
Транспорт воды и поддержание клеточного объёма
По определению, сама по себе полупроницаемая мембрана (а ею и является биологическая мембрана) не проницаема для воды. Более того, трансмембранный перенос воды — всегда пассивный процесс (через водные аквапориновые каналы как раз и происходит простая диффузия воды, но никаких специальных насосов для активного транспорта воды не обнаружено), осуществляемый через трансмембранные поры и каналы в составе других переносчиков и насосов. Тем не менее распределение воды между клеточными компартментами, цитозолем и органоидами клетки, между клеткой и интерстициальной жидкостью и её транспорт через биологические мембраны имеет огромное значение для гомеостаза клеток (в том числе для регулирования их объёма). Потокводычерезбиологическиемембраны(осмос)определяетразностьосмотическогоигидростатическогодавленийпообесторонымембраны.
· Осмос— поток воды через полупроницаемую мембрану из компартмента с меньшей концентрацией растворённых в воде веществ в компартмент с большей их концентрацией. Другими словами, вода перетекает оттуда, где её химический потенциал (Dmвода) выше, туда, где её химический потенциал ниже, так как наличие растворённых в воде веществ уменьшает химический потенциал воды.
Химический потенциал воды (Dmвода) зависит от разности концентрации воды по обе стороны мембраны.
· Осмотическоедавление(рис. 2–13) определяют как давление раствора, прекращающее его разведение водой через полупроницаемую мембрану. Численно осмотическое давление при равновесном состоянии (вода перестала проникать через полупроницаемую мембрану) равно гидростатическому давлению.
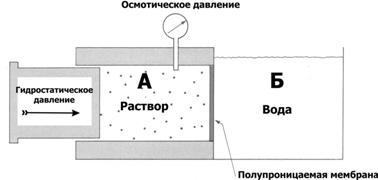
Рис.2–13.Осмотическоедавление [4]. Полупроницаемая мембрана разделяет отсеки А (раствор) и Б (вода). Осмотическое давление раствора измеряют в отсеке А. На раствор в отсеке А действует гидростатическое давление. При равенстве осмотического и гидростатического давлений устанавливается равновесие (вода не проникает через полупроницаемую мембрану). Осмотическое давление (p) описывает уравнениевант Хоффа.
Осмотическое давление (p) зависит от количества частиц в растворе (в частности, следует учитывать ионизацию вещества в растворе; так, примерно одинаковое осмотическое давление имеют 1 М раствор глюкозы, 0,5 М раствор NaCl и 0,33 M раствор CaCl2. В общем виде осмотическое давление описываетуравнениевантХоффа:
Уравнение2–8
p=RT(Fic)
где p =осмотическое давление, R — газовая постоянная, T — абсолютная температура, F — осмотический коэффициент определяют по специальным таблицам (значение F для электролитов в физиологических концентрациях обычно менее 1 и по мере разведения раствора приближается к 1), i — количество ионов, образующихся в растворе при диссоциации вещества, c — молярная концентрация вещества (в молях растворённого вещества в 1 л раствора).
· Осмотическийкоэффициент(F) (табл. 2–2) Значение F для электролитов в физиологических концентрациях обычно менее 1 и по мере разведения раствора F приближается к 1.
Таблица 2–2.Осмотическиекоэффициенты(F)некоторыхрастворов[4]
|
Вещество |
i |
Мол.масса |
F |
|
NaCl |
2 |
58,5 |
0,86 |
|
KC1 |
2 |
74,6 |
0,89 |
|
HC1 |
2 |
36,6 |
0,74 |
|
NH4Cl |
2 |
53,5 |
0,74 |
|
NaHCO3 |
2 |
84,0 |
0,58 |
|
NaNO3 |
2 |
85,0 |
1,01 |
|
CaCl2 |
3 |
111,0 |
0,86 |
|
MgCl2 |
3 |
95,2 |
0,89 |
|
Na2SO4 |
3 |
142,0 |
0,74 |
|
K2SO4 |
3 |
174,0 |
0,74 |
|
MgSO4 |
2 |
120,0 |
0,58 |
|
Глюкоза |
1 |
180,0 |
1,01 |
|
Сахароза |
1 |
342,0 |
1,02 |
|
Мальтоза |
1 |
342,0 |
1,01 |
|
KH2PO4 |
2 |
136,0 |
1,01 |
|
Лактоза |
1 |
342,0 |
1.01 |
· Осмоляльность. Термины «осмоль» и «осмоляльность» — внесистемные единицы.Осмоль(Осм) — молекулярная масса растворённого вещества в граммах, делённая на число ионов или частиц, на которые оно диссоциирует в растворе.Осмоляльность(осмотическая концентрация) — cтепень концентрации раствора, выраженная в осмолях, аосмоляльностьраствора(Fic) выражают в осмолях на литр.
· Осмотичностьрастворов. В зависимости от осмоляльности растворы могут быть изоосмотическими, гипер- и гипоосмотическими (иногда применяют не совсем корректный термин «–тонический», справедливый для простейшего случая — для электролитов). Оценка осмотичности растворов (или цитозоля и межклеточной жидкости) имеет смысл только при сравнении двух растворов (например, А и Б, цитозоля и межклеточной жидкости, инфузионных растворов и крови). В частности, вне зависимости от осмоляльности двух растворов между ними происходит осмотическое перемещение воды до достижения равновесного состояния. Такая осмотичность известна какэффективнаяосмотичность(тоничность для раствора электролитов).
ИзоосмотическийрастворА: осмотическое давление растворов А и Бодинаково.
ГипоосмотическийрастворА: осмотическое давление раствора Аменьшеосмотического давления раствора Б.
ГиперосмотическийрастворА: осмотическое давление раствора Абольшеосмотического давления раствора Б.
· Кинетикатранспортаводычерез мембрану линейна, не насыщаема и является функцией суммы движущих сил транспорта (Dmвода, сумма), а именно разницы химического потенциала по обе стороны мембраны (Dmвода) и разницы гидростатического давления (Dmдавление воды) по обе стороны мембраны.
Уравнение2–9
Dmвода, сумма=Dmвода+Dmдавление воды,т.е.:
Уравнение2–10

где R — газовая постоянная, T — абсолютная температура, P — гидростатическое давление, Vw— объём, занимаемый 1 молем воды.
Из практических соображений концентрации осмотически активных веществ выражают в обратных значениях (осмоляльность).
· Осмотическоенабуханиеиосмотическоесморщиваниеклеток. Состояние клеток при изменении осмотичности раствора электролита, в котором взвешены клетки, рассмотрено на рис. 2–14.

Рис.2–14.СостояниевзвешенныхвраствореNaClэритроцитов[4]. По абсциссе: концентрация (С) NaCl (мМ), по ординате: объём клеток (V). При концентрации NaCl 154 мМ (308 мМ осмотически активных частиц) объём клеток такой же, как и в плазме крови (изотоничныйэритроцитам раствор NaCl, С0, V0), При увеличении концентрации NaCl (гипертоничныйраствор NaCl) вода выходит из эритроцитов, и они сморщиваются. При уменьшении концентрации NaCl (гипотоничныйраствор NaCl) вода входит в эритроциты, и они набухают. При гипотоничности раствора, примерно в 1,4 превышающей значение изотоничного раствора, происходит разрушение мембраны (лизис).
· Регуляцияобъёмаклеток. На рис. 2–14 рассмотрен простейший случай — взвесь эритроцитов в растворе NaCl. В этом модельном экспериментеinvitroполучены такие результаты: если осмотическое давление раствора NaClувеличивается, то вода покидает клетки путём осмоса, а клетки сморщиваются; если осмотическое давление раствора NaClуменьшается, вода поступает в клетки, и клетки набухают. Но ситуацияinvivoсложнее. В частности, клетки находятся не в растворе единственного электролита (NaCl), а в реальном окружении множества ионов и молекул с разными физико-химическими характеристиками. Так, плазматическая мембрана клеток не проницаема для многих вне- и внутриклеточных веществ (например, белков), а также и потому, что в рассмотренном выше случае не учитывался заряд мембраны.
Сморщиваниеклетки. Приувеличениивнеклеточной осмоляльности (гиперосмоляльность, что, например, происходит при добавлении не проникающего через мембрану маннитола), силы осмоса выводят воду из клеток. Клетки продолжают сморщиваться до тех пор, пока осмоляльность вне- и внутри клеток не уравнивается (эффективнаяосмоляльность). Однако, при этом процессе (сморщивание) клетки включают регуляторные механизмы восстановления исходного состояния: происходит активация Na+,H+–обменника (поглощение клеткой Na+сопровождается выбросом из клетки H+). В результате цитозользащелачивается(происходит сдвиг значения pH в щелочную сторону), что приводит к активации Cl–,НСО2–-обменника (Cl–поступает в цитозоль, НСО2–выходит из клетки). Одновременно включается Na+,K+,CI–‑котранспортёр, переносящий ионы в цитозоль. Суммарный эффект работы этих трансмембранных переносчиков состоит в увеличении внутриклеточных концентраций Na+и Cl–, т.е. в увеличении внутриклеточной осмоляльности, что неизбежно приводит к увеличению потока воды в клетку и тенденции к восстановлению нормального объёма клетки.
Набуханиеклетки. Приуменьшениивнеклеточной осмоляльности (гипоосмоляльность, что, например, происходит при гидратации межклеточного пространства), силы осмоса направляют потоки воды в клетку. Клетки продолжают набухать до тех пор, пока осмоляльность вне- и внутри клеток не уравнивается (эффективнаяосмоляльность). Однако, при этом процессе (набухание) клетки включают регуляторные механизмы восстановления исходного объёма: активируются Cl–- и K+‑каналы и K+,Cl–‑котранспортёр. В результате ионы K+и Cl– по их электрохимическому градиенту выходят из клетки и «тянут» за собой воду (см. в книге рис. 9–12). Суммарный эффект состоит в уменьшении внутриклеточной осмоляльности, что неизбежно приводит к увеличению потока воды из клетки и тенденции к восстановлению нормального объёма клетки.
Таким образом, сочетанная работа ряда каналов и переносчиков, а также Na+,K+‑насоса позволяет клеткам регулировать их объём путём трансмембранного уравнивания осмоляльности (эффективная осмоляльность) клетки и межклеточного пространства. Однако, осмоляльность учитывает концентрацию частиц в растворе, но не их заряд. Распределение заряженных частиц по обе стороны мембраны описывает уравнениеГиббса–Доннана.
РавновесиеДоннана. Клетка содержит белки, органические полифосфаты, нуклеиновые кислоты и другие заряженных веществ, не проникающих через плазматическую мембрану. Большинство таких веществ при физиологических значениях pH несёт отрицательный заряд. Равновесное состояние (точнее состояние динамического равновесия) таких ионов (вне зависимости от их трансмембранной проницаемости) рассмотрено на рис. 2–15 и сопровождающего рисунок уравнения 2–11 (равновесиеГиббса–Доннана).

Рис.2–15.РавновесиеГиббса–Доннана[4]. В разделённых полупроницаемой мембраной отсеках А и Б находятся в растворе: проникающий через мембрану NaCl (ионы Na+и Cl–) и непроницаемые, но отрицательно заряженные ионы вещества X (X–).I— до установления равновесия.II— после установления равновесия.
На рис. 2–15(I) полупроницаемая мембрана отделяет раствор KCl в отсеке Б от смеси катионов K+и анионов X–в отсеке А. Мембрана проницаема для воды, K+и Cl–. Поскольку [Cl–]Бпревышает [Cl–]А, Cl–проникает из отсека Б в отсек А. В результате отрицательно заряженные ионы Cl–создают трансмембранную разность электрического потенциала — DmCl–(сторона А заряжена отрицательно). Эта разность (доннановские силы) заставляет K+перемещаться из отсека Б в отсек А. Через какое-то время для K+and Cl–устанавливается равновесиеДоннана:
Уравнение2–11
[K+]А[Cl–]А=[K+]Б[Cl–]Б
В уравнении 2–11 K+и Cl–(но не X–) находятся в состоянии электрохимического равновесия и, следовательно, удовлетворяют уравнению Нернста (уравнение 2–13), из которого можно рассчитать Dm как для K+, так и для Cl–:
Уравнение2–12
EА—EБ=-60мВ´log(2)=-18мВ
Непроницаемый анион Y–создаёт электрический потенциал на стороне мембраны, обращённой к отсеку А. В реальных клетках вклад непроницаемых анионов в МП составляет примерно –10 мВ.
Заключение. Ниже суммированы данные о регуляции распределения воды между компартментами, разделёнными полупроницаемой мембраной (в том числе между клетками и внеклеточным веществом).
· Поскольку клетка содержит не проходящие через мембрану отрицательно заряженные белки, доннановские силы приводят к набуханию клетки.
· Клетка реагирует на внеклеточную гиперосмоляльность накоплением в ней органических растворённых веществ.
· Градиент тоничности (эффективная осмоляльность) обеспечивает осмотический ток воды через мембрану.
· Вливание изотоничных солевых и бессолевых растворов (5% глюкозы), а также введение NaCI (эквивалентно изотоничному солевому раствору) увеличивает объём межклеточной жидкости, но имеет разные эффекты на объём клеток и внеклеточную осмоляльность. В нижеследующих примерах все расчёты проведены из следующих начальных значений: вся вода организма — 42 л (60% организма мужчины массой 70 кг), внутриклеточная вода — 25 л (60% всей воды), внеклеточная вода — 17 л (40% всей воды). Осмоляльность внеклеточной жидкости и внутриклеточной воды составляет 290 мОсм.
Изотоничныесолевыерастворы. Вливание изотоничного солевого раствора (0.9% NaCI) увеличивает объём межклеточной жидкости, но не влияет на объём внутриклеточной жидкости.
Влито 1,5 л изотоничного 0.9% раствора NaCI (физиологический раствор). Эффективная осмоляльность этого раствора — 290 мОсм в межклеточной жидкости. Эти 1,5 л увеличивают объём межклеточной жидкости на 1,5 л. Поскольку эффективная осмоляльность межклеточной жидкости не изменяется, не происходит и изменений трансмембранного градиента этого показателя; поэтому поступившая жидкость не перемещается ни в клетку, ни из неё. Таким образом, вливание изотоничного солевого раствора — эффективный способ увеличения объёма межклеточной жидкости без изменений объёма внутриклеточной жидкости. В тоже же время удаление изотоничного солевого раствора из организма уменьшит объём межклеточной жидкости, но не повлияет на объём внутриклеточной жидкости.
Изотоничныебессолевыерастворы. Приём 1,5 л воды или вливание изотоничного бессолевого раствора (5% глюкозы) увеличивает как объём межклеточной, так и внутриклеточной жидкости.
Выпито 1,5 л воды (или влито 1,5 л изотоничного [5%] раствора глюкозы, что эквивалентно 1,5 л выпитой воды, так как глюкоза распадается в организме на СО2и воду). Эти 1,5 л воды распределяются в межклеточной жидкости и увеличивают её объём от 17 до 18,5 л. Поступившая вода приводит к разведению растворённых в межклеточной жидкости веществ, что приводит к уменьшению омоляльности межклеточной жидкости с 290 мОсм до 266 мОсм (290 мОсм´[17¸18,5] = 266 мОсм). Так как внутриклеточная осмоляльность остаётся сначала на прежнем уровне (290 мОсм), между межклеточной жидкостью и внутриклеточной жидкостью возникает градиент осмоляльности, что приводит к перемещению воды из межклеточной жидкости в клетку. Перемещение воды в клетку продолжается до установления эффективной осмоляльности (280 мОсм), поэтому не вся вновь поступившая в организм вода перемещается в клетку (из 1,5 л 0,6 л остаётся в межклеточной жидкости). Начальная осмоляльность всей воды 12 180 мОсм (290 мОсм´42 л), конечная осмоляльность 43,5 л (42+1,5) — 280 мОсм (12 180¸43,5).
Хлориднатрия. Введение в организм NaCI (эквивалентно изотоничному солевому раствору) увеличивает объём межклеточной воды, но уменьшает объём внутриклеточной воды.
Введено количество NaCI, эквивалентное содержащемуся в 1,5 л физиологического раствора (1,5 л ´ 290 мОсм = 435 мОсм), но вода не введена. Сначала эти 435 мОсм NaCI распределяются в 17 л межклеточной жидкости и увеличивают её суммарную осмоляльность: от начальной в 4930 мОсм (290 мОсм´17 л) до 5365 мОсм. В результате осмоляльность межклеточной жидкости увеличивается от 290 мОсм до 316 мОсм (5365¸17). Возникшая гиперосмоляльность перемещает воду из клеток в межклеточной жидкость, устанавливая новое значение эффективной осмоляльности в 300 мОсм (суммарная начальная осмоляльность всей воды организма — 12 180 мОсм + 435 мОсм = 12 615 мОсм в 42 л; отсюда 12 615¸42 = 300 мОсм). Количество перемещённой из клеток в межклеточную жидкость воды составляет 0,9 л, на эти же 0,9 л уменьшается объём внутриклеточной воды (происходит сморщивание клеток).
Содержание Na+во всей воде организма определяет объём внеклеточной жидкости, а вся вода организма определяет её осмоляльность.
