- •Обмен гемоглобина
- •Эритроциты у взрослых образуются (эритропоэз) преимущественно в
- •Эпо синтезируется главным образом почками и скорость его секреции в кровоток увеличивается при
- •В процессе дифференцировки клетка приобретает способность синтезировать свой главный белок – гемоглобин, постепенно
- •В норме у взрослых мужчина - 4.6-6.2 миллионов эритроцитов /мкл крови, а у
- •«Стареющие» эритроциты захватываются клетками РЭС( селезенка, костный мозг и печень), где разрушаются. Образующиеся
- •Время жизни 120 дней (110-130). Поверхность всех эритроцитов 3800 м2. Общее количество 25XI012.
- •Эритроцит
- •Эритроцит является осмометром, ,который набухает и сжимается при увеличении и снижении осмотического давления.
- •Эритроциты легко меняют свою форму. Архитектура мембраны эритроцитов определяет ее механические свойства. Благодаря
- •Состав мембраны эритроцитов
- •Белки эритроцита
- •Метаболизм эритроцита
- •Метаболические процессы в эритроцитах отличаются рядом особенностей
- •Глюкоза в эритроцитах используется в основном в гликолизе и ПФП.
- •глюкоза
- •Большинство белков мембраны являются гликопротеинами и являются интегральными белками мембраны.Что касается белков без
- •Гемоглобин –главный белок цитозоля эритроцитов
- •Спектрин главный белок цитоскелета является димером из двух длинных (100 нм в длину)
- •Последние - особенно активны и могут вступать в реакции с белками, нуклеиновыми кислотами,
- •Ферменты АОЗ в Эритроцитах
- •Перекись водорода, образующаяся в этих реакциях, может разрушаться разными путями. В эритроцитах эту
- •ПФП окисления глюкозы в эритроцитах выполняет важную роль в поставке восстановительных эквивалентов системам,
- •В Э есть рудименты ЦТК- ферменты- изоцитрат ДГ, малат ДГ, а также АсАТ,
- ••Шунт Раппопорта конкурентно вытесняет О2 из HbO2 при состоянии гипоксии в ткани, а
- •глюкоза
- •Гем – небелковая часть гемоглобина.
- •Следующий этап катализируется уропорфилиноген –I-синтазой или дезаминазой ПБГ. Дезаминаза ПБГ вначале из двух
- •Причинами гемолитической анемии могут быть нарушения структурных белков мембран.
- •При отклонении значений ниже указанных говорят о гипохромной анемии ( недостаток
- •Гем – главный регулятор количества АЛК синтазы в клетке.
- •Температура, значение pН и парциальное давление CO2 влияют на кривые поглощения кислорода
- •Повышение отдачи 02 в кислой и богатой C02 областях ткани, биологически так же
- •2.3-дифосфоглицерат сдвигает кривую насыщения гемоглобина кислородом вправо
- •Гипоксия ведет к повышению уровня 2,3 дифосфоглицерата в эритроцитах. Изменение рН
- •Защелачивание внутри эритроцитов ведет к повышению активности ФФК и усилению образования 1,3-ДФГ, а
- •Эритроциты постоянно разрушаются, заменяясь новыми. Суточный распад- 20 мл Э, т.е. 0.85% всей
- •Распад Э начинается в периферической крови и заканчивается в клетках РЭС, где образуется
- •Образующийся при распаде гемоглобина билирубин поступает в
- •Клетками РЭС и кровью билирубин переносится к печени. Билирубин переносится в соотношении --1моль
- •Непрямой билирубин
- ••Попадая в печень, билирубин ковалентно связывается с 2 молекулами УДФ -глюкуроновой кислоты, образуя
- •Т.о. в клетках РЭС в частности в печени происходит распад :
- •Часть уробилиногена 75-80% переходит в стеркобилиногенен--- стеркобилин.
- •• Экспериментально доказано, что организм образует на 10-15% больше Б и соответственно Уробилина,
- •Определение содержания желчных пигментов в крови и моче играет
- •• Неконьюгированный, непрямой Б – липофилен. Он имеет сродство к мембранам, легко растворяется
- •Т.о. в клетках РЭС в частности в печени происходит распад :
- •Этот конъюгат легко диссоциирует, он быстро фильтруются в почках, и появляется в моче,
- •Изменение содержания желчных пигментов
- •Печеночная желтуха связана с
- •2.Конъюгирование Б в связи с врожденным дефектом УДФ- глюкуронилтрансферазы.
- •Надпеченочная желтуха
Последние - особенно активны и могут вступать в реакции с белками, нуклеиновыми кислотами, липидами, и другими молекулами, изменяя их структуру, что в конечном итоге приводит к нарушению функции клетки. Супероксидный анионный радикал может спонтанно дисмутировать с образованием H2O2 и O2; однако, скорость этой реакции значительно увеличивается под влиянием супероксид дисмутазы (СОД).
Ферменты АОЗ в Эритроцитах
-Это глютатионредуктаза,
-метгемоглобин редуктаза
-глутатионпероксидаза.
GluSH защищает ферменты Э от окисления по цистеиновым группам:
Glus-sulG----- 2GluSH ( Se- зависимая)
Hb(Fe++) + O2----- |
MetHb(Fe+++) + O2- |
O2- + 2H+ ---------- |
H2O2 |
Аналогично работают каталаза и СОД
Перекись водорода, образующаяся в этих реакциях, может разрушаться разными путями. В эритроцитах эту функцию выполняют фермент каталаза, превращая
перекись в H2O и O2, и, содержащий селен фермент глютатионпероксидаза, который
катализирует распад пероксида водорода, с образованием воды, окисляя глутатион. В присутствии Fe2+, пероксид водорода без участия ферментов распадается с образованием гидроксильных радикалов. Эти процессы могут значительно усиливаться при поступлении больших количеств железа.
ПФП окисления глюкозы в эритроцитах выполняет важную роль в поставке восстановительных эквивалентов системам, разрушающим активные формы кислорода. Врожденная недостаточность дегидрогеназы глюкозо-6-фосфата одно из наиболее распространенных и известных причин гемолитической анемии.
Описано свыше 300 генетических вариантов этого фермента и свыше 100 млн людей страдают от этого заболевания. Поступление в организм таких людей веществ, способствующих образованию пероксида водорода или супероксидного аниона кислорода вызывает активное потребление восстановленного глутатиона в глутатионпероксидазной реакции, а недостаточность дегидрогеназы глюкозо-6-фосфата не позволяет регенерировать глутатион и клетка подвергается окислительному стрессу, который завершается нарушением структуры липидов мембран и гемолизом.
В Э есть рудименты ЦТК- ферменты- изоцитрат ДГ, малат ДГ, а также АсАТ, АлАТ, Mg++ и Na-K-АТФ-азы. В Э есть восстановленный GluSH, необходимый для АОЗ.
В Э наблюдается биосинтез ЖК.
ХС в Э не синтезируется, но происходит быстрый обмен с ХС-содержащими фракциями ЛП крови.
Э может использовать уже готовые пурины. Только в Э работает шунт Раппопорта,
образование 2,3 ДФГК- является своеобразным депо
•Шунт Раппопорта конкурентно вытесняет О2 из HbO2 при состоянии гипоксии в ткани, а 2,3 ДФГ сдвигает кривую насыщения Hb кислородом вправо.

глюкоза
1,3-дифосфоглицерат 2,3-дифосфоглицератмутаза
АДФ
2,3-дифосфоглицерат
АТФ
3-фосфоглицерат дифосфоглицератфосфатаза
2-фосфоглицерат

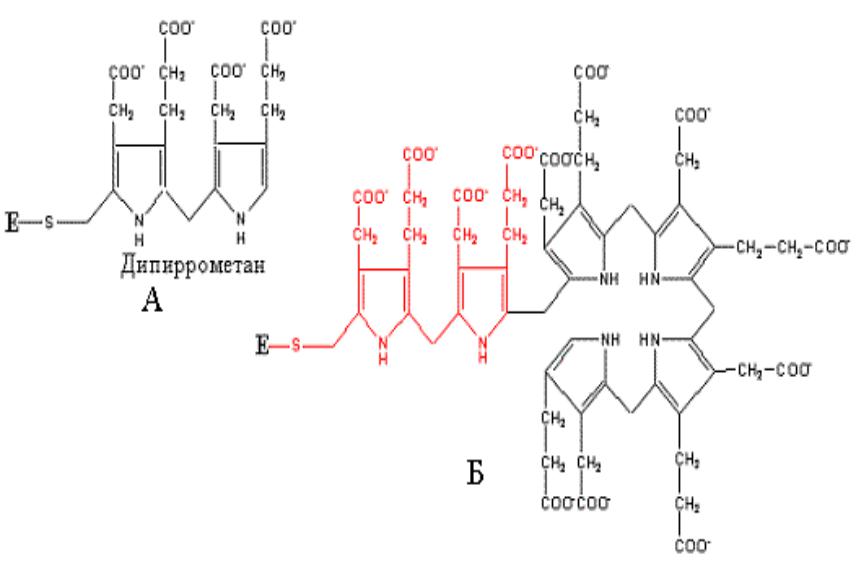
Гем – небелковая часть гемоглобина.
Гем представляет собой производное порфирина, связанное с железом.
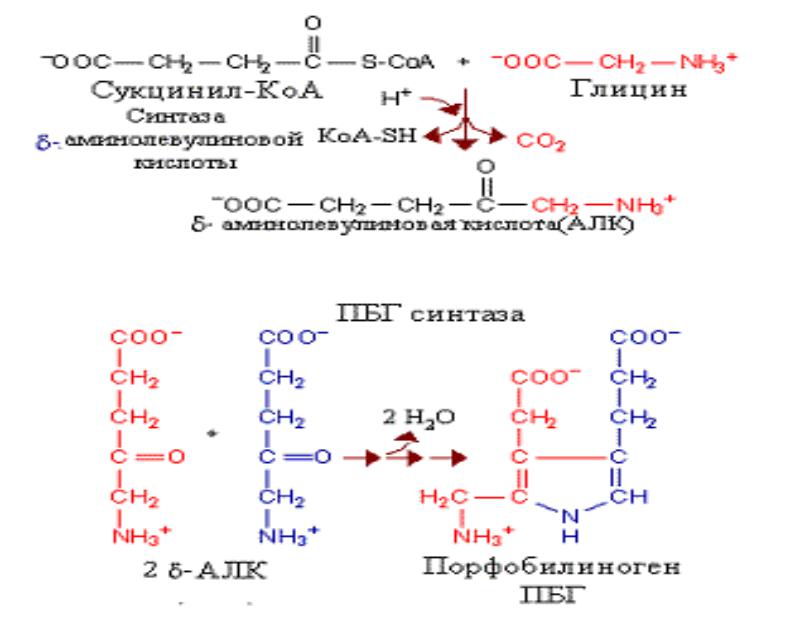
АЛК-дегидратазу называют также синтазой ПБГ. Этот фермент связывает восемь атомов Zn 2+, четыре из которых участвуют в механизме катализа. Zn2+-связывающие домены содержат цистеин и могут также связывать Pb2+, что вызывает торможение активности фермента. Повышенный уровень AЛК в крови является причиной некоторых неврологических проявлений отравления свинцом. Высокие уровни AЛК являются результатом наследственного дефицита некоторых ферментов пути синтеза гема. AЛК оказывает токсический эффект прежде всего на мозг, что по-видимому связано со структурным подобием AЛК с нейромедиатором g-аминомасляной кислотой. При аутоокислении AЛК образуются активные формы кислорода.