
- •Глава 15. Растворы электролитов
- •15.1. Электролитическая диссоциация
- •15.2. Сольватация ионов
- •15.3. Активности и коэффициенты активности электролитов
- •15.4. Теория растворов сильных электролитов
- •15.5. Расчет коэффициентов активности ионов
- •15.6. Слабые электролиты. Термодинамическая константа диссоциации
- •15.7. Единая количественная теория диссоциации электролитов
15.5. Расчет коэффициентов активности ионов
Одним из важных следствий, вытекающих из основного уравнения, является возможность расчета коэффициентов активности ионов. Учитывая связь энергии межионного взаимодействия с коэффициентами активности (уравнение (15.36)), получаем:
![]() . (15.58)
. (15.58)
Подставим сюда значение из уравнения (15.46):
![]() . (15.59)
. (15.59)
В этом уравнении
концентрация выражена числом ионов niв 1 см3раствора. Эта величина
связана с молярной концентрациейci:![]() ,
(где NА– число Авогадро), тогда
,
(где NА– число Авогадро), тогда
![]() . (15.60)
. (15.60)
Преобразуем это
уравнение, вводя в него ионную силу
![]() ,
переходя к десятичным логарифмам и
обозначив
,
переходя к десятичным логарифмам и
обозначив
![]() . (15.61)
. (15.61)
После этих подстановок уравнение для коэффициентов активности ионов принимает вид:
![]() . (15.62)
. (15.62)
Уравнение Дебая – Гюккеля (15.62) дает возможность рассчитать коэффициенты активности отдельного вида ионов, но экспериментально можно определять лишь средние ионные коэффициенты активности. Поэтому для опытной проверки уравнения нужно перейти к средним ионным коэффициентам активности. Исходя из их определения (уравнение (15.24)), получим
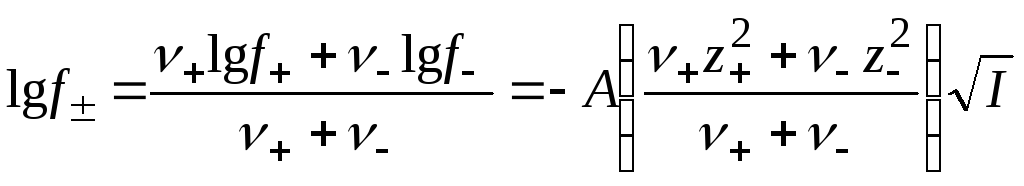 . (15.63)
. (15.63)
Учитывая, что система в целом электронейтральна, т.е. |+z+| = |–z–|, выражение в скобках представим в форме
![]() (15.64)
(15.64)
и окончательно получаем
![]() . (15.65)
. (15.65)
Это уравнение совпадает с эмпирически установленной закономерностью и является теоретическим обоснованием правила ионной силы Льюиса – Рендалла. Экспериментальная проверка уравнения (15.65) показала, что оно справедливо только для разбавленных растворов электролитов (I0,01 – 0,02), при больших концентрациях наблюдаются значительные расхождения экспериментально определяемых величин с теоретически рассчитанными.
Ограниченность теории Дебая – Гюккеля предопределена, прежде всего, недостатками самой модели, использованной при создании теории.
Согласно модели, рассматривается только электростатическое межионное взаимодействие, которое вместе с тепловым движением приводит к образованию сферической ионной атмосферы. Это допущение справедливо только для разбавленных растворов. Увеличение концентрации приводит к уменьшению межионного расстояния, начинают проявляться силы межмолекулярного взаимодействия, например, силы Ван-дер-Ваальса, а размер ионной атмосферы становится соизмеримым с размерами самого иона. В этом случае уже нельзя рассматривать ионы как точечные заряды.
При расчетах используется разложение показательной функции в ряд с ограничением двумя или одним членом разложения, что соответствует ограничению разбавленными растворами.
Допущение о равенстве диэлектрической проницаемости раствора диэлектрической проницаемости растворителя также справедливо только для разбавленных растворов. Наконец, в теории не учитывается взаимодействие ионов с растворителем.
Все это приводит к тому, что теория оказывается применимой к очень разбавленным растворам и уравнение (15.65) является первым приближением, илипредельным закономтеории Дебая – Гюккеля. Попытки усовершенствования теории предпринимались как Дебаем и Гюккелем, так и другими исследователями. Вовтором приближенииавторы теории учли, что ионы имеют конечные размеры, и расстояние между ними не может быть меньше некоторой минимальной величины. Полученное во втором приближении выражение для коэффициентов активности имеет вид:
![]() , (15.66)
, (15.66)
где
![]() ,a– расстояние наибольшего сближения
ионов. Эту величину можно рассматривать
как средний эффективный диаметр ионов.
Значениеaтеоретически не вычисляется,
а подбирается эмпирически.
,a– расстояние наибольшего сближения
ионов. Эту величину можно рассматривать
как средний эффективный диаметр ионов.
Значениеaтеоретически не вычисляется,
а подбирается эмпирически.
На практике часто используют также полуэмпирическое уравнение
![]() , (15.67)
, (15.67)
где C– эмпирическая постоянная. Это уравнение описывает зависимость коэффициентов активности от ионной силы в довольно широкой области концентраций.
