
- •Министерство образования и науки Украины
- •49600, Днепропетровск-5, пр. Гагарина, 4 введение в физический практикум Физический практикум и этапы его выполнения
- •Краткие сведения по теории погрешностей
- •При косвенных измерениях (если не требуется оценка вклада погрешностей каждого вида измерений) расчет погрешности осуществляется так же, как и для прямых измерений.
- •Лабораторная работа №1 Изучение основного закона динамики вращательного движения твердого тела на маятнике Обербека
- •1. Теория метода.
- •2. Устройство установки.
- •3. Порядок выполнения работы.
- •4. Математическая обработка результатов измерений.
- •Лабораторная работа №1- к
- •2. Устройство установки.
- •3. Порядок выполнения работы.
- •4. Математическая обработка результатов измерений.
- •Лабораторная работа № 2 Определение отношения теплоемкостей воздуха по методу Клемана – Дезорма
- •1. Теория метода.
- •2. Устройство установки.
- •3. Порядок выполнения работы и обработки результатов измерений.
- •Лабораторная работа № 2-к
- •2. Устройство установки.
- •3. Порядок выполнения работы и обработки результатов измерений.
- •Лабораторная работа №3-к (Компьютерный вариант) Исследование зависимости коэффициента полезного действия источника тока и полезной мощности тока от силы тока
- •1. Теория метода.
- •2. Устройство установки.
- •3. Порядок выполнения работы и обработки результатов измерений.
- •Лабораторная работа № 4-к (Компьютерный вариант) Определение индуктивности катушки
- •2. Устройство установки.
- •3. Порядок выполнения работы.
- •4. Математическая обработка результатов измерений.
Лабораторная работа № 2-к
(Компьютерный вариант)
Определение
отношения теплоемкостей
![]() воздуха
воздуха
по методу Клемана – Дезорма
Цель
работы:
Определение отношения теплоемкостей
![]() воздуха и сравнение полученного значения
с теоретическим.
воздуха и сравнение полученного значения
с теоретическим.
1. Теория метода.
Согласно молекулярно-кинетической теории молярные теплоемкости идеального газа при постоянном давлении Cp и постоянном объеме Сv зависят только от числа степеней свободы молекулы и выражаются формулами:
![]()
![]()
где i - число степеней свободы молекул газа (для одноатомного газа i=3, для двухатомного газа i=5, для многоатомного газа i=6);
R - универсальная газовая постоянная.
Отношение этих теплоемкостей равно:
![]() (1)
(1)
Безразмерная величина , которая называется показателем адиабаты или коэффициентом Пуассона, является важной характеристикой газа. В частности, она входит в уравнение Пуассона для адиабатического процесса:
![]() (2)
(2)
процесса, который происходит без теплообмена с окружающей средой. Практически все быстро протекающие процессы близки к адиабатическому.
Метод экспериментального нахождения значения , предложенный Клеманом и Дезормом, основан на последовательном переводе газа из состояния 1 в состояние 2 путем адиабатического расширения, а затем из состояния 2 в состояние 3 путем изохорного нагрева (рис.1). Эти процессы на диаграмме p – Т представлены кривыми 1 - 2 и 2 – 3 соответственно.


Рис.1. Графики газовых процессов в методе определения
отношения
![]() .
.
В сосуд при комнатной температуре Т0 нагнетается некоторое количество воздуха, в результате чего в сосуде установится давление р1, которое будет превышать атмосферное давление р0 на величину, равную р1 . Таким образом, начальное состояние воздуха 1 характеризуется параметрами Т0 и р1 (рис.1).
Если теперь быстро открыть и закрыть сосуд с воздухом, произойдет адиабатическое расширение воздуха (процесс 1 – 2), в результате которого воздух охладится, а его давление уравняется с атмосферным. Таким образом, состояние 2 будет характеризоваться новыми параметрами Т1 и р0 .
Через некоторое время воздух, находясь в закрытом сосуде, нагреется вследствие теплообмена с окружающей средой и перейдет из состояния 2 в состояние 3 (изохорный процесс) с параметрами Т0 и р3 . Давление р3 будет превышать атмосферное давление р0 на величину, равную р3 .
Используя уравнение Пуассона (2) и уравнение Менделеева-
Клапейрона pV = (m/M)RT, получим следующее соотношение между параметрами состояния воздуха 1 и 2 (рис.1):
 (3)
(3)
Отсюда:
 (4)
(4)
Применяя закон Шарля для изохорного процесса, запишем следующее соотношение между параметрами состояния воздуха 2 и 3:
 (5)
(5)
Из равенств (4) и (5) следует:
 (6)
(6)
После логарифмирования уравнения (6) получим выражение для определения значения :
 (7)
(7)
Принимая во внимание, что р1 = р0 + р1 , а р3 = р0 + р3 , формула (7) примет следующий вид:
 (8)
(8)
Величины р1/р0 и р3/р0 много меньше единицы. Тогда, используя приближенную формулу ln(1+x)=x, справедливую для малых значений х, получим:
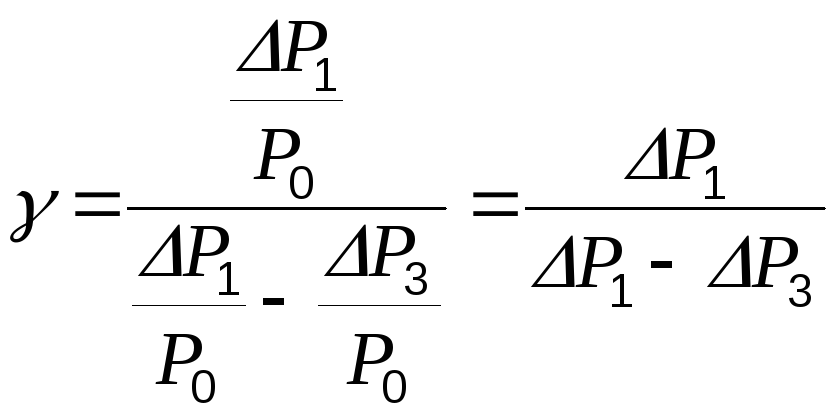 (9)
(9)
В данной лабораторной работе избыточные давления воздуха в сосуде р1 и р3 измеряются манометром (U- образной трубкой, заполненной подкрашенной водой) как разность уровней воды в его коленах. Заменяя р1 и р3 соответственно на gh1 и gh3 и сокращая на g, получим простую рабочую формулу для вычисления значения для воздуха:
 (10)
(10)
Таким образом,
для определения отношения теплоемкостей
воздуха
![]() достаточно осуществить процесс 1 – 2 –
3 (рис.1) и при этом измерить только
показанияU-
образного манометра в состояниях воздуха
1 и 3.
достаточно осуществить процесс 1 – 2 –
3 (рис.1) и при этом измерить только
показанияU-
образного манометра в состояниях воздуха
1 и 3.
