
Lectures.Part.2
.2.pdfНаціональний університет «Львівська політехніка» Кафедра фізичної та колоїдної хімії
Павловський Юрій Павлович
ФІЗИЧНА ТА КОЛОЇДНА ХІМІЯ
(частина 2.2) конспект курсу лекцій
для студентів стаціонарної форми навчання базового напряму
6.120201 «Фармація»
Львів-2011
2
Модуль 4 Колоїдний стан речовини
Вступ
Стан речовини на межі розділу фаз. Поверхнева енергія. Високодисперсний стан – особлива форма існування матерії. Предмет колоїдної хімії.
Серед великого розмаїття об’єктів природи особливе місце займають дисперсні системи: гетерогенні системи, в яких хоча б одна з фаз знаходиться у подрібненому стані.
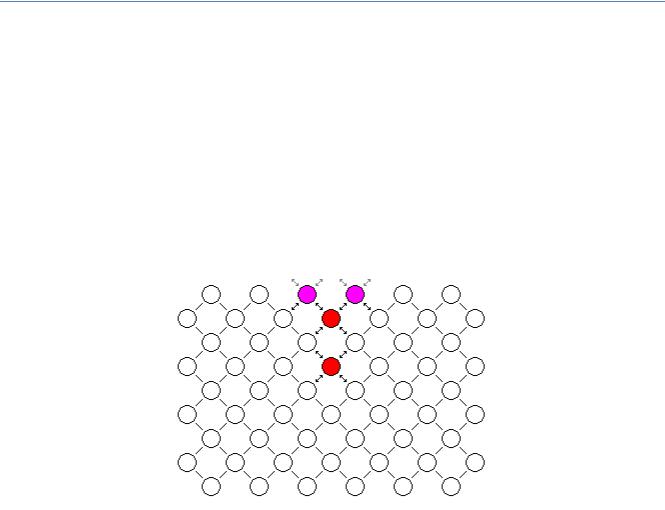
В гетерогенних системах фази розділені поверхнею. Властивості речовини на міжфазовій поверхні відрізняються від її властивостей в об’ємі фази. Це зумовлено тим, що всередині об’єму кожна молекула взаємодіє з певною кількістю подібних до себе молекул, а в поверхневому шарі, або з меншою кількістю подібних молекул, або з молекулами іншої природи (рідина/тверде тіло, рідина/пара…).
Рис.1.Молекули на поверхні взаємодіють з меншим числом молекул ніж ті, що знаходяться в об’ємі фази
Чим більша різниця міжмолекулярних сил, що діють в кожній з фаз, тим більша потенціальна енергія міжфазової поверхні – поверхнева енергія. Ця енергія проявляє себе у вигляді поверхневого (міжфазового натягу).
При утворенні нової поверхні слід виконати роботу проти сил взаємодії між сусідніми шарами молекул в об’ємі речовини. Наприклад, для поділу шматка крейди на два менші слід виконати певну роботу, значно більше роботи треба буде витратити для розмелювання цього шматка в порошок… Робота утворення одиниці поверхні поділу фаз називається вільною питомою поверхневою ене-
ргією (позначають – σ, одиниці вимірювання – Дж/м2 або Н/м).
Для межі рідина/повітря, цю величину називають також поверхневим натягом, для межі тверде тіло/рідина, рідина/рідина – пограничним натягом.
Величина поверхневого натягу залежить від природи і концентрації речовин у суміжних фазах та температури.
Критерієм перебігу процесів в ізобарно-ізотермічних умовах є зміна енергії Гіббса. В загальному випадку для зміни потенціалу Гіббса системи можна записати:
dG = -SdT + VdP + σdS + Sdσ + Σμidni + φdq + …
© Ю.Павловський 2011
3
Де: S – ентропія;
S – площа міжфазової поверхні.
Складові рівняння (1) (σdS + Sdσ = dGs) характеризують процеси, що протікають на межі поділу фаз. Отже, потенціал Гіббса поверхні (Gs= σ*S) може змінюватись як за рахунок зміни поверхневого натягу, так і за рахунок зміни площі міжфазової поверхні.
Якщо поверхневий натяг постійний (σ = const, dσ=0), самочинно протікатимуть процеси, що приводять до зменшення площі поверхні:
dG = σdS<0 коли dS<0
Прикладами таких процесів є злипання частинок дисперсної фази, флокуляція, коагуляція. Якщо площа поверхні не змінюється (S = const, dS=0) – самочинно протікають процеси у яких зменшується поверхневий натяг:
dG = Sdσ<0 коли dσ<0
Зменшення поверхневого натягу супроводжує процеси адсорбції, адгезії, змочування. Оскільки, будь-яке фізичне тіло обмежене поверхнею, то поверхневі явища характерні для усіх без винятку систем, тобто, завжди слід розглядати потенціал Гіббса не тільки, як функцію температури, тиску чи складу розчину, а і як функцію площі поверхні. Інша справа, що в різних системах поверхневі явища відіграють різну роль.
З цієї точки зору висодисперсний стан речовини – якісно особлива форма, бо поверхневі явища в такому стані відіграють основну роль.
Збільшення питомої поверхні з ростом дисперсності і, як наслідок, зростання ролі поверхневих явищ – основа єдності розгляду дисперсних систем і поверхневих явищ. Ця єдність є змістом сучасної колоїдної хімії, яку можна назвати фізичною хімією дисперсних систем і поверхневих явищ.
Глянувши навколо себе побачимо, що більшість предметів, які нас оточують є полікристалічні, волокнисті, шаруваті тіла, або ж сипучі матеріали, або знаходяться у вигляді суспензій, емульсій, паст, пін і т.д. До них відносяться ґрунти, тіла рослинного і тваринного світу, повітря, хмари, тумани, продукти харчування, фармацевтичні препарати, будівельні матеріали, полімери, сплави і т.д. Усі ці тіла об’єднує те, що вони дисперсні і мають розвинуту поверхню. Таким чином об’єктами дослідження колоїдної хімії є реальні речовини і матеріали, реальний навколишній світ.
Хіміки технологи фармацевтичних виробництв у своїй повсякденні практиці стикаються з різноманітними речовинами, що знаходяться у високодисперсному стані. Аерозолі, емульсії, креми, мазі, мила, мікродраже, мікрокапсули, пасти, порошки, пудри, слизи, суспензії – ось далеко неповний перелік дисперсних лікарських форм, які виробляє сучасна фармацевтична промисловість. Знання властивостей дисперсних систем дозволяє технологу грамотно керувати технологічним процесом отримання діючих речовин та виготовлення лікарських засобів.
Колоїди – умовно виокремлений вид дисперсних систем
З посеред дисперсних систем історично виділяють колоїди, з яких почалось їх вивчення. Шотландський вчений Томас Грем (Thomas Graham , 1805-1869) вивчав здатність розчинених речовин дифундувати через проникну мембрану. Він спостеріг, що кристалічні речовини, такі як цукор, сечовина, кухонна сіль проходять через мембрану, в той час як інші – клей, желатин, гуміарабік не проходять. Одні він назвав «кристалоїди», інші - «колоїди» ( грецькою: κόλλα – клей, ειδούς – подібний). Грем вважав, що основною відмінності між поведінкою «кристалоїдів» та «колоїдів» є розмір їх частинок. Пізніше було встановлено, що будь-які речовини, незалежно від їх природи, можуть бути переведені в колоїдний стан шляхом диспергування (подрібнення) до частинок колоїдного розміру.
В істинних розчинах, таких як цукор чи сіль у воді, розчинені частинки подрібнені до окремих молекул або іонів і утворюють з розчинником гомогенну систему. Розмір частинок складає від 0,1 до 1 нм. З іншого боку в суспензіях, таких як пісок, цемент чи крохмаль, що розмішані з водою, подрібнені частинки є агрегатами мільйонів молекул, мають розмір більший 200 нм і
© Ю.Павловський 2011
4
утворюють окрему подрібнену (дисперсну) фазу гетерогенної системи. Колоїдні розчини (колоїдні дисперсії) є чимось середнім між істинними розчинами та грубо дисперсними системами. Іншими словами в колоїдних розчинах частинки мають розміри більші ніж в істинних розчинах, та менші ніж у суспензіях. Основною відмінністю колоїдів від істинних розчинів є наявність міжфазової поверхні між подрібненими частинками та розчинником (дисперсійним середовищем). Основна відмінність від грубодисперсних систем – колоїдні частинки не видно в оптичний мікроскоп, бо його роздільна здатність обмежена половиною довжини найкоротшої хвилі видимого спектру світла (λ=400÷760 нм).
Колоїди – мікрогетерогенні дисперсні системи, розміри частинок яких лежать в межах 1 – 200 нм. Речовина, розміри частинок якої лежать в межах 1 – 200 нм, знаходиться в колоїдному стані.
Колоїдні частинки можуть бути різними за формою:
сфери, призми, циліндри: стрептококи, дріжджі, кишкові палички…(системи, що містять такі частинки носять назву – корпускулярні);
диски, пластинки, плівки: слюда, еритроцити, мембрани клітин, … (ламінарні системи);
волокна: целюлоза, віскоза, м’язові волокна, аксони, капіляри... (фібрілярні системи).
Для класифікації стану речовини як колоїдного, достатньо, щоб лише один вимір – довжина, ширина чи товщина, був в приведених вище межах.
© Ю.Павловський 2011
5
Лекція 1. Класифікація дисперсних систем
Класифікація за розмірами частинок
Для кількісної характеристики дисперсних систем використовують такі поняття, як лінійний розмір, дисперсність та питома поверхня.
Дисперсністю називають величину, обернену до лінійного розміру а: d=1/a [м-1] .
Питома поверхня дисперсної системи це відношення сумарної площі поверхні частинок
системи до їх об’єму або маси:
Sпит = S/V [м-1],
або
Sпит =S/m [м2/кг].
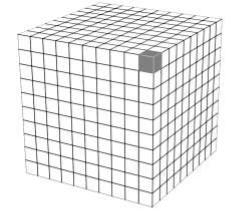
Розглянемо, як змінюється площа поверхні в процесі розділення частинки кубічної форми з ребром рівним 1 см (Рис.1.1).
Рис.1.1. Поділ куба на частинки з меншим у 10 разів ребром
Площа такої частинки: S = 6*a2 = 6*12 = 6 см2. Якщо кожне ребро розділити на 10 частин дістанемо 1000 частинок з ребром 0,1 см, а їх загальна площа становитиме S=6*1000*0,12 = 60 см2. При розмірі ребра а = 0,01 см – S = 600 см2, при а = 0,001 см – S = 6000 см2 і тд. Таким чином, при зменшенні лінійного розміру частинки у 10 разів, її дисперсність і питома поверхня у 10 разів зростає (табл.1.1).
Таблиця 1.1. Зміна дисперсності та питомої поверхні при поступовому подрібненні куба на n частинок з
ребром а
a, м |
n |
d, м-1 |
S, м2 |
V, м3 |
Sпит., м-1 |
1 |
1 |
1 |
6 |
1 |
6 |
0,1 |
103 |
10 |
60 |
1 |
60 |
0,01 |
106 |
100 |
600 |
1 |
600 |
0,001 |
109 |
1000 |
6000 |
1 |
6000 |
0,0001 |
1012 |
10000 |
60000 |
1 |
60000 |
В залежності від розподілу частинок дисперсної системи за розмірами розрізняють монодисперсні системи, які мають частинки однакового розміру, та полідисперсні – частинки мають різні розміри.
© Ю.Павловський 2011
6
Класифікація дисперсних систем за агрегатним станом дисперсної фази та дисперсійного середовища
В дисперсній системі розрізняють дисперсну фазу та дисперсійне середовище. Суцільна фаза дисперсної системи називається дисперсійним середовищем, подрібнені і розподілені в дисперсійному середовищі частинки складають дисперсну фазу.
Таблиця 1.2.
|
|
Типи дисперсних систем за агрегатним станом |
||
Назва |
Дисперсна |
|
Дисперсне |
Приклади |
фаза |
|
середовище |
||
|
|
|
||
|
|
|
|
|
_ |
газ |
|
газ |
Дисперсна система не утворюється, бо гази необмежено роз- |
|
чинні |
|||
|
|
|
|
|
Аерозоль |
рідина |
|
газ |
Водяний туман, кучові хмари, туман HCl, спрей, лік. аерозоль |
Аерозоль |
тверде тіло |
|
газ |
Дим: пічний, цигарковий, маскувальний |
Порошок |
тверде тіло |
|
газ |
Грубодисперсна система: крохмаль, борошно, какао, цемент, |
|
пудра |
|||
|
|
|
|
|
Піна |
газ |
|
рідина |
Мильна піна, крем вершковий, пінка косметична, лікувальна |
|
пінка («пантенол») |
|||
|
|
|
|
|
Емульсія |
рідина |
|
рідина |
Майонез, сметана, молоко, клей ПВА, водоемульсійна фарба, |
|
молочний сік рослин |
|||
|
|
|
|
|
Золь |
тверде тіло |
|
рідина |
Вільнодисперсна система: Туш, чорнило, колоїди срібла |
|
(«протаргол», «коларгол»), колоїдне золото, колоїдна сірка |
|||
|
|
|
|
|
Гель |
тверде тіло |
|
рідина |
Зв’язанодисперсна система: желе, холодець, косметичні та |
|
лікувальні гелі |
|||
|
|
|
|
|
Суспензія |
тверде тіло |
|
рідина |
Грубодисперсна система: будівельний розчин, річковий мул, |
|
олійна фарба |
|||
|
|
|
|
|
Тверда піна |
газ |
|
тверде тіло |
Пемза, пінобетон, керамзит, пінопласти, зефір, крем бізе |
Тв. емульсія |
рідина |
|
тверде тіло |
Масло вершкове, сир голландський, ґрунт |
Твердий золь |
тверде тіло |
|
тверде тіло |
Природні мінерали: польовий шпат, опал, рубін, кольорове |
|
скло, сплави металів – сталь, чавун, бронза |
|||
|
|
|
|
|
Класифікація дисперсних систем за характером взаємодії ДС і ДФ
За рахунок міжмолекулярних сил на межі розділу фаз завжди відбувається взаємодія між речовиною дисперсної фази і дисперсійного середовища. За характером цієї взаємодії розрізняють ліофільні та ліофобні колоїди (з грецької λύω – розчиняти, φιλία – любов/дружба, φόβος – страх).
Ліофільністю називають здатність частинок дисперсної фази взаємодіяти з молекулами дисперсійного середовища та утворювати сольватні (гідратні у воді) оболонки.
До ліофільних дисперсних систем відносять розчини білків, мил, алкалоїдів, танідів, барвників, розчинна кава, дріжджові культури, деякі види глин і т.п. Ці системи деколи називають напівколоїдами.
Ліофільні колоїди термодинамічно стійкі і здатні самочинно диспергуватись. Цей процес можливий тому, що зростання енергії Гіббса за рахунок збільшення поверхні (ΔG1=σΔS>0) компенсується її зменшенням за рахунок виділення теплоти при сольватації (ΔH<0) і зростанням ентропії системи за рахунок хаотичного руху частинок (ΔS>0). Тобто ΔG2=ΔH –T S<0 і | ΔG2| > |
ΔG1|.
Ліофільні колоїди оборотні, частинки ліофільного золю після їх виділення з дисперсійного середовища можуть знову переходити в колоїдний стан при додаванні відповідного розчинника. Наприклад для переведення в колоїдних стан сухих дріжджів, чи культури бактерій (препарати «біфідумбактерин», «колібактерин»…) достатньо додати води, молока тощо.
© Ю.Павловський 2011
7
Ліофобні колоїди термодинамічно і агрегативно нестійкі та необоротні. При виділенні з дисперсійного середовища утворюють порошкоподібні осади. Ліофобним колоїдам, однак, можна надати ліофільних властивостей (ліофілізувати) адсорбцією на їх поверхні поверхнево-активних речовин.
До ліофобних систем відносять аерозолі, емульсії, гідрозолі металів, їх оксидів, сульфідів, тобто власне колоїди.
Класифікація дисперсних систем за структурою
За характером взаємодії частинок дисперсної фази між собою, дисперсні системи поділяють на вільнодисперсні та зв’язанодисперсні.
До вільно дисперсних відносяться безструктурні системи, в яких частинки незалежно рухаються в дисперсійному середовищі (тепловий рух, седиментація). Прикладами таких систем є аерозолі, емульсії, золі.
Для зв’язанодисперсних систем характерне утворення просторових сіток, каркасів, як за рахунок взаємної адгезії частинок дисперсної фази, так і за рахунок великої в’язкості дисперсійного середовища. Частинки, що утворили структуру, здатні лише до коливального руху. Зв’язанодисперсні системи мають деякі властивості твердого тіла. До них відносяться гелі, студні, піни, капілярно-пористі тіла.
Класифікація за фазовою відмінністю
Особливе місце в колоїдній хімії займають розчини полімерів та високомолекулярних сполук (ВМС). Розчини ВМС за своєю природою є істинними, бо частинки дисперсної фази складаються з окремих молекул і утворюють гомогенні, стійкі і оборотні системи. Наприклад розчин полістиролу у ацетоні, каучуку в бензині, желатину у воді тощо.
В той же час, розміри окремих молекул в таких розчинах такі ж, а не рідко і більші ніж в колоїдних частинок і вони дійсно проявляють деякі властивості колоїдних систем.
Оскільки розчини ВМС об’єднують властивості істинних і колоїдних розчинів, їх називають молекулярними колоїдами, на відміну типових колоїдних систем – суспезоїдів.
Отже, усі дисперсні системи можна розділити на суспензоїди – системи, частинки яких складаються з агрегатів атомів і молекул, і молекулярні колоїди – системи, що містять молекули колоїдної області дисперсності.
© Ю.Павловський 2011
8
Лекція 2. Отримання та очистка дисперсних систем
Отримання дисперсних систем
Для отримання ліофільних дисперсних систем достатньо розчинити дисперсну фазу і відповідному розчиннику. Наприклад, сухе молоко, яєчний порошок, культуру бактерій у воді, каучук у бензині і т.п.
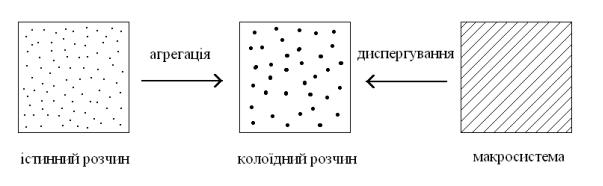
Отримувати ліофобні системи можна двома протилежними шляхами: або подрібненням великих частинок на дрібніші, або ж створення умов, в яких окремі атоми і молекули об’єднуються в агрегати колоїдних розмірів. Перший метод називають диспергаційним , другий – агрегаційним.
Рис. 2.1. Методи отримання дисперсних систем
Диспергаційні методи отримання колоїдних систем
Для подрібнення рідких або твердих тіл необхідно затратити певну роботу. Для цієї цілі можна використовувати механічне подрібнення, диспергування ультразвуком, електричним струмом тощо.
Повна робота диспергування:
W=К·σ·Ѕ,
де σ – поверхневий або міжфазовий натяг, Ѕ – площа поверхні, що утворюється,
К – коефіцієнт, що залежить від способу диспергування Із зростанням ступеня подрібненості затрати енергії зростають і можуть складати основну її ча-
стку. Наприклад, у виробництві цементу на подрібнення сировини, вугілля і клінкеру (цементного каменя) витрачається 75% від усіх затрат енергії.
1. Механічне диспергування
До механічних методів відноситься дроблення, розмелювання, розтирання… з допомогою різних типів млинів: валкових, кульових, відцентрових, струминних та ін. Цей метод дає порівняно крупнодисперсні порошки. Більш тонке подрібнення досягається з допомогою колоїдних млинів різноманітних конструкцій. Розривне зусилля в колоїдних млинах досягається дією відцентрової сили у дуже вузькому зазорі між рухомими елементами млина.
На колоїдних млинах подрібнюють графіт, сірку, оксиди металів, пігменти, какао, лікарські препарати, харчові продукти ...
2.Електричне диспергування
Для отримання золів металів та напівпровідників використовують електричний метод подрібнення Бредіга: на електроди занурені у дисперсійне середовище (вода чи органічний розчинник) подають велику напругу до появи «вольтової дуги». Метал при цьому випаровується і охолоджуючись у дисперсному середовищі утворює колоїдні частинки.
В методі Сведберга диспергування проводиться високочастотним електричним розрядом.
© Ю.Павловський 2011
9
3. Ультразвукове диспергування
В цьому методі диспергування мікрочастинок настає в результаті розривних зусиль, що виникають внаслідок місцевого стискання і розширення середовища при проходженні через нього ультразвукової хвилі. Зміна тиску на фронті у/з хвилі досягає тисяч атмосфер протягом дуже короткого часу. Краплини рідини, шматки крихких речовин при цьому розсипаються на дрібніші.
Цей метод використовують для отримання емульсій, золів крихких металів, сплавів, гіпсу, графіту, лікарських засобів і та ін.
4. Пептизація
Пептизація це хімічний метод отримання колоїдних розчинів, який полягає у подрібнені свіжих осадів додаванням до них стабілізаторів – ПАР, електролітів.
Агрегаційні методи отримання колоїдних систем
1. Заміна розчинника
В даному методі колоїдний розчин отримують додаванням до істинного розчину речовини, яку хочуть отримати в колоїдному стані, нового розчинника, в якому розчинний перший розчинник, але не розчиняється дана речовина (якщо до дорогих французьких парфумів додати води, то ефірні масла утворять емульсію, а парфуми помутніють ).
Цей метод широко використовують для отримання емульсій лікарських засобів. Наприклад, спиртові розчин прополісу, «хлорфіліпту» при розбавленні водою дають емульсії, які використовують для полоскання ротової порожнини, горла…
2. Конденсація пари
При охолодженні або стисканні пари, досягаються умови, при яких пара стає насиченою і конденсується у вигляді краплинок диму чи туману. Цим методом отримують різноманітні аерозолі, в тому числі і лікувальні.
3. Кристалізація розчину
При охолодженні розчину розчинність речовини зменшується, він стає перенасиченим і речовина може при певних умовах кристалізуватись у вигляді частинок колоїдних розмірів (а може дати великий монокристал).
Можливість утворення великої кількості дрібних кристалів, чи краплинок, або меншої кількості але крупних, залежить від наявності центрів кристалізації. Для виникнення нової фази необхідно досягнути у системі певного пересичення. Енергія, яка виділяється при конденсації досить значна, і новоутворена частинка повинна відати її навколишньому середовищу, або наявним стороннім частинкам – зародкам конденсації. При наявності великої кількості центрів росту утворюються високодисперсні системи, якщо ж їх нема, конденсація/кристалізація може не відбутись зовсім.
Відомо, що для захисту квітучих садів від весняних заморозків садівники задимлюють сади спалюючи торішнє листя, хмиз, солому. При цьому утворюються тверді частинки диму на яких конденсується водяна пара і віддає приповерхневому шару повітря теплоту конденсації, а це 44 кДж/моль або 2444 кДж на 1кг водяної пари.
Для захисту садів та посівів від граду, або ж для штучного викликання дощу в заданому місці, в атмосфері з літаків розпилюють твердий вуглекислий газ, цемент… Однак, найефективнішим є розпилення дрібнокристалічного йодиду срібла, що має однакові з кристаликами льоду параметри кристалічної ґратки. Коли кристалики AgI попадають в переохолоджену хмару утворюються дуже багато кристаликів льоду, які випадають у вигляді снігу або дощу, танучи в нижніх, тепліших шарах повітря.
© Ю.Павловський 2011
10
4. Хімічний метод
В хімічному методі для отримання дисперсних систем можна використати будь-яку реакцію, що проводить до утворення нової фази.
Реакції обміну:
AgNO3 + HCl = HNO3 + AgCl (золь)
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2 (піна)
Реакції гідролізу:
FeCl3 + 3H2O = 3HCl + Fe(OH)3 (золь)
SnCl2 + 3H2O = 2HCl + Sn(OH)2 (золь)
Реакції окислення-відновлення:
3FeCl2 + AuCl3 = 3FeCl3 + Au (золь)
2Na2S2O3 + 2H2SO4 = 2Na2SO4 + 2H2SO3 + S2(золь)
Реакції полімеризації:
nCH2=CH2 → (-CH2-CH2-)n (золь/емульсія)
Очистка дисперсних систем
Отримані тим чи іншим методом, а також природні колоїдні розчини, буває необхідно очистити від домішок іонів та молекул.
Для цього використовують діаліз, електродіаліз, ультрафільтрацію, зворотний осмос.
1. Діаліз
Діалізом (від διάλυσις – розчинення, термін введений засновником колоїдної хімії Т. Гремом) називають процес видалення іонів або молекул з золю шляхом їх дифузії через напівпроникну мембрану.
В якості напівпроникних мембран (НПМ) раніше використовували пергамент, колодій, дублений желатин, плівки з нітрота ацетилцелюлози, керамічні мембрани. В наш час використовують синтетичні мембрани з наперед заданим розміром пор. Основною властивістю НПМ є їх здатність утримувати колоїдні частинки і пропускати окремі іони чи молекули.
Приклад:
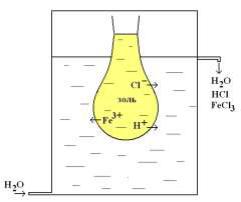
Після отримання золю гідроксиду заліза, його слід очистити від надлишку FeCl та HCl (див. реакцію вище). Для цього, золь поміщають у мішечок з колодію, а його занурюють у проточну воду. Появу іонів хлору контролюють додаванням розчину нітрату срібла. Діаліз проводять доти, поки вода не перестане мутніти при додаванні AgNO3 (рис.3).
Рис. 2.2. Діаліз розчину гідрозолю заліза
Діаліз широко використовують у хімічній промисловості для очистки продуктів емульсійної полімеризації, у фармацевтичному виробництві для очистки живих культур від поживних речовин та продуктів метаболізму, для очистки білків, ферментних препаратів.
Широкого застосування набув у медицині метод очистки крові пацієнтів з гострою і хронічною нирковою недостатністю – гемодіаліз.
© Ю.Павловський 2011
