
Lectures.Part.2
.2.pdf61
Лекція 11. Емульсії
Емульсія – Emulsio – (від лат. еmulgero – видоювати) – молокоподібна рідина. Емульсія це дисперсна система, що складається з дрібних краплинок рідини (дисперсна фаза) подрібне-
них в іншій рідині (дисперсійне середовище). Необхідна умова існування емульсії - взаємна не-
розчинність або обмежена розчинність рідин.
Більшість емульсій відносять до мікрогерогенних та грубодиспесних систем - краплини дисперсної фази в емульсіях мають розмір від 1 до 50 мкм і більше (1 мкм = 10-6 м) і їх можна спостерігати з допомогою оптичного мікроскопа.
Емульсії дуже поширені у природі і широко використовуються на практиці. Як приклад можна привести: молоко, маргарин, майонез, молочний сік рослин – латекс, лімфа крові, сира нафта, природні бітуми. У вигляді емульсій використовують мастильно-охолоджувальні рідини,
водно-емульсійні фарби та клеї (ПВА), пестициди та гербіциди, косметичні креми і т.д.
Особливе місце займають емульсії у фармації. Лікувальні форми у вигляді емульсій ви-
користовують як для зовнішнього (креми, мазі), так і для внутрішнього (ентерального) застосу-
вання (препарати для лікування при різних захворюваннях та для збалансованого висококало-
рійного харчування, дитяче харчування, харчування для космонавтів тощо). Для внутрішньо-
венного (паретерального) введення використовують високодисперсні (0,1–1 мкм) прозорі ему-
льсії, що містять жири, вуглеводи, амінокислоти та вітаміни для повного живлення.
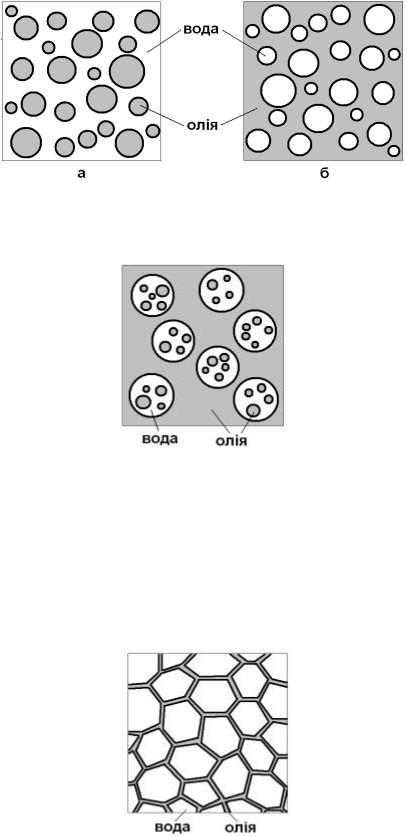
За полярністю фаз емульсії поділяють на два типи:
1)дисперсії олії у воді (О/В) - емульсії першого роду або прямі, являють собою неполярну рі-
дину (бензол, толуол, гас, рослинна олія, мінеральні оливи і т.п., а в загальному - олія) под-
рібнену в полярному середовищі – воді.
2)дисперсії води в олії (В/О) - емульсії другого роду або зворотні, - полярна рідина подрібнена
в неполярному середовищі (рис.1).
Зустрічаються також „множинні” емульсії, в яких краплинки дисперсної фази є, в свою чергу, середовищем для більш дрібних краплинок (рис.2).
В залежності від об’ємної частки (ωV) дисперсної фази розрізняють розведені (ωV=0,1%),
концентровані (ωV≤74%) та висококонцентровані емульсії (ωV>74%). Межа між
двома останніми класами визначається неможливістю частинок дисперсної фази зберіга-
ти сферичну форму при ωV>74%, яка відповідає щільній упаковці сфер. У високо-
© Ю.Павловський 2011
62
Рис. 1. Типи емульсій: а) пряма емульсія О/В; б) зворотна емульсія В/О
концентрованих емульсіях частинки мають форму багатогранників, розділених тонкою плівкою дисперсійного середовища, тобто, за своєю структурою, подібні до пін (Рис.3).
Рис. 2. Множинна емульсія Крім того, емульсії поділяють на ліофільні та ліофобні. Ліофільні - термодинамічно стій-
кі та оборотні системи, утворюються самочинно при температурах близьких до критичної тем-
ператури змішування рідких фаз (водні емульсії аніліну, фенолу). Вони є високодисперсними
(колоїдними) системами, розмір краплин яких не перевищує 0,1 мкм. Ліофільні емульсії утво-
рюють також колоїдні ПАР (мила) та ВМС, наприклад, білки.
Рис. 3. Високонцентрована емульсія типу В/О
Ліофобні емульсії отримують як конденсаційними так і диспергаційним методами. В
промисловості диспергаційне емульгування найчастіше проводять механічним перемішуванням інгредієнтів емульсії в змішувачах різного типу: гомогенізаторах, колоїдних млинах. Застосо-
© Ю.Павловський 2011
63
вують також акустичні (звукові та ультразвукові) диспергатори. Рідше, головним чином в лабо-
раторних умовах, емульсії отримують методами конденсації, тобто, шляхом виділення краплин рідкої дисперсної фази з пересиченої пари, пересичених розчинів або розплавів. Лі
офобні емульсії термодинамічно та агрегативно нестійкі. Вони можуть існувати достатньо дов-
го лише у присутності емульгаторів. При великій різниці густини дисперсної фази та диспер-
сійного середовища вони, крім того, седиментаційно нестійкі. Седиментація краплин достатньо захищеної від коалесценції (злипання) емульсії приводить до утворення вершків або осаду без розшарування на дві суцільні рідини.
Отримання емульсій методами диспергування проводять обов’язково в присутності ему-
льгаторів (стабілізаторів емульсії). В якості емульгаторів виступають різні речовини: поверхне-
во-активні речовини (ПАР), високомолекулярні сполуки (ВМС), електроліти та тверді речовини у вигляді високодисперсних порошків.
Молекули ПАР, адсорбуючись на межі розділу фаз, знижують поверхневий натяг σ. При цьому вони орієнтуються полярними групами до води, а неполярними вуглеводневими радика-
лами - до олії. Однак, зменшення поверхневого натягу недостатньо для утворення стійкої ему-
льсії. Так, спирти та органічні кислоти з числом атомів вуглецю меншим 8 сильно зменшують
σ, але не можуть стабілізувати емульсію. Для того, щоб ПАР була добрим емульгатором її гід-
рофільні та ліпофільні (гідрофобні) властивості повинні бути приблизно однакові (так званий гідрофільно-ліпофільний баланс – ГЛБ), тобто, емульгатор повинен мати приблизно однакову спорідненість до обох фаз. Якщо спорідненість до різних фаз сильно відрізняється, то емульга-
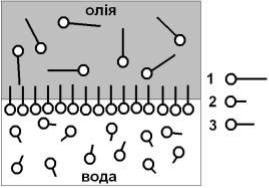
тор буде переміщатись від межі розділу у фазу до якої його спорідненість більша (Рис. 3).
Рис. 3. Поведінка на межі розділу фаз молекул ПАР з різним значенням гідрофільноліпофільного балансу:
1)ГЛБ молекули ПАР зміщений у бік гідрофобності (ліпофільності)
2)ГЛБ зміщений у бік гідрофільності;
3)оптимальне значення ГЛБ
Типовими емульгаторами є мила з числом атомів вуглецю у радикалі 10 – 18 (олеати,
стеарати, пальмітати та ін.). Їх молекули мають досить довгий органічний радикал із великою
© Ю.Павловський 2011
64
спорідненістю до олії, та іонізовану групу із значною спорідненістю до води. При адсорбції на поверхні краплинок емульсії неполярні ланцюги за рахунок бокової когезії утворюють гелепо-
дібні шари, які перешкоджають частинкам емульсії злипатись. Таким чином, стабілізуюча дія емульгатора полягає не тільки у зниженні σ на межі фаз, скільки в утворенні структурно-
механічного бар’єру, який забезпечує стійкість емульсії. Цим же пояснюється стабілізуюча дія дрібно розмелених порошків. В результаті адгезії частинки порошку збираються на поверхні та утворюють механічно стійку захисну плівку. Для стабілізації прямих емульсій (О/В) викорис-
товують гідрофільні порошки, зворотних (В/О) – гідрофобні. Гідрофільними порошками-
стабілізаторами є глина, крейда, гіпс, силікагель, оксид заліза, а в харчовій промисловості – гір-
чичний порошок; гідрофобними – графіт, сажа, сульфіди металів.
На стабілізуючу дію мил впливає також утворенням подвійного електричного шару на поверхні розділу фаз. Будову міцели олії, стабілізованої олеатом натрію, який дисоціює за рів-
нянням:
NaOl ↔ Na++ Ol¯,
можна схематично показати формулою:
{[m·Олія ]· nOl¯ ·(n-x)Na+}-x ·xNa+.
В результаті вибіркової адсорбції аніона Ol¯ краплинки емульсії заряджаються негатив-
но, а водна фаза позитивно. Між зарядженими краплинками виникає енергетичний бар’єр який перешкоджає їх зближенню.
Для емульсій характерне явище обертання фаз, яке виникає при зміні властивостей ему-
льгатора. Наприклад, якщо до прямої емульсії „олія у воді” стабілізованої олеатом натрію, ГЛБ якого зміщений у бік гідрофільності, додати розчин хлористого кальцію, то утвориться емуль-
сія „вода в олії”. Це пояснюється утворенням нерозчинного у воді олеату кальцію:
2NaOl + CaCl2 = 2NaCl + Ca(Ol)2,
який має більшу спорідненість до олії і краще стабілізує зворотну емульсію.
Встановити тип емульсії можна різними методами:
1)методом зливання краплини емульсії з краплиною води або неполярної рідини. Невеликі кра-
плини емульсії та розчинника наносять на скло і, нахиляючи його, спостерігають, чи зіл-
лються краплини при стиканні одна з одною. Якщо краплина емульсії зливається з крапли-
ною води, то дисперсійним середовищем є вода, а емульсія - пряма. Коли ж краплина ему-
льсії зливається з краплиною неполярної рідини – то середовище – олія, емульсія – зворот-
на;
2)методом розтікання. Краплину емульсії наносять на скляну пластинку покриту парафіном.
Краплина буде розтікатись коли дисперсійне середовище – олія;
© Ю.Павловський 2011
65
3)методом вимірюванням електропровідності. Емульсії типу „олія у воді” мають значно бі-
льшу електропровідність ніж „вода в олії”
4)методом забарвлення. До емульсії додають барвники розчинні у воді або у жирах і спосте-
рігають, що забарвилось – дисперсне середовище чи дисперсна фаза. Наприклад жиророз-
чинний барвник „судан III” забарвить краплини прямої емульсії або середовище зворотної, і
навпаки, водорозчинний „метиленовий синій” забарвить середовище прямої емульсії та кра-
плини зворотної.
Досить часто на практиці постає завдання перешкодити утворенню емульсії, або зруйнувати емульсію. Це можна зробити різними способами в залежності від конкретної емульсії.
В розведених емульсіях першого роду (О/В) зменшення стійкості відбувається під дією елект-
ролітів згідно з правилом Шульце-Гарді.
Якщо емульсії стабілізовані типовими емульгаторами, то їх можна зруйнувати хімічним шля-
хом. Так, емульсії першого роду, стабілізовані милом, можна деемульгувати, додаючи мінера-
льні кислоти, які руйнують емульгатор. В якості деемульгаторів можна застосувати ПАВ, які мають більшу поверхневу активність ніж емульгатори, але не можуть утворювати на поверхні краплинок стійку механічну плівку.
Поширеним способом руйнування емульсій є механічна дія, зокрема, центрифугування, а також усі способи, що викликають коагуляцію колоїдного розчину: дегідратація, заморожування,
кип’ятіння, додавання електроліту, дія електричного струму і т.п.
© Ю.Павловський 2011
