
Zadachi_2
.pdf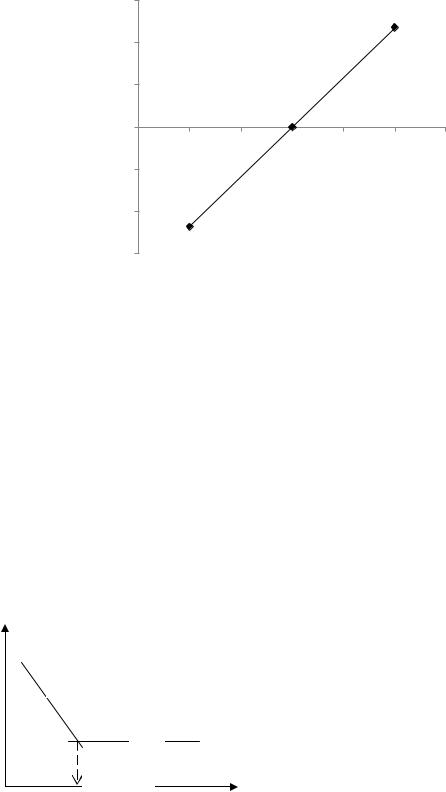
3
lg(I/(Iдиф - I))
2 |
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
E 1/2 |
|
|
|
0 |
|
|
|
|
|
|
0,99 |
1 |
1,01 |
1,02 |
1,03 |
1,04 |
1,05 |
-1 |
|
|
|
|
|
-Е, В |
-2
-3
Порівнюючи визначені двома способами значення потенціалів півхвиль з табличними даними, встановлюємо, що досліджуваним іоном є Zn2+.
Задача 5. Наведіть графіки та поясніть форму кривих амперометричного титрування речовини А стандартним розчином титранту В, якщо його вести при Екат=-1,5 В, а потенціали півхвилі цих речовин відповідно становлять:
а) |
Е1/2 ( A) 1,2 |
B; |
Е1/2 (В) 2,0 |
В; |
б) |
Е1/2 ( А) 0,9 |
В; |
Е1/2 (B) 1,2 |
B. |
Розв’язок. а) При потенціалі катоду Екат=-1,5 В визначувана речовина А буде електродноактивною (бо за модулями |-1,2|<|-1,5| ) і тому на кривій амперометричного титрування буде спостерігатися спадаюча пряма (лінія 1). Титрант буде неелектродноактивним (бо |-2,0| >|-1,5| ) і на кривій титрування значення сили струму не буде змінюватись (лінія 2):
I, мкА
1
2
Vт.е.
-Е, В
б) При потенціалі катоду Екат=-1,5 В визначувана речовина А буде електродноактивною (бо |-0,9|<|-1,5| ) і тому на кривій амперометричного титрування буде спостерігатися спадаюча пряма (лінія 1). Титрант також буде
31
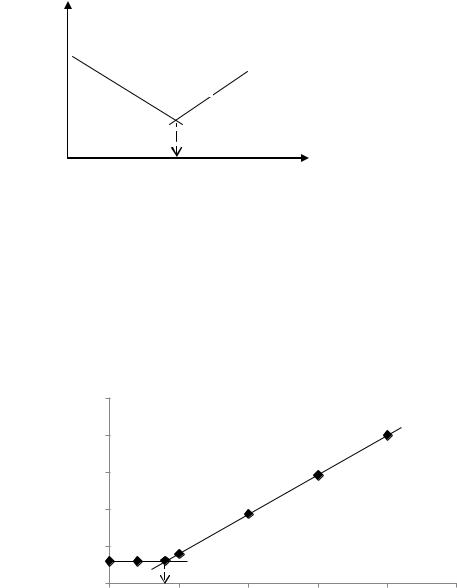
електродноактивним (бо |-1,2| <|-1,5| ) і на кривій титрування буде зростаюча пряма (лінія 2):
I, мкА
1
2
Vт.е.
-Е, В
Задача 6. Визначте концентрацію цинку (мг/л), якщо при амперометричному титруванні 10,0 мл цього розчину свіжоприготованим розчином
K4Fe(CN)6 з титром за цинком T(K4Fe(CN)6 /Zn) = 0,00244 г/мл при Екат = -1,46
В одержали такі результати:
V (K4Fe(CN)6) , мл |
0 |
0,2 |
0,4 |
0,5 |
1,0 |
1,5 |
2,0 |
І, мкА |
30 |
30 |
31 |
40 |
94 |
146 |
200 |
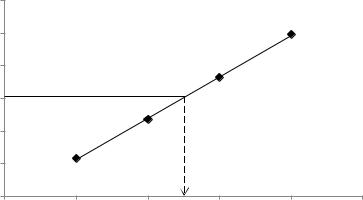
Розв’язок. Будуємо криву амперометричного титрування в координатах І-
V(K4Fe(CN)6):
І,мкА 250 |
|
|
|
|
|
200 |
|
|
|
|
|
150 |
|
|
|
|
|
100 |
|
|
|
|
|
50 |
|
|
|
|
|
0 |
Vт.е. = 0,4 мл |
|
|
|
|
|
|
|
|
|
|
0 |
0,5 |
1 |
1,5 |
2 |
2,5 |
|
|
|
|
V(K4Fe(CN)6 ), мл |
|
З кривої титрування визначаємо об’єм титранту в точці еквівалентності Vт.е.= 0,4 мл. Тоді маса цинку визначається за формулою:
m(Zn) T Vт.е. 0,00244 0,4 0,000976 г 0,976 мг, а концентрація цинку :
C |
m(Zn) |
|
0,976 |
0,0000976 мг/л. |
|
|
10 10 3 |
||||
|
V |
р ну |
|
|
|
|
|
|
|
|
|
32
Задачі для самостійного розв’язування
1. Для визначення домішки плюмбуму у металічному алюмінію його наважку 5,1545 г розчинили, перенесли у мірну колбу місткістю 50 мл і довели об'єм розчину фоновим електролітом до риски. При полярографуванні цього розчину висота хвилі становила 110 мм. Полярографування стандартних розчинів солі Рb2+ дало такі результати:
С (Pb2+) 106 , г/см3 |
0,5 |
1,0 |
1,5 |
2,0 |
2,5 |
h, мм |
40 |
78 |
121 |
159 |
202 |
|
|
|
|
|
|
Визначте масову частку (% ) Pb в аналізованому зразку.
2. Для визначення вмісту купруму в латуні її наважку 0,1125 г розчинили і довели об'єм розчину до 50 мл. При полярографуванні одержаного розчину висота хвилі становила 210 мм. Полярографування чотирьох стандартних розчинів солі Cu2+ дало такі результати:
С (Cu2+) 103, г/см3 |
0,5 |
1,0 |
1,5 |
2,0 |
h, мм |
50 |
150 |
250 |
350 |
|
|
|
|
|
Визначте масову частку (% ) купруму в зразку латуні.
3.Для визначення вмісту плюмбуму у цинковій руді її наважку 1,6125 г розчинили і об'єм розчину довели до 200 мл. При полярографуванні 20,0 мл цього розчину висота хвилі становила 30 мм. Після добавки 5 мл стандартного
розчину Рb(NО3)2 концентрацією 0,009 М висота хвилі зросла до 40 мм. Визначте масову частку (% ) плюмбуму в руді.
4.Для визначення вмісту мангану у сталі її наважку 1,6000 г розчинили і об'єм розчину довели до 200,0 мл. При полярографуванні 15,5 мл цього розчину висота хвилі становила 21,0 мм. Після добавки 2,5 мл 0,0050 М
розчину MnSО4 висота хвилі зросла до 24,5 мм. Визначте масову частку (%) мангану в сталі.
5.Визначте вміст купруму у 500 мл досліджуваного розчину в г, якщо при полярографуванні цього розчину висота хвилі становила 56 мм. Висота хвилі
для стандартного розчину, що містить 4 10-3 моль/л солі Cu2+, становила 69 мм. 6. Визначте концентрацію плюмбуму (мг/л), якщо при амперометричному титруванні 20,0 мл цього розчину стандартним розчином Na2SО4 з титром
T(Na2SО4/Pb) = 0,00720 г/мл при Екат = -1,0 В одержали такі результати:
V, мл |
0 |
0,5 |
1,0 |
1,5 |
2,0 |
2,5 |
3,0 |
|
|
|
|
|
|
|
|
І,мкА |
215 |
163 |
113 |
60 |
40 |
39 |
41 |
|
|
|
|
|
|
|
|
7. Визначте концентрацію ніколу (мг/мл) у досліджуваному розчині, якщо при амперометричному титруванні 20 мл цього розчину спиртовим розчином диметилгліоксиму (ДМГО) з титром за ніколом, рівним 0,00295 г/мл, при Екат = -1,76 В одержали такі результати:
33
|
V (ДМГО), мл |
0 |
0,5 |
1,0 |
1,5 |
|
2,0 |
2,5 |
3,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
І, мкА |
240 |
190 |
140 |
93 |
|
74 |
76 |
75 |
|
|
|
|
|
|
|
|
|
|
|
|
8. Визначте масову частку формальдегіду у |
досліджуваному розчині |
|||||||||
формаліну ( =1,035 г/мл), якщо 5 мл цього розчину помістили у колбу місткістю 200,0 мл і довели об'єм фоновим розчином до риски. При полярографуванні 10 мл цього розчину дифузійний струм становив 40,3 мкА. Після додавання до цього розчину 1,5 мл стандартного розчину з вмістом формальдегіду 6,5 мг/мл дифузійний струм зріс до 49,5 мкА.
9. Наведіть графіки та поясніть форму кривих амперометричного титрування речовини А розчином титранту В, якщо титрування вести при Екат = -2,0 В, а потенціали півхвилі цих речовин відповідно становлять:
а) |
Е1/2 ( A) 1,2 |
B; |
Е1/2 (В) 2,1 |
В; |
б) |
Е1/2 ( А) 0,7 |
В; |
Е1/2 (B) 1,3 |
B; |
в) |
Е1/2 ( А) 2,2 |
В; |
Е1/2 (B) 1,3 |
B. |
10. При дослідженні якісного складу розчину на фоні 1 М КС1 була записана вольтамперна крива, з якої знайшли величину дифузійного Ідиф = 75 мкА та залишкового Ізал = 8 мкА струмів. Частина кривої на ділянці потенціалів, близьких до Е 1/2, описується значеннями:
-Е, В |
1,06 |
1,08 |
1,10 |
1,12 |
1,14 |
І, мкА |
8,2 |
18 |
42.5 |
68 |
77 |
Визначте якісні параметри іона та ідентифікуйте його за табличними значеннями півхвиль деяких елементів у присутності 1 М КС1:
Е1/2(Со(II))= -1,23 В; Е1/2 (Ni(II))= -1,10 В; Е1/2(Zn(II))= -1,02 В; Е1/2(Cd (II))= - 0,64 В.
ХРОМАТОГРАФІЧНИЙ АНАЛІЗ
Питання для самостійної підготовки
1.На чому оснований хроматографічний метод аналізу?
2.Розділення за методами: а)газоадсорбційної; б)газоабсорбційної; в)розподільчої рідинної; г)газорідинної; д)тонкошарової; е)іонообмінної хроматографії. Області застосування, переваги та недоліки цих методів аналізу.
3.Класифікація хроматографічних методів аналізу.
4.Блок-схема газового хроматографа.
5.Теорія лінійної рівноважної газової хроматографії.
34

6.Теорія нерівноважної газової хроматографії.
7.Теорія тарілок в хроматографії.
8.Залежність висоти, еквівалентної теоретичній тарілці, від швидкості газуносія. Рівняння Ван-Деемтера.
9.Вплив основних факторів на ВЕТТ.
10.Час утримування, віддаль утримування і об’єм утримування в хроматографічному аналізі. Методи якісного хроматографічного аналізу.
11.Використання логарифмічних індексів Ковача в хроматографічному аналізі.
12.Кількісний хроматографічний аналіз рідин і газів.
13.Метод абсолютного калібрування.
14.Метод внутрішньої нормалізації.
15.Метод внутрішнього стандарту.
16.Вплив основних факторів на чіткість розділення компонентів.
17.Поняття про критерій розділення в хроматографічному аналізі.
18.Хроматографічний аналіз з програмуванням температури.
19.Основні принципи детектування в газовій хроматографії.
20.Види детекторів для газової хроматографії і вимоги до них.
Приклади розв’язування типових задач
Задача 1. При аналізі органічної сполуки була встановлена її відстань утримування: l = 7 мм. Ідентифікуйте цю сполуку, якщо при хроматографуванні індивідуальних речовин в цих же умовах їх часи утримування становили відповідно: етанол – 0'56''; хлороформ - 1'24''; толуол - 2'56''; СС14 -3'10''; кумол - 4'44''. Швидкість руху діаграмної стрічки.720 мм/год.
Розв’язок. Для ідентифікації сполуки хроматографічним методом необхідно встановити її час утримування за формулою: wl ,
де τ – час утримування, с;
l - відстань утримування мм;
w- швидкість руху діаграмної стрічки, мм/с.
Для досліджуваної сполуки час утримування складає τ= 17/(0,2)=85 c. Порівнюючи його з часом утримування відомих речовин, можна припустити, що досліджувана речовина – хлороформ, тому що її час утримування практично співпадає з часом утримування хлороформу (84 с). Для однозначного висновку про ідентифікацію досліджуваної речовини необхідно скористатись більш достовірним способом – шляхом добавки передбачуваної речовини до досліджуваної суміші і повторним хроматографуванням. Якщо
35
передбачувана речовина присутня в суміші, то висота її піку після додавання добавки збільшиться.
Задача 2. При хроматографуванні газових сумішей з вмістом бензолу - 0,05; 0,10; 0,15; та 0,20 % об. висоти хроматографічних піків мали значення: 23, 47, 73, 99 мм відповідно. Визначте концентрацію бензолу в досліджуваній суміші, якщо висота його хроматографічного піку, одержаного в тих самих умовах, становить 61 мм.
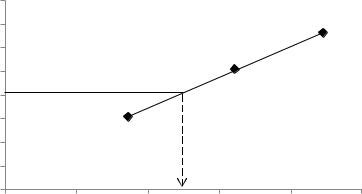
Розв’язок. При хроматографуванні газових сумішей використовують метод калібрувального графіку, з якого визначають концентрацію досліджуваної речовини:
h, мм120 |
|
|
|
|
|
100 |
|
|
|
|
|
80 |
hx = 61 мм |
|
|
|
|
|
|
|
|
|
|
60 |
|
|
|
|
|
40 |
|
|
|
|
|
20 |
|
|
Cx = 0,125 % об. |
|
|
|
|
|
|
||
0 |
|
|
|
|
|
0 |
0,05 |
0,1 |
0,15 |
0,2 |
0,25 |
|
|
|
|
|
C, % об. |
Вміст бензолу в досліджуваній суміші – 0,125 % об.
Задача 3. Оцініть концентрацію етилену в газовій суміші, якщо висота його хроматографічного піку дорівнює 97 мм (М 1:4). При хроматографуванні калібрувальної суміші з концентрацією етилену 58,4 % об. висота його піку становила 128 мм (М 1:8) (залежність висоти піку від концентрації є прямопропорційною).
Розв’язок. Згідно методу стандартів: Cx |
hx |
Cст |
97 4 |
58,4 22, 1% . |
|
hст |
128 8 |
||||
|
|
|
Задача 4. Визначте вміст пропану в газовій суміші, якщо висота його хроматографічного піку становила 210 мм. Суміш з вмістом пропану 7,45 % об. мала значення висоти хроматографічного піку 332 мм. При розведенні цієї газової суміші і її хроматографуванні для одержання інших точок калібрувального графіку отримали такі результати:
36
|
|
|
|
1-е розведення |
|
2-е розведення |
|
|
|
|
|
|
|
Тиск |
в |
ємності до |
розведення |
14 |
|
48 |
P`надл, мм рт.ст. |
|
|
|
|
||
Тиск |
в |
ємності після |
розведення |
164 |
|
296 |
P``надл, мм рт.ст. |
|
|
|
|
||
Ратм, |
мм рт.ст. |
|
|
738 |
||
|
|
|
|
|
|
|
h, мм |
|
|
|
255 |
|
154 |
|
|
|
|
|
|
|
Розв’язок. Для побудови калібрувального графіку необхідно розрахувати, які значення мали концентрації пропану в газовій суміші після першого та другого розведень:
C1 Co |
|
P |
Р' |
(1) |
|
7,45 |
|
738 14 |
|
6,21 % об ; |
|
атм |
надл |
|
|
|
|
|
|||
|
Р |
Р" |
(1) |
|
738 164 |
|
||||
|
|
атм |
надл |
|
|
|
|
|
|
|
C2 C1 |
P |
Р' |
(2) |
6,21 |
738 48 |
|
4,72 % об . |
|||
атм |
надл |
|
|
|
|
|||||
Р |
Р" |
(2) |
738 296 |
|||||||
|
|
атм |
надл |
|
|
|
|
|
|
|
Складемо таблицю значень для побудови калібрувального графіка в координатах h-С:
С, % об |
7,45 |
6,21 |
4,72 |
|
|
|
|
h, мм |
332 |
255 |
154 |
|
|
|
|
За цими даними будуємо калібрувальний графік, з якого визначаємо вміст пропану, якщо висота його хроматографічного піку – 210 мм:
h, мм 400 |
|
|
|
|
|
350 |
|
|
|
|
|
300 |
|
|
|
|
|
250 |
hx = 210 мм |
|
|
|
|
|
|
|
|
|
|
200 |
|
|
|
|
|
150 |
|
|
|
|
|
100 |
|
|
|
|
|
50 |
|
|
Сx= 5,51 % об. |
|
|
0 |
|
|
|
|
|
3 |
4 |
5 |
6 |
7 |
8 |
|
|
|
|
|
С, % об. |
Сх=5,51 % об.
Задача 5. Визначте кількісний cклад суміші органічних розчинників, якщо висоти хроматографічних піків етилацетату, гептану і толуолу мають значення
37
відповідно: 97 (M 1:1), 101 (М 1:2), 120 (М 1:4) мм. При хроматографуванні штучної суміші з вмістом: етилацетату 23 %, гептану - 19% і толуолу – 41 % висоти хроматографічних піків відповідних компонентів мали значення 103 (М
1:4), 131 (М 1:1), 109 (М 1:4) мм.
Розв’язок. Суміш рідких розчинників визначали методом внутрішньої нормалізації, згідно якого концентрація кожного компоненту визначається за формулою:
Ci |
|
|
fi |
Pi |
100% , |
|
f1 P1 |
f2 P2 |
... fn Pn |
||||
|
|
|
де fi – нормувальний множник і-того компоненту;
Рі – його кількісний параметр (висота або площа піку), в даному випадку – висота;
n – кількість компонентів в суміші.
Один з компонентів (будь-який) вибираємо як стандарт. Нехай в нашому
випадку це буде етилацетат, тоді fетилацетат=1. А нормувальні множники інших компонентів розраховуємо відносно речовини-стандарту за даними для
штучної суміші за формулою:
|
|
|
|
|
|
|
fi |
|
|
Ci Pст |
. |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
Cст Pi |
|
|
||
|
|
|
|
f гептан |
19 103 4 |
|
2,60 ; |
|
|
|
|
|
fтолуол |
41 103 4 |
1,68 . |
|
|
|
|
23 131 1 |
|
|
|
|
|
23 109 4 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Тоді за значеннями, одержаними для досліджуваної суміші розраховуємо |
|||||||||||||||
кількісний склад суміші: |
|
|
|
|
|
|
|
|
|
||||||
Cетилацетат |
|
|
1 97 1 |
|
|
|
|
|
100% 6,8 % ; |
|
|||||
|
|
|
|
|
|
|
|
|
|
||||||
1 97 1 2,60 101 2 |
|
|
|
|
|
|
|||||||||
|
|
|
1,68 120 4 |
|
|
||||||||||
Cгептан |
|
|
|
2,60 101 2 |
|
100% 36,8% ; |
|
|
|||||||
|
|
|
|
|
|
|
|
||||||||
1 97 |
1 2,60 101 2 1,68 120 4 |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||
Cтолуол |
|
|
|
1,68 120 4 |
|
|
|
100% 56,4% . |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||||||
1 97 |
1 2,60 101 2 1,68 120 4 |
|
|
||||||||||||
|
|
|
|
|
|
|
|
||||||||
Задача 6. При аналізі етанолу на вміст води методом внутрішнього стандарту були одержані такі дані: наважка розчинника – 9,3543 г, маса розчинника з додаванням бутанолу як внутрішнього стандарту – 10,6912 г; висоти хроматографічних піків води – 43 мм, бутанолу – 23 мм; ширини на половині висоти піків 2,4 мм та 4,0 мм відповідно.
Ємність масою 17,8435 г, в якій готувалася калібрувальна суміш, після додавання бутанолу мала масу 18,4763 г, – води – 19,7589 г. Висоти хроматографічних піків калібрувальної суміші: бутанолу – 74 мм (ω0,5=1,8 мм); води - 60 мм (ω0,5=3,5 мм). Розрахуйте вміст води в розчиннику.
38
Розв’язок. Обчислимо маси компонентів калібрувальної суміші:
mkбутанол = mбутанол+ємність- mємність= 18,4763-17,8435=0,6328 г; mkвода = m вода+бутанол+ємність- mбутанол+ємність=19,7589-18,4763=1,2826 г; mkбутанол + вода=m вода+бутанол+ємність- mємність=19,7589-17,8435=1,9154 г.
За даними, одержаними для калібрувальної суміші, розраховуємо склад та кількісні параметри (в даному випадку – площі хроматографічних піків):
C k |
|
|
|
mбутанолk |
|
100% |
0,6328 |
|
100% 33,04% |
; |
||||
|
|
|
|
|
|
|
|
|||||||
бутанол |
|
mk |
|
mk |
|
|
|
0,6328 1,2826 |
|
|
||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
бутанол |
вода |
|
|
|
|
|
||||
C k |
|
|
|
mk |
|
|
100% |
|
1,2826 |
100% |
66,96 % ; |
|
||
|
|
вода |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|||||||
вода |
|
mk |
|
mk |
|
|
0,6328 1,2826 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||||||
|
|
бутанол |
|
вода |
|
|
|
|
|
|
|
|
||
Рkбутанол=h∙ω0,5=74·1,8=133 мм2; Рkвода=60·3,5=210 мм2.
Далі розраховуємо нормувальний множник для води (для бутанолу як внутрішнього стандарту він дорівнює 1):
f |
|
|
Cводаk |
Pбутанолk |
|
66,96 133 |
1,28. |
|
вода |
C k |
|
Pk |
33,04 210 |
||||
|
|
|
|
|
||||
|
|
|
|
|
|
|||
|
|
|
бутанол |
вода |
|
|
|
|
Тоді за даними для досліджуваного спирту визначаємо в ньому вміст води за формулою:
C X |
|
PводаХ |
fвода |
mбутанолХ |
100% |
43 2,4 1,28 (10,6912 9,3543) |
100% 20,52 %. |
|
|
|
|
|
|
||||
вода |
|
P Х |
|
m Х |
|
23 4,0 9,3543 |
|
|
|
|
|
|
|
||||
|
|
бутанол |
|
розчинника |
|
|
|
|
Задача 7. Аналіз суміші газів на хроматографі показав, що компоненти А, В і С утримувалися в колонці протягом: А – 58 с, В - 2 хв 49 с; , С - 4 хв 09 с; ширини піків на половині висоти для компонентів: А - 1,04 мм, В - 1,31 мм, С - 2,16 мм. Довжина колонки - 2 м. Знайдіть висоту, еквівалентну теоретичній тарілці (ВЕТТ), для А і В та число еквівалентних теоретичних тарілок для С. Швидкість руху стрічки самописця - 360 мм/год.
Розв’язок. Спочатку необхідно розрахувати відстані утримування компонентів, перевівши час утримування у с, а швидкість руху стрічки – у
мм/с:
lA= τ∙ w =58·(360:3600)=5,8 мм; lB=169·(360:3600)=16,9 мм; lC=249·(360:3600)=24,9 мм.
Кількість теоретичних тарілок для кожного компонента розраховують за формулою:
|
|
l |
|
2 |
5,8 |
|
2 |
|
|
16,9 |
|
2 |
|
|
24,9 |
2 |
||||
n 5,54 |
|
r |
|
5,54 |
|
|
|
172; |
n |
|
5,54 |
|
|
923 ; n |
|
5,54 |
|
|
737 . |
|
A |
|
0,5 |
|
|
1,04 |
|
|
|
В |
|
1,31 |
|
|
С |
|
2,16 |
|
|||
|
|
|
|
|
|
|
|
|
||||||||||||
Висоту, еквівалентну теоретичній тарілці (ВЕТТ), розраховують як:
39

H |
|
|
L |
|
2000 |
11,6мм ; |
H |
|
|
|
L |
|
2000 |
2,2мм . |
A |
|
|
В |
|
|
|||||||||
|
|
nA |
172 |
|
|
|
|
nВ 923 |
|
|||||
|
|
|
|
|
|
|
|
|
||||||
Задача |
8. Розрахуйте |
логарифмічні |
|
індекси |
Ковача та проведіть |
|||||||||
ідентифікацію невідомої речовини за такими даними для часів утримування:
нормальних вуглеводнів |
C6Н14 |
- 1 |
хв 05 |
сек (τz); |
|
. |
C7Н16 |
- 2 |
хв 22 |
сек (τz+1); |
|
невідомої речовини - |
2 хв 45 сек (τx); |
||||
інертної речовини |
- |
|
22 сек (τo). |
||
Табличні індекси Ковача |
для деяких |
речовин: пентанол - 700,3; 1- |
|||
бромбутан - 716,8; гексанон-2 – 729,4; 1-хлорпентан - 732,2; толуол - 766,8;
октен-1- 783,7.
Розв’язок. Експериментальний індекс Ковача розраховуємо (з врахуванням переведення часу утримування у с) за формулою :
I 100 |
lg( x |
o ) lg( z |
o ) |
100 z 100 |
lg(165 |
22) |
lg( 65 22) |
100 6 717,0 ; |
lg( z 1 |
o ) lg( z |
o ) |
lg(142 |
22) |
lg( 65 22) |
що відповідає значенню табличного індексу Ковача для 1-бромбутану (716,8). Задача 9. При аналізі суміші двох компонентів, була одержана
хроматограма з такими характеристиками: ω0,5(А) = 2,5 мм; ω0,5(В) = 1,8 мм; відстань між максимумами хроматографічних піків Δl = 7,4 мм. Визначте критерій розділення та оцініть ефективність розділення цих компонентів.
Розв’язок. Критерій розділення розраховуємо за формулою:
K p |
|
lr |
|
7,4 |
1,72. |
|||
(1) |
(2) |
2,5 |
1,8 |
|||||
|
|
|
|
|||||
|
|
0,5 |
0,5 |
|
|
|
|
|
Оскільки значення критерію розділення є більшим від 1 (1,72>1), то розділення є повним і параметри кожного піку можна точно визначити.
Задача 10. Розрахуйте кількість теоретичних тарілок та висоту, еквівалентну теоретичній тарілці, якщо на колонці довжиною 2,0 м в оптимальних умовах хроматографування одержали коефіцієнт селективності для двох піків КС = 0,06 і критерій розділення КР =0,9.
Розв’язок. Критерій розділення та коефіцієнт селективності зв’язані між собою співвідношенням, з якого можна визначити число теоретичних тарілок:
|
|
|
|
K 2 |
|
|
(0,9)2 |
|
|
K p 0,424Kc n |
→ |
n |
|
|
1251. |
||||
P |
|
|
|||||||
(0,424)2 |
K 2 |
(0,424)2 (0,06)2 |
|||||||
|
|
|
|
|
|
||||
|
|
|
|
|
C |
|
|
|
|
Тоді висоту, еквівалентну теоретичній тарілці, можна розрахувати як:
L 2000
H 1,60 мм. n 1251
40
