
- •1.1. Еволюція хімії лікарських засобів
- •1.2. Предмет та об’єкти дисципліни «Органічний синтез лікарських засобів»
- •2.1. Сучасні вимоги до лікарських препаратів
- •2.2. Стратегія органічного синтезу ЛР
- •2.3. Загальні принципи комп’ютерного пошуку та конструювання ЛЗ
- •2.4. Схема розробки нового лікарського препарату
- •2.5. Особливості органічного синтезу лікарських субстанцій
- •3.1 Вплив функціональних груп на біологічну активність молекули
- •3.1.1. Вплив алкільних груп
- •3.1.2. Ефект галогенів
- •3.1.3. Вплив гідроксильних груп
- •3.1.5. Вплив аміногруп.
- •3.1.6. Дія кислотних угруповань
- •3.1.7. Вплив ненасичених зв’язків
- •5.1.1. Галогенпохідні в якості засобів для наркозу
- •5.1.2. Дихлороетиламінний фармакофор та його роль в створенні протипухлинних засобів
- •Етери та естери
- •5.3. Альдегіди та кислоти. Вітаміни F и В15
- •6.2. Пептиди
- •6.4. Похідні γ-аміномасляної кислоти.
- •6.5. Інші амінокислоти у фармацевтичних препаратах
- •7.1. Заміщені циклогексани
- •7.2. Камфора
- •7.3. Похідні адамантану
- •7.4. Стероїди з циклопентафенантреновою структурою. Вітамін D
- •8.1. Антисептики фенольного ряду
- •8.2. Аміноспирти ароматичного ряду
- •8.2.1. Аміноалкілбензени, похідні амфетаміну
- •8.2.2. Синтез адреноблокаторів фенольного ряду (анаприлін)
- •8.2.3. Похідні п-амінофенолу
- •8.3. Похідні бензенової та саліцилової кислот
- •8.4. Похідні п-амінобензенових кислот
- •8.4.1. Протитуберкульозні засоби – похідні п-амінобензенової кислоти
- •8.4.2. Анестетики на основі п-амінобензенової кислоти
- •8.5. Похідні сульфанілової кислоти
- •8.6. Антигістамінні препарати ряду діарилметану
- •8.7. Оксопохідні нафталену
- •9.1.1. Синтез протипухлинних речовин групи азирідину та оксирану
- •9.1.2. Антибіотики, що містять чотиричленне азетидинове ядро
- •9.2. Лікарські речовини на основі п'ятичленних гетероциклів
- •9.2.1. Аскорбінова кислота
- •9.2.2. Антибактеріальні нітрофурани
- •9.2.3. Противиразкові препарати з фурановим фрагментом (ранітидин, лупітидин)
- •9.2.4. Похідні піролу та індолу
- •9.2.5. Похідні піролідину в якості ноотропних та антигіпертензивних засобів
- •9.2.6. Похідні імідазолу та бензімідазолу
- •9.2.7. Похідні піразолу
- •9.2.8. Похідні тіазолу. Вітамін В1
- •9.3. Похідні шестичленних гетероциклів
- •9.3.1. Похідні бензопірану
- •9.3.2. Токофероли (вітамини групи Е)
- •9.3.3. Похідні піридину, хіноліну та ізохіноліну
- •9.3.4. Похідні піримідину
- •Похідні піримідинів з антивірусною (антиСНІД-овою) активністю
- •9.3.5. Похідні бензотіазинів.
- •9.3.6. Пуринові основи
- •9.4. Синтез лікарських засобів з семичленним гетероциклом. Похідні дибензодіазепінового ряду
- •9.5. Лікарські засоби – похідних біциклооктану.
106
Вітамін В1 входить до складу ферменту кокарбоксилази, що є пірофосфатним естером тіаміну:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
NH3 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H C |
+ |
|
|
|
|
- . |
2H O |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
2Cl |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
O |
O |
|
N CH2 |
|
|
|
N |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
P |
|
|
O |
|
|
P |
|
O |
|
CH2 |
CH2 |
S |
|
N |
|
|
CH3 |
|
||||||
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
OH |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Кокарбоксилаза
9.3. Похідні шестичленних гетероциклів
З шестичленних гетероциклів становлять наступні:
а) з одним гетероатомом:
O N
Піран Піридин
N
Хінолін
б) з двома гетероатомами:
N
 N
N
N N
Піримідин Піразин
O
C
HN
 C
C  O
O  NH
NH
Урацил
найбільший інтерес для медицини
NH
Піперидин
 N
N
Ізохінолін
NH
NH
Піперазин
S
NH
Фентіазин
|
107 |
Ці гетероцикли є основою молекул багатьох |
природних лікарських |
речовин (з груп алкалоїдів, вітамінів, антибіотиків), а |
також синтетичних |
препаратів (група снодійних – похідні барбітурової кислоти; група аміназину; ципрофлоксацин; протитуберкульозні препарати – ізоніазид, фтивазид та багато інших).
9.3.1. Похідні бензопірану
Бензопірани – конденсовані системи, що складаються з бензенового та піранового кілець. Їх похідні, що містять карбонільну групу, називають хромонами та кумаринами. Кумарини та хромони розповсюджені як структурні компоненти деяких природних сполук.
O |
O |
O |
O |
1,4-Бензопіран |
1,2-Бензопіран |
Кумарин |
|
|
OH |
O |
|
|
|
|
|
|
|
|
|
O |
O |
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
4-Гідроксикумарин |
|
|
|
|
Хромон |
|
|
|
|
|
|
|
||||||||
Природні |
|
токсини, |
що |
|
містяться |
|
в |
конюшині, є |
похідними |
|
|||||||||||||
4-гідроксикумарина, сполуки, |
що має властивості антикоагулянта. Цим |
|
|||||||||||||||||||||
обумовлено |
застосування |
варфарину, дикумарину, неодикумарину – |
|
||||||||||||||||||||
антикоагулянтів непрямої дії, що використовують для тривалого зниження |
|
||||||||||||||||||||||
згортання крові при лікування тромбозів, тощо. Дія непрямих антикоагулянтів |
|
||||||||||||||||||||||
пов’язана з порушенням біосинтезу протромбіну, проконвертину та інших |
|
||||||||||||||||||||||
факторів згортування крові. Ці сполуки ефективні при введенні в організм, та |
|
||||||||||||||||||||||
не впливають на згортування крові поза організмом. Першим представником |
|
||||||||||||||||||||||
антикоагулянтів групи 4-гідроксикумарину був дикумарин. Однак, у зв’язку з |
|
||||||||||||||||||||||
високою токсичністю цієї сполуки, її поступово замінили неодикумарином. |
|
||||||||||||||||||||||
Синтезують |
дикумарин |
|
та |
|
неодикумарин |
|
|
з’єднуючи |
дві |
моле |
|||||||||||||
гідроксикумарину |
за |
допомогою |
|
формальдегіду |
|
або |
етилгліоксила |
||||||||||||||||
відповідно. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
OH |
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
+ |
CH2O |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
O |
C |
|
|
C |
O |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
O |
|
|
O |
|
|
|
|
|
|
|
|
|
||||||
108
|
|
OH |
|
OH |
|
|
|
|
|
CH2 |
|
|
|
O |
C |
O O |
C |
|
|
|
O |
||
|
|
Дикумарин |
|
||
OH |
O |
C |
OC2H5 |
OH |
|
|
|
|
|||
|
O |
C |
H |
|
|
|
+ |
C |
|
||
O |
C |
|
O |
||
O |
|
|
O |
||
|
OH |
O |
OC2H5 |
|
|
|
C |
OH |
|||
|
|
CH |
|
|
|
|
C |
O |
C |
|
|
|
O |
O |
O |
|
|
Неодикумарин
Схожу структуру мають більш активні сучасні препарати фепромарон та ацекумарол:
O
C 
OH CH2 C2H5
CH 
C 
O O
Фепромарон
9.3.2. Токофероли (вітамини групи Е)
|
O |
|
OH |
C |
CH3 |
CH2 |
||
|
CH |
|
|
C |
NO2 |
O |
O |
Ацекумарол
В наш час виділені з природних джерел або одержані синтетично7 речовин – токоферолів, що мають Е-вітамінну активність. За хімічною будовою всі вони є похідними хроману(бензо-γ-дигідропірану). Вітаміни групи Е містяться в рослинних оліях, зародках пшениці, яєчному жовтку, м’ясі, молоці, тощо. Для добування вітамінуЕ пшеничні зародки екстрагують органічними
розчинниками. Токофероли розрізняються між собою за кількістю та розміщенням метильних груп у бензеновому кільці. Найбільшу активність має α-токоферол, молекула якого містить три метильні групи. Фармакопейним препаратом є α-токоферолу ацетат.
109
|
|
|
|
|
|
HO |
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
CH2 |
(CH2CH2 |
CHCH2 |
)3 |
H |
|
|||||||||||||
|
|
|
|
|
|
H3C |
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
α-Токоферол |
|
|
|
|
|
|
||||||||||||
Одержують токоферол |
|
майже |
|
|
виключно |
|
синтетичним |
шляхом– |
|||||||||||||||||||||||||
конденсацією триметилгідрохінону з фітилбромідом та наступним ацилуванням |
|||||||||||||||||||||||||||||||||
утвореного α-токоферолу: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
HO |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
HO |
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
+ |
|
Br |
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C16H33 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
H3C |
|
|
|
OH |
C |
C16H33 |
H3C |
|
|
|
O |
|
CH3 |
|
|||||||||||||||||||
|
|
|
|
|
|
CH3 |
|
|
|
|
|
||||||||||||||||||||||
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
(CH3CO)2O |
|
CH3COO |
|
|
CH3 |
C16H33 |
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
|
|
|
|
O |
CH |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
α-Токоферолу ацетат |
|
|
|
|
|||||||||||||
В |
|
організмі |
відбувається |
|
|
гідроліз |
|
|
естерного, якийзв’язку |
||||||||||||||||||||||||
супроводжується вивільненням фенольного гідроксилу, наявність |
якого |
||||||||||||||||||||||||||||||||
забезпечує антиоксидантну активність токоферолів. На відміну від вітамінів |
|||||||||||||||||||||||||||||||||
групи К, |
на активність |
токоферолів |
впливає довжина та будова бічного |
||||||||||||||||||||||||||||||
ланцюга. Зміни в ньому можуть призвести до повного зникнення активності. |
|||||||||||||||||||||||||||||||||
9.3.3. Похідні піридину, хіноліну та ізохіноліну |
|
|
|
|
|
|
|||||||||||||||||||||||||||
Ера |
застосування піридинових сполук в медичній |
практиці почалась з |
|||||||||||||||||||||||||||||||
часу відкриття вітамінуРР. Після встановлення на початку ХХ. йогост структури, виявилось, що ця важлива для організму речовина має дуже просту
будову |
і є |
піридин-3-карбоновою (нікотиновою) кислотою. Свою |
назву |
нікотинова кислота одержала від нікотину– алкалоїду тютюну, окисненням |
|||
якого |
можна |
одержати цю сполуку. Після встановлення її |
структури |
розгорнулися масштабні дослідження похідних піридину для пошуку нових синтетичних лікарських засобів.
110
Вітамін РР – це нікотинова кислота та її амід(нікотинамід). Нестача цієї речовини викликає у людей захворювання пелагру. Назва вітаміну РР пішла від «Pellagra preventive» – попереджує пелагру. Нікотинова кислота міститься в органах тварин (печінка, нирки, м'язи), в молоці, рибі, дріжджах, овочах, гречаній крупі та .інДобувають її тільки синтетично. Промисловий синтез нікотинової кислоти здійснюють шляхом окислення β-піколіну. З одержаної нікотинової кислоти синтезують амід через утворення метилового естеру та дії на нього аміаку при підвищеній температурі.
|
CH3 |
O |
COOH |
COOCH3 |
|
|
CH3OH |
|
|
N |
|
N |
N |
|
|
|
Нікотинова кислота |
|
|
|
|
|
O |
|
|
|
NH3, 180 oC |
C NH2 |
|
|
|
|
N |
|
|
|
|
Нікотинамід |
|
До похідних піридину відноситься також і група вітамінівВ . Вони
6
містяться у дріжджах, неочищених зернах злаків, картоплі, овочах, м'ясі, рибі,
молоці, печінці, яєчному |
жовтку. |
До цієї групи |
входять |
три |
споріднених |
|
сполуки: піридоксин, піридоксаль, піридоксамін (1–3), |
які |
перетворюються |
||||
одна в одну за допомогою відповідних |
. реакційДисульфідне |
похідне |
||||
піридоксину – піридітол |
(4) є |
антидепресантом, |
який |
виявляє |
ноотропні |
|
властивості. Ноотропний ефект має також і препарат мексидол (5), що у вигляді гідрохлориду (6) (емоксилін) застосовується також в якості ретинопротектора для захисту сітківки ока.
|
|
R |
|
|
|
CH2OH |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
HO |
|
|
|
CH2OH |
HO |
|
|
CH2-S- |
|
HO |
|
|
|
|
||
|
|
|
|
|
||||||||||||
H3C |
|
|
|
|
H3C |
|
|
|
|
|
CH3CH2 |
|
N |
|
CH3 |
|
|
N |
|
N |
2 |
|
|
||||||||||
(1) R = CH2OH |
|
|
(4) |
|
|
|
|
R' |
|
|||||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
(5) R' = (-CH COOH) |
|||||||||||
(2) R = CHO |
|
|
|
|
|
|
|
2 |
2 |
|||||||
|
|
|
|
|
|
|
(6) R' = HCl |
|
||||||||
(3) R = CH2NH2 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
(1) Піридоксин; (2) Піридоксаль; (3) Піридоксамін; (4) Піридітол; (5) Мексидол; (6) Емоксилін.
|
|
|
|
|
111 |
Вітаміни |
групи В6 |
приймають |
участь у білковому обміні в якості |
||
коферментів, зокрема, в |
реакціях |
переамінування |
та |
декарбоксилювання |
|
амінокислот. Фармакопейним препаратом є піридоксину гідрохлорид, який |
|||||
одержують за |
методом |
Преображенського, виходячи |
з |
монохлороцтової |
|
кислоти. На першій стадії під дією метилату натрію утворюється метиловий естер метоксиоцтової кислоти, в подальшому проводять його конденсацію з ацетоном, яка приводить до метоксиацетилацетону. Реакція останнього з ціанацетамідом дозволяє сформувати піридиновий цикл, подальші хімічні перетворення якого приводять до піридоксину:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
2OCH3 H3C |
|
O |
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
ClCH2COOH |
CH3ONa |
|
|
|
|
|
|
C |
|
CH3 |
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
CH OCH |
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
CH2OCH3 |
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
2 |
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CN |
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
C |
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HNO3 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
CNCH2 |
|
C |
|
|
NH2 |
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
C |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
|
|
N |
|
|
|
|
|
|
O |
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
H3C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
CH2OCH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2OCH3 |
|
|
|
|
||||||||||||||||||||||||
|
O2N |
|
|
|
|
|
|
|
|
|
CN |
PCl |
|
O2N |
|
|
|
|
|
|
CN H2, Pd |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
H3C |
|
|
O |
|
|
|
|
|
|
|
H3C |
N |
Cl |
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
CH2OCH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2OH |
|||||||||||||||
|
|
H2N |
|
|
|
|
|
|
|
|
|
CH2NH2 NaNO , HCl |
|
HO |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2OH |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
|
|
|
|
|
|
|
N |
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Піридоксин |
||||||||||||||||
Важливе значення в якості фармакологічних засобів мають також похідні піридин-4-карбонової (ізонікотинової) кислоти. Ізоніазид – гідразід ізонікотинової кислоти (ГІНК) – один з представників великого класу речовин з протитуберкульозною активністю. Методом одержання ізоніазиду є перетворення ізонікотинової кислоти через хлорангідрид у естер з наступною дією гідразингідрату (ізонікотинову кислоту одержують з γ-піколіну):
112
CH3 |
COOH |
COOR |
|
|
[O] |
|
R-OH, H+ |
NH2-NH2 |
|
-H2O |
N |
-H O |
N |
- ROH |
N |
2 |
|||
|
|
|
|
|
O NH NH2 |
O |
O |
NH N |
CH |
C |
C |
OH |
C |
|
|
H |
O CH3 |
|
|
|
|
|
|
|
N |
-H2O |
N |
O CH3 |
|
|
|
|||
|
|
|
|
OH |
Ізоніазид |
|
|
Фтивазид |
|
Конденсацією ізоніазиду з ароматичними та аліфатичними альдегідами одержують відповідні похідні, що також застосовуються в хіміотерапії туберкульозу, наприклад, фтивазид, який одержують конденсацією ваніліну (3-метокси-4-гідроксибензальдегіду) з ізоніазидом.
Тіопохідні ізонікотинової кислоти, а саме її тіоаміди, також мають здатність пригнічувати розвиток мікобактерій. Таку будову мають препарати етіонамід та протіонамід. Основою синтезу цих речовин є конденсація α-піколіну з алкілгалогенідом(через утворення літійорганічної сполуки). Це призводить до нарощування бічного ланцюга. В подальшому атом Нітрогену піридинового кільця окиснюють доN-оксиду. Галогенування хлороксидом фосфору призводить до утворення4-хлорпіридинів. Атом галогену, в свою чергу, нуклеофільно заміщують на нітрильну групу, яку дією H2S переводять у тіоамідну:
|
1. C6H5Li |
|
H2O, CH3COOOH |
|
|
2. R-Cl |
|
||
N |
CH3- HCl |
N |
CH2-R |
+ |
N CH2-R |
||||
|
Cl |
|
CN |
O - |
POCl3 |
NaCN |
|
H2S |
|
|
N CH2-R |
N |
CH2-R |
|
|
S C |
NH2 |
|
|
N |
CH2-R |
R = CH3 |
– Етіонамід; |
R = СН2СН3 – Протіонамід
113
Дигідропіридин також є основою багатьох ЛЗ. Один з таких препаратів –
ніфедипін (корінфар) – основний |
представник антагоністів іонів кальцію– |
|||||||||||||||||
похідних 1,4-дигідропіридинів. Він викликає розслаблення гладкої мускулатури |
||||||||||||||||||
судин, розширює коронарні та периферичні артерії, знижує периферичний опір, |
||||||||||||||||||
артеріальний |
|
|
тиск, покращує |
постачання |
серця |
киснем. Ніфедипін |
||||||||||||
застосовують |
для |
|
|
профілактики та |
купіювання |
|
нападів |
стенока, придії |
||||||||||
гіпертонії та хронічної серцевої |
недостатності. З |
початку 1970-х |
років, коли |
|||||||||||||||
перші препарати цієї групи були введені в медичну |
практику, до початку |
|||||||||||||||||
нового століття, похідні дигіропіридину склали великий фармацевтичний блок |
||||||||||||||||||
антигіпертензивних |
|
|
ЛЗ. В наш |
час застосовується кілька десятків таких |
||||||||||||||
препаратів. Це ніфедипін, нікардипін, фелодипін та ін. |
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
CH OOC |
|
|
|
|
|
|
COOR1 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
CH3OOC |
|
|
|
COOC2H5 |
|||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
H3C |
|
|
N |
|
|
CH |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
H3C |
N |
CH3 |
|
|||||||||
|
|
|
|
3 |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
H |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
||||
|
(1-3) |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
(4) Фелодипін |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
(1) R=3-NO2. R1=(CH2)2-N(CH2)C6H5 |
— Нікардипін; |
|
|
|||||||||||||||
(2) R=2-NO2. R1=CH3 |
|
— Ніфедипін; |
|
|
||||||||||||||
(3) R=3-CH3 |
R1=2-OCHF2 |
|
— Ріодипін; |
|
|
|
|
|
||||||||||
Більшість препаратів цього типу отримують синтезом Ганча з двох молей ацетооцтового ефіру або його похідних з ароматичними альдегідами та аміаком:
|
|
Ar |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
Ar |
|
|||
ROOC |
H |
O |
|
COOR' |
|
ROOC |
COOR' |
||||||||
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
||||||||
|
CH2 |
+ |
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
C |
|
C |
|
Alk |
N |
Alk |
|||||||||
|
|
|
|
||||||||||||
Alk O |
|
|
|
O Alk |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
NH3 |
|
|
|
|
|
|
|
|
H |
|
|||
Похідні хіноліну займають важливе місце |
|
серед протипаразитарних |
|||||||||||||
засобів. Так, найбільш відомим і ефективним засобом |
боротьби проти всіх |
||||||||||||||
видів малярійного плазмодія є хініналкалоїд кори хінного дерева (Cinchona), |
|||||||||||||||
що росте в Азії(Індонезія) і Південній Америці. Його кора використовувалася |
|||||||||||||||
при лікуванні малярії ще в XVII столітті. У чистому вигляді хінін був виділений |
|||||||||||||||
на початку XІX століття, а |
повний синтез |
здійснено у1945 році. Налічується |
|||||||||||||
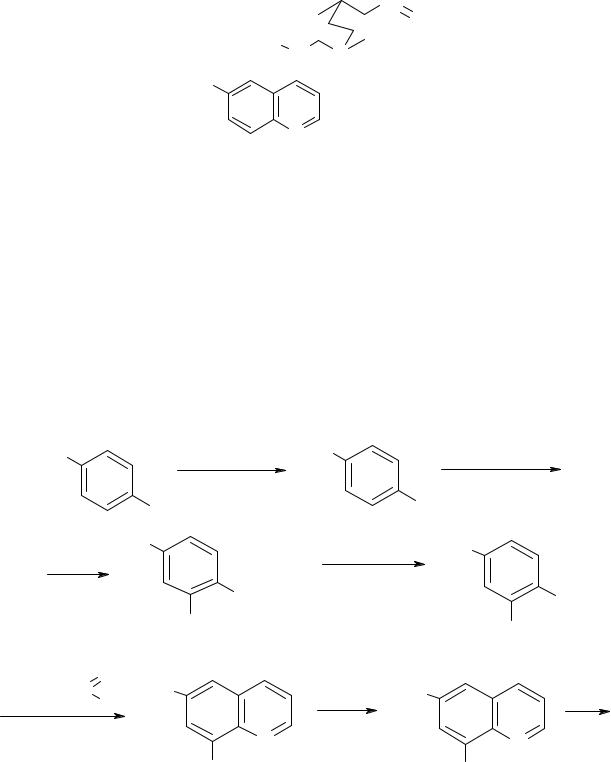
114
більше 20 алкалоїдів хінного дерева, з яких цінхонін(в молекулі хініну
гідроксиметильна група заміщена |
|
воднем) застосовують для лікування |
||||
тропічної лихоманки. |
|
|
|
|
||
|
|
|
|
|
|
CH |
HO CH |
|
|
|
CH2 |
||
|
|
|||||
|
N |
|||||
CH3O |
|
|
|
|
|
|
|
|
|
|
|
||
N
Хінін
Після заборони масового використання інсектициду ДДТ (у зв'язку з його здатністю акумулюватися в тканинах людей та тварин і приводити до отруєнь) різко зросло число випадків захворювань малярією(кілька сотень мільйонів на рік). Широке застосування синтетичних лікарських речовин, наприклад, сульфаніламідних похідних, в боротьбі з малярією призвело до виникнення резистентних (стійких) штамів плазмодія (до природного хініну збудники малярії не мають резистентності!). Тому пошук нових, більш ефективних і менш токсичних препаратів (особливо близьких за структурою до природного хініну) важко переоцінити. Першим синтетичним протималярійним препаратом був плазмохін. Хінолінове ядро в його синтезі формують за реакцією Скраупа на основі 2-нітроацетаніліду:
CH3O |
(CH3CO)2O CH3O |
HNO3, H2SO4 |
|
-CH3COOH |
NHC(O)CH3 |
|
NH |
|
|
2 |
|
|
CH3O |
NaOH CH3O |
|
-CH3COOH |
|
|
NHC(O)CH3 |
NH |
|
NO2 |
2 |
|
NO |
|
|
|
2 |
|
O |
H2 CH3O |
CH2=CH-C |
CH3O |
|
|
H |
|
H+ |
N |
N |
|
NO2 |
NH |
|
|
2 |
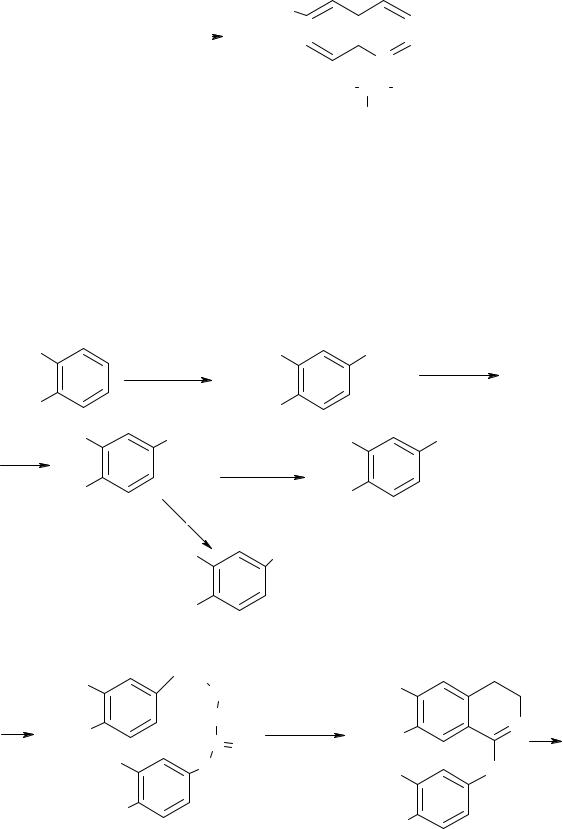
115
|
Cl-CH(CH) (CH ) |
NR |
CH3O |
|
|
|
|
|
|
|
|||
|
3 |
2 |
3 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
NH |
CH (CH2)3NR2 |
|
|||
|
|
|
|
|
|
|
|
|
|
CH3 |
|
||
|
R= C2H5 |
– Плазмохін; |
R= Н |
|
|
– Примахін |
|
||||||
Після |
відновлення |
|
|
нітрогрупи |
|
в |
|
|
, аміннуостанню |
алкілюють |
|||
хлоралкіламінами, отримуючи плазмохін або примахін відповідно.
Ряд цінних алкалоїдів, похідних ізохіноліну, містяться в опії. Один з них
– папаверин, похідне бензилізохіноліну. Папаверин |
– 6,7-диметокси-1-(3,4- |
||
диметоксибензил)-ізохінолін, використовується |
у |
вигляді |
гідрохлориду. |
Перший синтез папаверину здійснений 1910в |
році. Вихідною |
сполукою є |
|
вератрол (орто-диметоксибензен): |
|
|
|
|
CH3O |
CH2O, HCl |
CH O |
CH Cl |
KCN |
||
|
|
|
3 |
|
2 |
||
|
CH3O |
|
CH3O |
|
|
|
|
|
CH3O |
CH2CN H O, H+ |
CH3O |
|
CH2COOH |
||
|
|
|
2 |
|
|
|
|
|
CH3O |
|
|
|
CH O |
|
|
|
|
H2, Ni |
|
3 |
(2) |
|
|
|
|
|
|
|
|||
|
|
CH3O |
|
CH2CH2NH2 |
|
|
|
|
|
CH3O |
(1) |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3O |
CH2 |
CH2 |
|
CH |
O |
|
|
|
|
|
||||
|
|
|
|
3 |
|
+ |
|
|
|
|
NH |
POCl3 |
|
||
(1+2) |
CH3O |
|
|
NH |
|||
|
C O |
|
CH3O |
||||
|
|
|
|||||
|
CH3O |
CH2 |
|
CH O |
CH |
||
|
|
|
|
|
3 |
|
2 |
|
CH3O |
|
|
CH3O |
|
||
|
|
|
|
|
|
||
