
05.Альдег.кет
.pdf
|
|
|
O |
|
|
|
|
|
O |
||||
R |
|
C |
H |
+ 2 [Ag(NH3)2]OH |
|
R |
|
C |
+ 2 Ag |
|
+ 3 NH3 |
|
+ H2O |
|
|
|
|
|
|||||||||
|
|||||||||||||
|
|
|
аммиачный раствор |
|
|
|
|
ONH4 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
оксида серебра |
|
|
|
|
|
|
|
|
|
В роли окислителя может выступать также реактив Фелинга (смесь раствора сульфата меди (ІІ) со щелочным раствором натрийкалиевой соли виннокаменной кислоты):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
CuSO4 + |
2 NaOH |
|
|
|
|
Cu(OH)2 |
|
|
+ |
Na2SO4 |
|
|
||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||
|
COONa |
|
|
|
|
|
|
|
|
COONa |
H |
|
|
|
|
|
|
COONa |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
CH |
|
|
OH |
+ |
Cu(OH) |
|
|
|
|
CH |
|
|
O |
Cu |
O |
|
|
|
CH |
|
2 H O |
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
2 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
CH |
|
|
|
OH |
|
|
|
|
|
CH |
|
|
|
O |
|
O |
|
|
|
CH |
|
2 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
COOK |
|
|
|
|
|
|
COOK |
|
|
|
|
|
COOK |
|
|
|||||||||||||||
При нагревании альдегидов с синей фелинговой жидкостью образуется красный осадок оксида меди (І) (качественная реакция на альдегидную группу):
|
COONa H |
|
|
|
COONa |
|
|
|
|
|
|
|
|
|
|
|
|
COONa |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O 2 H2O |
|
|
O |
|
|
|
|
|
|
|
|
OH |
|
CH |
|
|
O |
|
O |
|
CH |
|
|
|
|
|
|
|
|
CH |
|
|||||||||||
|
|
Cu |
|
+ |
R |
|
C |
|
|
R |
|
C OH |
+ |
Cu2O |
|
|
+ 4 CH |
|
|
|
||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
OH |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
CH |
|
|
O |
H |
O |
|
|
CH |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
COOK |
|
|
|
COOK |
|
|
|
|
|
|
|
|
|
|
|
|
COOK |
|||||||||||
Реакции альдегидов с реактивами Толленса и Фелинга могут быть использованы для отличия альдегидов от кетонов, т.к. кетоны в этих условиях не окисляются.
Кетоны окисляются лишь сильными окислителями при нагревании. При этом возможен разрыв углеродного скелета кетона как с одной, так и с другой стороны карбонильной группы (правила Попова – Вагнера). В обоих случаях образуются кислоты с меньшим числом атомов углерода, чем в исходном кетоне. Однако главным направлением реакции является окисление соседнего с карбонилом наименее гидрогенизированного атома углерода и последующий разрыв его связи с карбонильным углеродом:
|
|
O |
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
O |
||
|
|
|
|
|
|
|
|
|
|
|
[ O ] |
|
|
|
|
|
|
|
||
CH3 |
|
C |
|
CH2 |
|
CH2 |
|
CH3 |
|
CH3 |
|
C |
OH + CH3 |
|
CH2 |
|
C OH |
|||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
пентанон-2 |
этановая кислота |
пропановая кислота |
|||||||||||||
По образовавшимся продуктам окисления можно судить о строении кетона.
Реакция окисления-восстановления (реакция Канниццаро). В
присутствии концентрированной щѐлочи формальдегид и альдегиды, не содержащие атомов водорода при α-углеродном атоме, вступают в реакцию диспропорционирования. При этом одна из двух молекул альдегида восстанавливается до соответствующего спирта, а другая – окисляется до кислоты (в присутствии КОН – до соли кислоты).
130

2 H |
|
|
|
C |
O |
|
|
KOH |
H |
|
|
C |
O |
|
+ |
CH3OH |
||||||||||||
|
|
|
H |
|
|
|
|
|
|
OK |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
CH3 |
O |
KOH |
|
|
|
|
CH3 |
O |
|
|
|
|
|
|
CH3 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
2 CH3 |
|
|
C |
|
C |
|
|
CH3 |
|
C |
|
C |
+ |
CH |
3 |
|
C |
|
CH OH |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
OK |
|
|
|
|
2 |
|||||||
|
|
|
CH3 |
|
|
|
|
|
|
CH3 |
|
|
|
|
|
CH3 |
||||||||||||
Альдегиды, содержащие атомы водорода при α-углеродном атоме, в условиях реакции Канниццаро осмоляются.
Б. Р е а к ц и и с у ч а с т и е м α - у г л е р о д н о г о а т о м а
Карбонильная группа, являясь электроноакцепторным заместителем, увеличивает подвижность атомов водорода при α-углеродном атоме.
Реакции галогенирования. Альдегиды и кетоны реагируют с галогенами с образованием α-галогенопроизводных:
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
Cl |
O |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
CH3 |
|
|
CH2 |
|
C H + Cl2 |
|
|
|
CH3 |
|
|
|
CH |
|
|
C H |
+ |
HCl |
||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||
пропионовый альдегид |
|
|
|
-хлорпропионовый альдегид |
|
|||||||||||||||||||||
|
|
|
|
O |
|
|
|
|
|
|
|
O |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
C |
|
|
CH3 + Br2 |
|
|
|
CH3 |
|
|
C |
|
CH2Br + |
HBr |
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
ацетон |
|
|
|
|
|
бромацетон |
|
|
|
|||||||||||||||
α-Галогенопроизводные альдегидов и кетонов проявляют слезоточивое действие и называются лакриматорами.
Установлено, что эти реакции идут с предварительным превращением карбонильного соединения в енол. Например, бромирование ацетона начинается с его енолизации в процессе кето-енольной таутомерии:
|
|
H |
|
O |
|
H |
|
|
|
|
O |
|
|
|
H |
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
H |
|
C |
|
C |
|
C |
|
H |
|
|
|
CH3 |
|
C |
|
|
|
|
CH2 |
|||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
H |
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|||||
кетонная форма ацетона |
|
|
енольная форма ацетона |
|||||||||||||||||||||
В ацетоне при комнатной температуре содержится всего 2,5 . 10-4 % енольной формы. Между тем скорость бромирования ацетона равна скорости енолизации и не зависит от концентрации брома. Щелочи и кислоты способствуют образованию енольных форм. α-Моногалогенпроизводные получают в присутствии минеральной кислоты. В щелочной среде происходит дальнейшее замещение атомов водорода у α-углеродного атома ацетона:
131

O
CH3 C CH3
CH3
O C
H B |
|
|
|
|
|
|
|
|
|
r |
|
|
|
|
O |
||||
B |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
r |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
CH3 |
|
C |
|
CH2Br |
||
- HBr |
|
|
|||||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
r |
|
|
|
|
|
|
|
|
|
O |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
CH3 |
|
|
|
C |
|
|
|
CH2Br |
|
|
|
|
|
|
|
CH3 |
|
|
C |
|
|
CHBr |
r |
|
|
|
|
CH3 |
|
|
|
C |
|
|
|
CHBr2 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- HBr |
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
r |
|
|
|
|
|
|
|
|
|
O |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
r |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
C |
|
|
CHBr2 |
|
|
|
|
|
|
CH3 |
|
|
C |
|
|
CBr2 |
|
|
|
|
CH3 |
|
|
|
C |
|
|
CBr3 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- HBr |
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Причем на каждой из последующих стадий равновесие все больше и больше смещается в сторону енольной формы бромзамещѐнного ацетона.
Тригалогенкарбонильные соединения в щелочной среде расщепляются с образованием соли карбоновой кислоты и тригалогенметана (CHHal3). Например, в случае йодирования в щелочной среде реакция идѐт с выделением желтых кристаллов йодоформа:
|
|
O |
|
|
|
O |
|
|
|
|
|
O |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NaOH |
|
|
|
|
|
|
|
CH3 |
|
C |
|
CH3 + 3 I2 |
|
|
CH3 |
|
C |
|
C I3 |
|
CH3 |
|
C |
|
ONa + CHI3 |
||||||
|
|
- 3 HI |
|
|
|
|
|
||||||||||||||||
йодоформ
Йодоформ применяют в медицине как антисептик в виде присыпок, мазей при лечении инфекционных ран, язв и др.
В. Р е а к ц и и к о н д е н с а ц и и
Альдольная конденсация. Альдегиды, содержащие атомы водорода у α- углеродного атома, в слабощелочной среде вступают в реакцию альдольной конденсации. При этом происходит присоединение α-углеродного атома одной молекулы альдегида к карбонильному углероду другой молекулы и образуется а л ь д о л ь, соединение с альдегидной и спиртовой группами:
 O O CH3 C
O O CH3 C H + HCH 2 C
H + HCH 2 C H
H
CH3COOK, |
|
|
OH |
|
O |
|||
K2SO3 |
|
|
|
|
|
|
||
|
|
|
|
|
||||
|
|
CH3 |
|
CH |
|
CH2 |
C H |
|
|
|
|
|
|||||
этаналь (уксусный альдегид) |
3-гидроксибутаналь |
|
( -оксимасляный альдегид) |
||
|
В реакцию вступает только группа, находящаяся в α-положении к карбонилу, так как водородные атомы только этой группы в достаточной степени активируются карбонильной группой:
|
|
|
|
|
O |
|
|
|
|
O |
|
|
|
|
|
OH |
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
OH - |
|
|
|
|
|
|
|
|
|
|
|
|||
CH3 |
|
CH2 |
|
C |
+ HCH |
|
C |
CH3 |
|
CH2 |
|
CH |
|
CH |
|
C |
|||||||
|
|
H |
|
H |
|
|
|
|
|
H |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
CH3 |
|
|
|
|
альдоль |
|
CH3 |
|
|||||||||
|
|
|
пропаналь |
|
|
|
|
|
|
3-гидрокси-2-метилпентаналь |
|
||||||||||||
132

М е х а н и з м . В слабощелочной среде гидроксид-ион отщепляет протон от α- углеродного атома альдегида с образованием сопряженного енолят-аниона:
H |
O |
|
|
O |
|
|
|
O |
|
CH2 |
C |
|
CH2 |
C |
|||
H C C |
H - H2O |
H |
|
H |
||||
|
|
|
|
|
|
|||
H |
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
C |
O |
|
|
|
|
|
|
H |
|
|
||
|
|
|
|
|
|
|
|
мезомерно стабилизированный енолят-анион
Енолят-анион атакует электрофильный углерод второй молекулы альдегида с образованием альдоля:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
||||
|
|
|
O |
|
|
|
|
O |
|
|
|
|
|
|
|
O |
|
CH3 |
|
C |
|
+ CH2 |
C |
|
|
CH3 |
CH |
|
CH2 |
C |
|
||||
|
H |
H |
|
H |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
OH
+ HOH O
- OH  CH3 CH CH2 C
CH3 CH CH2 C H
H
Продукты альдольной конденсации ( -оксиальдегиды) при нагревании легко теряют воду, превращаясь в α,β-ненасыщенные альдегиды. Дегидратация происходит благодаря очень большой подвижности водородных атомов в α- положении по отношению к карбонильной группе:
|
|
OH H |
|
O |
|
0 |
|
|
|
|
|
|
|
O |
|
||||
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|||
CH3 |
|
CH |
|
CH |
|
C H |
|
CH3 |
|
CH |
|
|
CH |
|
C H |
+ H2O |
|||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
||||||||||||
альдоль (3-гидроксибутаналь) |
|
|
кротоновый альдегид (бутен-2-аль) |
||||||||||||||||
Реакция отщепления молекулы воды от альдоля с образованием ненасыщенного альдегида называется кротоновой конденсацией. В ряде реакций карбонильных соединений продукт альдольного присоединения выделить не удается, сразу получается ненасыщенное карбонильное соединение. То есть кротоновую конденсацию можно рассматривать как переход от предельного альдегида к непредельному через образование альдоля с последующей дегидратацией.
Альдольная конденсация кетонов происходит в более жестких условиях. При этом образуются -кетоспирты:
|
|
|
|
|
|
|
|
O |
|
|
|
OH |
O |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Ba(OH)2 |
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
C |
|
O |
+ HCH 2 |
|
C |
|
CH3 |
|
CH3 |
|
C |
|
CH2 |
|
C |
|
CH3 |
||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||
|
|
CH3 |
ацетон |
|
|
|
CH3 кетоспирт |
||||||||||||||||||
4-гидрокси-4-метилпентанон-2
133

При нагревании с H2SO4(конц.), кетоны вступают в реакцию кротоновой конденсации с образованием непредельных кетонов:
|
|
CH3 |
|
|
O |
|
|
|
CH3 |
|
O |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
H2SO4 |
|
|
|
|
|
|
|
|
|
|
|
|
CH3 + H2O |
CH3 |
|
C |
|
O |
+ HCH 2 |
|
C |
|
CH3 |
CH3 |
|
C |
|
|
CH |
|
C |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
ацетон |
|
|
|
|
|
|
|
|
|
|
окись мезитила |
||||||||||||||
Альдольная и кротоновая конденсации возможны также между альдегидами и кетонами.
Сложноэфирная конденсация (реакция Тищенко). При нагревании альдегидов с алкоголятами алюминия в неводной среде образуются сложные эфиры карбоновых кислот:
|
|
O |
|
O |
|
|
|
O |
||||||||||
CH3 |
|
|
(C2H5O)3Al |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|||||||||||
|
C H |
+ |
H C |
|
CH3 |
|
CH3 C O CH2 CH3 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
этиловый эфир уксусной кислоты
Г. Р е а к ц и и п о л и м е р и з а ц и и
Реакции полимеризации характерны для альдегидов; кетоны не
полимеризуются. |
|
|
|
|
|
|
|
|
|
|
|
Тримеризация |
формальдегида. |
Под |
влиянием разбавленных кислот |
||||||||
формальдегид образует |
циклический |
кристаллический тример триоксан |
|||||||||
(триоксиметилен): |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
H |
+ |
|
O |
O |
|||
|
|
|
|
|
|
||||||
3 H |
|
|
C |
|
|
|
|||||
|
|
H |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
O |
|||
|
|
|
|
|
|
|
|
|
|
||
формальдегид |
|
|
|
триоксан (триоксиметилен) |
|||||||
Полимеризация формальдегида.
Безводный газообразный формальдегид в присутствии катализаторов превращается в высокомолекулярный полиформальдегид (полиоксиметилен) с т. пл. 185 оС. Этот полимер обладает высокой прочностью и применяется для изготовления синтетического волокна, труб, листов, деталей автомобилей, электротехнических деталей и т. д.
n CH2 |
|
O |
|
Fe2(CO3)3 |
|
|
CH2 |
|
|
O |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
n |
||||||
|
||||||||||||||||||
формальдегид |
полиформальдегид |
|||||||||||||||||
В водных растворах формальдегид находится в равновесии со своим |
||||||||||||||||||
гидратом: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
H |
|
|
|
|
|
|
|
|
|
H |
|
|
OH |
|||||
C |
|
O |
+ H |
|
OH |
|
|
|
|
|
|
C |
||||||
|
|
|
|
|
|
|
|
|||||||||||
H |
|
|
|
|
|
|
|
|
|
H |
|
|
OH |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
гидрат |
|||
формальдегид |
|
|
|
|
|
|
|
|
|
формальдегида |
||||||||
134

В результате отщепления воды от молекул гидрата формальдегида образуется смесь линейных полимеров, в которых величина п колеблется в широких пределах. При п=80–100 этот полимер называется параформальдегид (параформ). Он выпадает в виде белого осадка при стоянии концентрированного раствора формалина (40% водного раствора формальдегида с добавлением метанола):
HO CH |
2 |
OH |
+ |
n.HO CH |
OH + HOCH OH |
|
|
|
HOCH |
2 |
( |
OCH |
) |
OCH OH |
|
|
|
||||||||||||
|
|
|
2 |
2 |
- H2O |
|
|
2 n |
2 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
формальдегид |
|
|
|
параформальдегид (параформ) |
||||||
При нагревании с разбавленной серной кислотой протекает деполимеризация параформальдегида и триоксиметилена, что делает их удобным транспортабельным сырьѐм для получения безводного газообразного формальдегида.
Тримеризация и тетрамеризация ацетальдегида. Полимеризация ацетальдегида в присутствии следов серной кислоты при 20 оС приводит к образованию паральдегида, при 0 оС – метальдегида:
|
|
O |
|
+ |
|
|
CH3 |
|||
|
|
|
|
|
|
|
|
|
||
|
|
H |
|
O |
O |
|||||
|
C |
|
|
|||||||
3 CH3 |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||
H 20 oC |
H3C |
|
O |
|
CH3 |
|||||
|
|
|
||||||||
|
|
|
|
|
|
|
||||
ацетальдегид |
паральдегид |
|
O 4 CH3 C H
H
H + |
H3C |
|
|
O CH |
|
||||
|
O |
|
|
3 |
|||||
|
|
|
|
|
|
|
|||
0 oC |
|
|
|
|
|
|
|
|
|
H3C |
|
|
|
|
|
O |
|
||
|
|
|
|
|
|||||
|
|
O CH3 |
|
||||||
|
|
|
|
||||||
|
метальдегид |
|
|||||||
Паральдегид – жидкость, метальдегид – твѐрдое вещество, используется в быту как сухое горючее («сухой спирт»). При нагревании паральдегида и метальдегида с минеральными кислотами происходит их деполимеризация.
Фенолформальдегидные смолы. Формальдегид вступает в реакцию поликонденсации с фенолом с образованием фенолформальдегидных смол (см. раздел «Фенолы»).
=============================================================
5.2. АРОМАТИЧЕСКИЕ АЛЬДЕГИДЫ И КЕТОНЫ
=============================================================
5.2.1. НОМЕНКЛАТУРА И ИЗОМЕРИЯ АРОМАТИЧЕСКИХ АЛЬДЕГИДОВ И КЕТОНОВ
Ароматические альдегиды и кетоны содержат карбонильную группу, которая может быть связана либо с углеродом бензольного ядра, либо с
135

углеродом боковой цепи. Если карбонильная группа в альдегидах связана непосредственно с углеродом бензольного ядра, то их обычно называют по отвечающим им ароматическим кислотам:
O O C H C
H C H
H
|
|
|
|
|
CH3 |
||
бензойный альдегид |
n - толуиловый альдегид |
||||||
(бензальдегид) |
(4-метилбензальдегид) |
||||||
Альдегиды с карбонильой группой в боковой цепи называют как |
|||||||
арилзамещенные альдегиды жирного ряда: |
|
|
|
|
|||
|
|
|
O |
|
|
|
O |
|
CH2 |
|
C H |
CH2 |
|
C H |
|
|
|
|
|||||
|
|
|
|
|
|
||
|
CH3 |
фенилуксусный альдегид |
n - толуилуксусный альдегид |
Кетоны бывают чисто ароматическими и жирно-ароматическими. К первому типу относятся кетоны, в которых карбонильная группа связана с двумя ароматическими углеводородными радикалами. Если один из радикалов алифатический, то такие кетоны относят к жирно-ароматическим. Для названий и тех, и других чаще всего используют радикало-функциональную номенклатуру. Широко применяют также тривиальные названия.
O |
O |
C |
CH3 C |
дифенилкетон (бензофенон) |
метилфенилкетон (ацетофенон) |
5.2.2. СПОСОБЫ ПОЛУЧЕНИЯ АРОМАТИЧЕСКИХ АЛЬДЕГИДОВ И КЕТОНОВ
Для получения ароматических альдегидов и кетонов могут быть использованы те же методы, что и для получения алифатических альдегидов и кетонов (окисление первичных и вторичных ароматических спиртов, омыление геминальных дигалогенпроизводных, пиролиз кальциевых солей карбоновых кислот и др.) Вместе с тем существует также ряд специфических методов.
Окисление ароматических углеводородов. Прямое окисление толуола и других производных, содержащих метильную группу, связанную с бензольным кольцом, приводит к соответствующим альдегидам:
136

|
|
|
|
|
|
O |
|
|
CH3 |
V2O5 |
|
C H |
|
||||
|
|
+ O2 |
|
|
|
+ |
H2O |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|||
|
||||||||
толуол |
|
бензальдегид |
|
|||||
Этот способ используется как в лаборатории, так и в промышленности.
Гидролиз геминальных дигалогенопроизводных. Толуол хлорируют при УФ-облучении до хлористого бензилидена, который подвергают гидролизу с образованием бензальдегида:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
O |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
CH3 |
+ 2 Cl2; h |
|
CHCl 2 |
+ 2 H2O |
HO |
|
|
|
CH |
|
|
|
C H |
|||||||||||||
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- 2 HCl |
|
|
|
|
- 2 HCl |
|
|
|
|
|
|
|
|
|
- H2O |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
толуол |
|
хлористый |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бензальдегид |
||||||||||
|
|
|
|
|
бензилиден |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Этим методом получают различные производные бензальдегида, например 2,6- дихлорбензальдегид из 2,6-дихлортолуола.
Непосредственное введение альдегидной группы в бензольное кольцо (реакция Гаттермана – Коха). Эту реакцию называют ещѐ реакцией формилирования. Формилирование ароматических углеводородов проводят смесью оксида углерода (ІІ) и хлористого водорода в присутствии хлорида алюминия. Предполагается, что в качестве промежуточного продукта здесь получается неустойчивый хлористый формил:
|
|
O |
|
|
|
C H |
|
|
CO + HCl |
+ |
HCl |
|
AlCl3 |
||
|
|
|
|
бензол |
|
бензальдегид |
|
М е х а н и з м :
1) |
CO |
|
HCl |
H |
O |
|
|
+ |
C Cl |
|
|
||||
|
|
|
|
||||
|
|
|
|
хлорангидрид муравьиной кислоты |
|||
|
|
|
|
(хлористый формил) |
|
||
2) H |
|
O |
|
H |
+ |
O |
|
C |
Cl |
+ AlCl 3 |
C |
+ AlCl 4 |
|||
|
|
|
|
|
|
|
|
137

|
|
+ |
O |
O |
|
O |
|
H |
|
C H |
|||
|
C |
|
H C |
H |
||
3) |
|
|
|
+ |
|
- H + |
|
|
|
|
|
|
|
|
|
комплекс |
комплекс |
|
||
4) |
H + |
+ |
AlCl 4 |
HCl + |
AlCl 3 |
|
Бензальдегид этим методом образуется с небольшим выходом. Реакция используется в основном для получения алкил- и галогенозамещенных ароматических альдегидов.
Синтез через магнийорганические соединения. Фенилмагнийбромид,
полученный из бромбензола и магния, вводят в реакцию со сложным эфиром муравьиной кислоты. Расщеплением образовавшегося магнийорганического соединения получают ароматические альдегиды:
|
|
|
O |
MgBr |
|
Br |
MgBr |
|
CH |
O R |
O |
O |
C H |
||||
|
H |
C |
|
|
|
|
|
|
|
||
|
+ Mg |
O |
R |
|
|
|
эфир безводн. |
|
|
R O MgBr |
|
бромбензол |
фенилмагнийбромид |
|
|
|
бензальдегид |
Восстановление хлорангидридов кислот. На палладиевых и никелевых катализаторах хлорангидриды ароматических карбоновых кислот восстанавливают до ароматических альдегидов. Катализатор при этом частично дезактивируют серой, чтобы предупредить дальнейшее восстановление альдегида в спирт.
O |
O |
|
C Cl |
C H |
|
H2 |
+ HCl |
|
Pd, Ni |
||
|
||
хлорангидрид бензойной кислоты |
бензальдегид |
Реакция Фриделя – Крафтса. Основным методом получения ароматических кетонов является ацилирование ароматических углеводородов по Фриделю – Крафтсу. В качестве ацилирующих агентов наиболее часто используют галогенангидриды или ангидриды карбоновых кислот в присутствии кислот Льюиса:
138
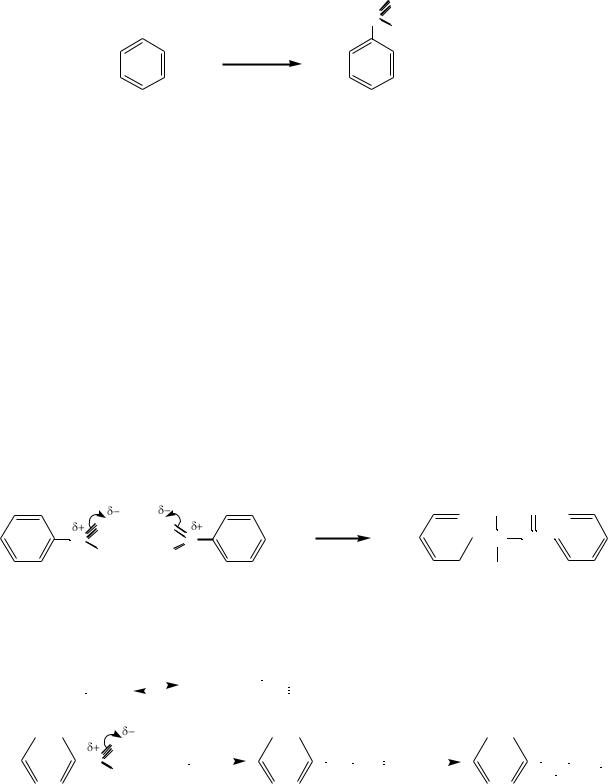
|
O |
|
|
C CH |
|
|
3 |
|
|
CH3COCl |
HCl |
|
+ |
|
|
AlCl3 |
|
бензол |
ацетофенон |
|
5.2.3. ХИМИЧЕСКИЕ СВОЙСТВА АРОМАТИЧЕСКИХ АЛЬДЕГИДОВ И КЕТОНОВ
По химическим свойствам ароматические альдегиды и кетоны во многом сходны с альдегидами и кетонами жирного ряда. Так, ароматические альдегиды дают реакцию «серебряного зеркала», образуют ацетали, циангидрины, гидросульфитные соединения и др., однако не вступают в реакцию альдольной конденсации из-за отсутствия в них водорода при α- углеродном атоме и трудно полимеризуются. Ароматические кетоны обладают меньшей реакционной способностью, чем кетоны жирного ряда. Поэтому они не образуют гидросульфитных соединений, бензофенон не реагирует с синильной кислотой. Вместе с тем ароматические альдегиды и кетоны дают ряд специфических реакций.
Бензоиновая конденсация. Специфичной для ароматических альдегидов является конденсация под влиянием солей синильной кислоты с образованием ароматических α-оксикетонов (бензоинов) (Н. Н. Зинин):
O |
+ |
O |
C |
KCN |
C H |
H |
|
||
|
|
|
|
OH O

 C C
C C
H
бензальдегид |
бензоин |
М е х а н и з м :
1) K |
|
C |
|
|
N |
|
|
|
|
|
|
|
|
K+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
+ C |
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
изомери- |
|
|
|
|
|
|
OH |
|||||||||||||||
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
зация |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
2) |
|
|
|
|
|
|
|
H |
+ C |
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
C |
|
|
N |
|
|
|
|
|
|
C |
|
C |
|
|
N |
|||||||||||
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
карбанион |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
оксониевый ион |
|
|
" - " распределяется по |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
" - " не распределяется |
|
|
всему иону, возникает |
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
равномерно по всему иону |
|
|
|
|
эффект сопряжения |
|||||||||||||||||||||||||||||
139
