
Лекція № 9
Тема: Кисневовмістні органічні сполуки. Спирти, альдегіди, кетони.
Мета: Вивчити властивості одноатомних та багатоатомних спиртів, їх будову, добування та застосування. Навчитися складати структурні формули спиртів та назви їх по замістниковій номенклатурі, а також формули ізомерів. Вивчити властивості альдегідів і кетонів, їх добування та застосування. Навчитися складати формули ізомерів альдегідів та кетонів та називати їх по номенклатурі ІЮПАК.
План:
1. Номенклатура і ізомерія спиртів.
2. Властивості спиртів.
3. Добування та застосування спиртів.
4. Будова, номенклатура, ізомерія альдегідів.
5. Властивості і добування альдегідів.
6. Номенклатура, ізомерія кетонів.
7. Властивості і будова кетонів.
Література.
Хомченко І.Г., Загальна хімія., К.: Вища школа, 1993. С. 329 – 342.
Спирти
і феноли – це
органічні речовини, молекули яких
містять гідроксильні групи
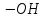 ,
сполучені з вуглеводневим радикалами.
Загальна назва спиртів і фенолів –гідроксильні
сполуки.
,
сполучені з вуглеводневим радикалами.
Загальна назва спиртів і фенолів –гідроксильні
сполуки.
Відмінність спиртів і фенолів полягає в тому, що у фенолах гідроксильні групи сполучені безпосередньо з бензольним ядром. Приклади спиртів і фенолів:
Спирти: Феноли:
СН3-СН2ОН С6Н5ОН
Залежно від числа гідроксильних груп, що містяться в молекулі, розрізняють одноатомні, двохатомні, трьохатомні спирти:
СН3 – СН2 – СН2; СН2 – СН – СН2; СН2 – СН – СН2
│ │ │ │ │ │
ОН ОН ОН ОН ОН ОН
Одноатомний спирт Двохатомний спирт Трьохатомний спирт
Спирти
поділяються також на первинні,
в
яких гідроксильна група сполучена з
первинним вуглецевим атомом, вторинні
–
група
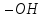 приєднана до вторинного атома вуглецю
ітретинні
– група
приєднана до вторинного атома вуглецю
ітретинні
– група
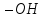 знаходиться біля третинного атома
вуглецю. Приклади таких спиртів:
СН3
знаходиться біля третинного атома
вуглецю. Приклади таких спиртів:
СН3
│
СН3 – СН2; СН3 – СН – СН3; Н3С – С – СН3
│ │ │
ОН ОН ОН
Первинний спирт Втроринний спирт Третинний спирт
До
простих ефірів належать сполуки, в яких
атом кисню сполучений з двома вуглецевими
радикалами, наприклад
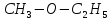 .
.
Номенклатура. За міжнародною номенклатурою назви спиртів утворюють від назв відповідних алканів з додаванням закінчення –ол. Після закінчення зазнають номер вуглецевого атома, біля якого знаходиться гідроксильна група. Нумерацію вуглецевих атомів починають з того кінця ланцюга, до якого ближче розташована гідроксильна група. У назви двохатомних та інших багатоатомних спиртів перед закінченням –ол додають префікс ди- (ді-), три- і т.д. залежно від кількості груп, а потім зазнають положення всіх груп. Приклади:
3 2 1 1 2 3
СН3 – СН2 – СН2 – ОН; СН2 – СН – СН2
Пропанол-1 │ │ │
ОН ОН ОН
Прпантріол-1,2,3
1 2 3 4 5
СН3 – СН – СН – СН – СН3
│ │ │
ОН ОН СН3
4-Метилпентандіол-2,3
Для
деяких спиртів поширені назви за
раціональною номенклатурою. Ці назви
утворюють з назви радикала і слова
“спирт”,
наприклад:
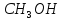 – метиловий спирт,
– метиловий спирт,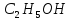 – етиловий спирт,
– етиловий спирт,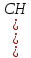 – ізопропіловий спирт.
– ізопропіловий спирт.
Ізомерія.
Ізомерія
спиртів пов’язана як з розгалуженням
вуглецевого ланцюга, так і з різним
положенням гідроксильної групи.
Наприклад, бутанол
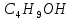 може мати такі ізомери:
може мати такі ізомери:
4 3 2 1 4 3 2 1
СН3 – СН2 – СН2 – СН2; СН3 – СН2 – СН – СН3;
│ │
ОН ОН
Бутанол-1 Бутанол-2
СН3
│
3 2 1 3 2 1
СН3 – СН – СН2; Н3С – С – СН3
│ │ │
СН3 ОН ОН
2-Метилпропанол-1 2-Метилпропанол-2
Наведені
ізомери різняться властивостями,
наприклад, температурами кипіння, які
дорівнюють 117,3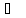 (бута-нол-1); 99,5
(бута-нол-1); 99,5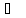 (бутанол-2); 108,4
(бутанол-2); 108,4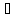 (2-метилпропанол-1); 82,5
(2-метилпропанол-1); 82,5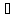 (2-метилпропанол-2).
(2-метилпропанол-2).
Насичені одноатомні спирти
До насичених одноатомних спиртів належать аліфатичні спирти, молекули яких містять одну гідроксильну групу, сполучену з алкільним радикалом.
Гомологічний
ряд. Члени
гомологічного ряду насичених одноатомних
спиртів мають загальну формулу
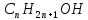 ,
де n=1,
2, 3, 4. Першими членами цього ряду є
,
де n=1,
2, 3, 4. Першими членами цього ряду є
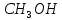 – метанол,
– метанол,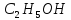 – етанол,
– етанол,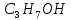 – пропаном,
– пропаном,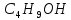 – бутанол.
– бутанол.
Властивості. За звичайних умов насичені одноатомні спирти з нормальною будовою ланцюга, що містять від 1 до 11 атомів вуглецю, - це безбарвні рідини. Зі збільшенням молекулярної маси спиртів їх розчинність у воді зменшується: метанол, етанол і пропаном змішуються з водою в будь-яких співвідношеннях, бутанол та інші різкі за звичайних умов спирти розчиняються у воді мало, а вищі спирти практично не розчиняються у воді.
Спирти мають досить високі температури кипіння. Це пов’язано з асоціацією їх молекул, яка відбувається так само, як і асоціація молекул води, за рахунок утворення водневих зв’язків між молекулами ROH (R – вуглеводневий радикал):
R R R
│ │ │
O – H O – H…. O – H
Хімічні властивості спиртів зумовлені переважно наявністю гідроксильної групи в молекулі.
1. Взаємодія з лужними металами. Під дією лужних металів на спирти утворюються алкоголяти:
2C2H5 – OH + 2Na → 2C2H5 – ONa + H2
Етилат натрію
Ця
реакція відбувається з розривом зв’язку
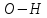 у гідроксильній групі.
у гідроксильній групі.
2.
Взаємодія з галогеноводнями та іншими
галогеновмісними речовинами.
Під дією галогеноводнів або хлоридів
фосфору
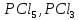 на насичені одноатомні спирти відбувається
заміщення групи ОН у спиртах на галогени,
наприклад:
на насичені одноатомні спирти відбувається
заміщення групи ОН у спиртах на галогени,
наприклад:
С2H5OH + HBr → C2H5Br + H2O
Ця реакція за участю гідроксильної групи відбувається з розривом зв’язку С-О.
3. Дегідратація. При наявності фосфорної або концентрованої сірчаної кислоти при нагріванні від спиртів відщеплюється вода і утворюються ненасичені вуглеводні, наприклад:
CH3
– CH(OH) – CH3
 CH3
– CH═CH2
+ H2O
CH3
– CH═CH2
+ H2O
4. Взаємодія з кисневмісними кислотами. Спирти реагують з кислотами, утворюючи складні ефіри. Наприклад, під час взаємодії етанолу з азотною кислотою утворюється складний ефір азотної кислоти – метилнітрат:
CH3OH + HNO3 → CH3 – O – NO2 + H2O
Складні ефіри утворюються також при взаємодії спиртів з органічними кислотами.
5. Окислення. Під час спалювання спиртів (окислення киснем повітря) утворюються оксид вуглецю (IV) і вода:
2CH3OH + 3O2 → 2CO2 + 4H2O
При каталітичному окисленні киснем повітря, окислені перманганатом калію, дихроматом калію при наявності сірчаної кислоти утворюються альдегіди і кетони, наприклад:
CH3 – CH2OH + [O] →CH3 – COH + H2O
Етанол Ацетальдегід
O
││
СН3 – CH(OH) – CH3 + [O] →CH3 – C – CH3 + H2O
Пропанол 2 Ацетон
Третинні спирти більш стійкі до окислення. Тільки під дією сильних окиснювачів вони можуть окислюватися з розщепленням вуглецевого ланцюга.
6. Дегідрування. Під час каталітичного дегідрування первинних спиртів утворюються альдегіди, вторинні спирти – кетони:
СН3 – СН2 – СНОН →СН3 – СН2 – СОН + Н2
Первинний спирт Альдегід
СН3 – СН(ОН) – СН3 → CH3 – CО – CH3 + Н2
Вторинний спмрт Кетон
Каталізатором
дегідрування спиртів звичайно є мідь
(температура 300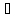 ).
).
Добування. Насичені спирти можна добути гідролізом галогенопохідних відповідних алканів водним розчином лугу, наприклад:
С4Н9Br
+ H2O
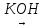 C4H9OH
+ HBr
C4H9OH
+ HBr
Бромбутан Бутанол
Спирти утворюються також при гідратації алкенів:
СН3 – СН ═СН2 + H2O →СН3 – СН – СН3
Пропілен │
ОН
Пропанол 2
Спирти можна добути відновленням інших кисневмісних сполук – альдегідів і кетонів.
Насичені багатоатомні спирти
Багатоатомні спирти містять у молекулі кілька гідроксильних груп. Двохатомні спирти називають діолами, або гліколями. Назви двохатомних спиртів за міжнародною номенклатурою складають з назви відповідного алкану з додаванням закінчення –діол і цифр, які означають положення гідроксильної групи в ланцюгу.
Трьохатомні спирти називать тріодами, або гліцеринами. Їх назви будують аналогічно до назв двохатомних спиртів, аале з додаванням закінчення –тріол.
Найпростіші представники двох- і трьохатомних спиртів:
НО – СН2 – СН2 – ОН; СН2 – СН – СН2
Етандіол -1,2, або етиленгліколь │ │ │
ОН ОН ОН
Пропантріол -1,2,3, або гліцерин
Властивості. Хімічні властивості багатоатомних спиртів багато в чому подібні до властивостей одноатомних спиртів. При цьому в реакціях може брати участь як одна, так і дві і більше гідроксильних груп.
Взаємодія з гідроксидом міді (ІІ). Ця реакція характерна тільки для багатоатомних спиртів. Осад гідроксиду міді(ІІ) розчиняється в етиленгліколі та гліцерині з утворенням розчину яскраво-синього кольору:
Сu(OH)2
+ 2CH2OH
– CH2OH→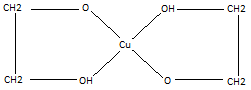 +
H2O;
+
H2O;
Гліколят міді (ІІ)
Сu(OH)2
+ 2CH2OH
– CHOH – CH2OH→
Гліцерат міді (ІІ)
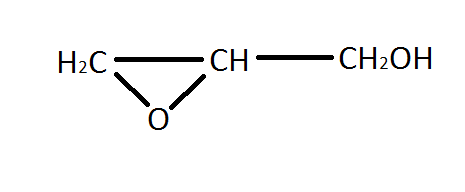
Добування і застосування етиленгліколю і гліцерину. Етиленгліколь добувають у промисловості гідратацією (приєднання води) етиленоксиду:
Як і одноатомні спирти, етиленгліколь можна добути гідролізом галогенопохідних алканів водним розчином лугів. Для цієї реакції необхідні 1,2-дигалогенопохідні етану:
СН2Сl—СН2С1+2Н2О
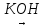 СН2ОН—СН2ОН+2НСl
СН2ОН—СН2ОН+2НСl
1 2-Дихлоретан
Етиленгліколь утворюється під час пропускання етилену крізь розчин перманганату калію, при цьому відбуваються окислення і гідратація етилену:
СН2=СН2+ [0] +Н20 → СН2ОН—СН2ОН
Гліцерин добувають синтетично з пропілену.за такою схемою:
CH2═CH
– CH3
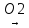 CH2═CH
– CH2OH
CH2═CH
– CH2OH
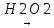
Пропілен Аліловий спирт
→
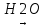 CH2OH
– CHOH - CH2OH
CH2OH
– CHOH - CH2OH
Гліцерин входить до складу природних сполук - жирів рослинного і тваринного походження - і може бути виділений з них.
Етиленгліколь і гліцерин використовуються в промисловому органічному синтезі. Гліцерин застосовують для виробництва мастил, як зм'якшувач шкіри і тканин, у парфюмерній, фармацевтичній і харчовій промисловості.
Водні розчини етиленгліколю і гліцерину замерзають при низьких температурах, тому їх використовують як антифризи - рідини з низькою температурою замерзання, які застосовуються для охолодження двигунів внутрішнього згоряння.
Гліцерин.
Єдиний практично важливий представник трьохатомного спирту. Сиропоподібна солодка рідина, без кольору, добре розчинна у воді. Водні розчини гліцерину замерзають при низькій температурі.
Гліцерин широко розповсюджений у природі, є основним спиртом, приймає участь у будові молекул різних груп ліпідів. У промисловості гліцерин добувають гідролізом ацилгліцеринів
Гліцерин широко використовується в багатьох галузях промисловості. Основна його кількість розходується для добування похідних - гліфталевих смол, нітрогліцерину.
У харчовій промисловості гліцерин використовують для приготування лікерів та безалкогольних напоїв, у паперовій та шкіряній промисловості - для збереження матеріалів від висихання. Він входить до складу багатьох косметичних препаратів і широко використовується як пом'ягчуюча шкіру речовина
Карбонільні
сполуки містять у молекулі карбонільну
групу
![]() .Карбонільні
сполуки поділяють на альдегіди і кетони.
.Карбонільні
сполуки поділяють на альдегіди і кетони.
Альдегіди. У молекулах альдегідів карбонільна група сполучена з вуглеводневим радикалом і атомом водню (або з двома атомами водню), тобто загальна формула цих сполук R – COH.
Номенклатура. Назви альдегідів за замісниковою номенклатурою згідно з правилами IUРАК будують з назви відповідного вуглеводню з додаванням закінчення -аль. Перед коренем назви записують бічні замісники, зазначаючи їх положення і кількість. Нумерацію атомів вуглецю починають з вуглецевого атома карбонільної групи. Приклади:
4 3 2 1 5 4 3 2 1
СН2—СН2—СН2—СOH; СН3—СН—СН—СН2—СOH;
Бутаналь │ │
СН3 СН3
3,4 Диметилпентаналь
Для альдегідів широко використовують тривіальні назви, які аналогічні назвам відповідних органічних кислот. У табл. наведено назви за замісниковою номенклатурою та тривіальні назви деяких насичених альдегідів.
|
|
|
Назва |
|
Формула |
|
|
|
|
За замісниковою |
Тривіальна |
|
|
Номенклатурою |
|
|
НСНО |
Метаналь |
Формальдегід, мураши |
|
|
|
ний альдегід |
|
СН3—СНО |
Етаналь |
Адетальдегід, оцтовий Альдегід |
|
СН3—СН2 —СНО |
Пропаналь |
Пропіоновий альдегід |
|
СН3—СН2 —СН2 —СНО |
Бутаналь |
Масляний альдегід |
|
СН3—СН(СН3)—СНО |
2-Метил пропаналь |
Ізомасляний альдегід |
|
СН3—(СН2)3—СНО |
Пентаналь |
Валеріановий альдегід |
|
СН3—СН(СН3)—СН2-СНО |
3 Метил бутаналь |
Ізовалеріановий альдегід |
|
СН3—С(СН3)2-СНО |
2,2-Диметил- |
Триметилоцтоєий альдегід |
|
|
пропаналь |
|
Властивості. Перший член гомологічного ряду насичених альдегідів НСНО — безбарвний газ, кілька наступних альдегідів - рідини. Вищі альдегіди - тверді речовини.
Хімічні властивості альдегідів.
1. Реакції приєднання. Альдегіди легко приєднують ціановодень НСN і гідросульфіт натрію NаНSО3:
CN
│
CH3COH + HCN → CH3 – C – OH
│
H
OH
│
CH3COH + NаНSО3 → CH3 – C – SО3Na
│
H
Продукти приєднання NaНSО3 - кристалічні речовини, розчинні у воді. При нагріванні з кислотами вони розпадаються з утворенням вихідного альдегіду. Тому останню реакцію використовують для очистки альдегідів.
При наявності нікелевих або платинових каталізаторів альдегіди приєднують водень і відновлюються до первинних спиртів, наприклад:
СН3—СН2—СOH + H2 → СН3—СН2—СН2ОН
Приєднуючи спирти, альдегіди утворюють сполуки, що мають назву ацетaлів. Реакція відбувається при наявності кислот:
OC2H5
│
СН3—СН2—СOH
+
2C2H5OH
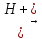 СН3—СН2—СH
+ H2O
СН3—СН2—СH
+ H2O
│
OC2H5
Ацеталі - це прості ефіри двохатомного спирту. Вони легко гідролізуються з утворенням вихідних речовин.
2. Окислення. Під час окислення альдегідів, яке відбувається дуже легко, утворюються органічні кислоти або їхні солі. Наприклад, під час окислення оцтового альдегіду утворюється оцтова кислота:
СН3COH + [О] → СН3 - СООН
Якісною реакцією на альдегіди є реакція срібного дзеркала - окислення їх аміачним розчином оксиду срібла при нагріванні:
СН3—СН2—СOH +2[Аg(NН3)2]ОН →
O
║
СН3—СН2—С—ONH4 + 2Ag + 3NH3 + H2O
Металічне срібло, яке виділяється, вкриває стінки посудини тонким блискучим шаром.
Альдегіди окислюються також гідроксидом міді (II), який відновлюється до червоно-коричневого оксиду міді (І):
СН3—СH2—СOH + 2Сu(ОН)2 → СН3—СH2—СOOH +Сu2О+2Н2О.
3. Взаємодія з галогенами. Як уже зазначалось, атом водню біля другого вуглецевого атома вуглеводневого ланцюга альдегідів має підвищену рухливість. Під час взаємодії альдегідів з хлором чи бромом цей водневий атом легко заміщується на галоген, наприклад:
СН3—СН2—СOH + Вr2 → СН3—СНВr—СOH + НВr.
Добування. 1.Альдегіди утворюються під час окислення або каталітичного дегідрування (відщеплення водню) первинних спиртів:
СН3—СН2—СН2ОН + [O] → СН3—СН2—СOH + Н2О
Пропанол 1 Пропаналь
Каталітичне дегідрування спирта відбувається при наявності металічної міді.
2.Альдегіди можна добути гідролізом дигалогенопохідних алканів, наприклад:
CH3 – CHBr2 + H2O → CH3COH + 2HBr
3. Альдегіди утворюються під час взаємодії алкенів з оксидом вуглецю (II) і воднем 9(оксосинтез):
СН2=СН2 + СО + Н2 → СН3—CH2COH
Оксосинтез відбувається при наявності каталізаторів - комплексних сполук кобальту під тиском 5-10 МПа.
Кетони
У
молекулах кетонів карбонільна група
сполучена з двома однаковими або
різними
вуглеводневими радикалами
![]() .
Найпростішим кетоном є ацетон
.
Найпростішим кетоном є ацетон
CH3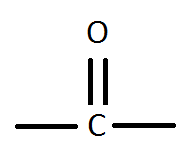 CH3
CH3
Номенклатура. Згідно з міжнародною номенклатурою назви кетонів будують з назв відповідного вуглеводню з додаванням закінчення -он. У кінці назви ставлять цифру, що зазначає положення в ланцюгу атома вуглецю, з яким сполучений карбонільний кисень. Нумерацію головного ланцюга починають, як завжди, з найбільш розгалуженого кінця вуглецевого ланцюга. Якщо розгалуженість однакова, то нумерують з того кінця ланцюга, до якого ближче розташована карбонільна група. Назви кетонів за раціональною номенклатурою будують з назв радикалів, сполучених з карбонільною групою з додаванням слова «кетон». Приклади:
1 2 3 4 5
СН3—С—СН2—СН2—СН3
║
O Пентанон 2 (метилпропілкетон)
Для деяких кетонів поширені тривіальні назви, наприклад ацетон.
Ізомерія. Ізомерія кетонів зумовлена розгалуженістю вуглецевого ланцюга і різним положенням карбонільного кисню. Розглянемо як приклад ізомери кетону С5Н10О. Для цього кетону можливі два ізомерних кетони, що містять п'ять вуглецевих атомів у головному ланцюгу і один ізомерний кетон з головним ланцюгом з чотирьох атомів вуглецю:
1 2 3 4 5
СН3— СН2— С —СН2—СН3
║
О Пентанон 3
Властивості. Простіші кетони є безбарвними рідинами, які розчиняються у воді. Вищі кетони — тверді речовини. Багато хімічних властивостей, характерних для альдегідів, виявляються і у кетонів.
1. Реакції приєднання. Так само, як і альдегіди, кетони приєднують речовини, що містять нуклеофільні частинки, наприклад ціановодень і гідросульфіт натрію:
CN
│
CH3 – C – CH3 + HCN → CH3 – C – CH3
║ │
O OH
Гідрування кетонів при наявності каталізаторів приводить до утворення вторинних спиртів:
CH3
– C – CH3
+ H2
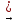 CH3
– CHOH – CH3
CH3
– CHOH – CH3
║
O
На відміну від альдегідів кетони не взаємодіють із спиртами, не вступають у реакції конденсації і полімеризації.
2. Окислення. Кетони окислюються значно важче, ніж альдегіди, і тільки сильними окислювачами. Під час окислення кетонів відбувається розрив (деструкція) вуглецевого ланцюга і утворюється суміш продуктів. Кетони не вступають у реакцію срібного дзеркала.
Добування. 1. Кетони утворюються під час окислення або каталітичного дегідрування вторинних спиртів, наприклад:
СН3-СНОН-СН3 + [О] → СН3-С-СН3 + Н2О
║
O
Каталітичне дегідрування проводять з використанням мідних каталізаторів.
2. Як і альдегіди, кетони можна добути гідролізом дигалогенопохідних алканів. Щоб утворився кетон, обидва атоми галогену у вихідній сполуці повинні знаходитись біля одного (не кінцевого) атома вуглецю:
3. Кетони утворюються внаслідок приєднання води до гомологів ацетилену при наявності каталізаторів — солей ртуті (II).
