
Лекція № 8
Тема: Ненасичені та ароматичні вуглеводні.
Мета: вивчити властивості та способи добування алкенів. Навчитися складати структурні формули ненасичених вуглеводнів та виводи їх ізомери. Вивчити властивості та способи отримання алкінів. Навчитися складати структурні формули ненасичених вуглеводнів та виводити їх ізомери. Вивчити будову молекули бензолу, властивості бензолу, характеристику гомологів бензолу. Розглянути практичне застосування гомологів бензолу.
План:
Гомологічний ряд алкенів.
Властивості добування та застосування алкенів.
Фізичні та хімічні властивості алкенів.
Застосування алкенів.
Гомологічний ряд алкінів.
Властивості добування та застосування алкінів.
Фізичні та хімічні властивості алкінів.
Будова молекули бензолу.
Властивості бензолу.
Класифікація аренів.
Характеристика гомологів бензолу.
Застосування гомологів бензолу.
Реакція Вюрца-Фелінга та Фріделя.
Література.
Хомченко І.Г., Загальна хімія., К.: Вища школа, 1993. С. 282 – 294.
Алкени, алкіни і алкадієни належать до ненасичених органічних сполук. Ненасиченими називаються сполуки, молекули до яких містять атоми вуглецю, сполучені подвійними і потрійними зв’язками.
Гомологічний ряд алкенів.
Алкени
–
вуглеводні, в молекулах яких є один
подвійний зв’язок між атомами вуглецю
![]() .
Алкені називають такожолефінами
або
етиленовими
вуглеводнями.
.
Алкені називають такожолефінами
або
етиленовими
вуглеводнями.
Етилен.
Найпростішим
алкеном є етилен
 .
За міжнародною номенклатурою назва
етилену – етен. Структурна формула
молекули етилену має такий вигляд:
.
За міжнародною номенклатурою назва
етилену – етен. Структурна формула
молекули етилену має такий вигляд:
![]()
Розглянемо
природу зв’язків у молекулі
 з позицій сучасної електронної теорії.
В атому вуглецю, який знаходиться в
збудженому стані (
з позицій сучасної електронної теорії.
В атому вуглецю, який знаходиться в
збудженому стані (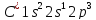 ),
гібридизації можуть зазнати не всі, а
тільки три орбіталі зовнішнього рівня:
однаs-
і дві p-
орбіталі. Третя p-
орбіталь
з неспареним електроном залишається в
незмінному вигляді. Такий тип гібридизації
(s
),
гібридизації можуть зазнати не всі, а
тільки три орбіталі зовнішнього рівня:
однаs-
і дві p-
орбіталі. Третя p-
орбіталь
з неспареним електроном залишається в
незмінному вигляді. Такий тип гібридизації
(s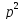 – гібридизація) спостерігається при
утворенні молекули етилену
– гібридизація) спостерігається при
утворенні молекули етилену
 .
.
Подвійний
зв’язок у молекулі етилену складається
з одного
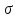 -
і одного π- зв’зків. Подвійний зв’язок
міцніший від одинарного, але не в два
рази.
-
і одного π- зв’зків. Подвійний зв’язок
міцніший від одинарного, але не в два
рази.
Гомологи
етилену.
Етилен
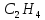 – перший член гомологічного ряду
алкенів. Послідовно додаючи до формули
гомологічну різни
– перший член гомологічного ряду
алкенів. Послідовно додаючи до формули
гомологічну різни можна одержати формули гомологів
етилену: С3Н6,
С4Н8,
С5Н10
і т.д. Загальна формула вуглеводнів ряду
алкенів СnH2n,
де n=2,3,4…
можна одержати формули гомологів
етилену: С3Н6,
С4Н8,
С5Н10
і т.д. Загальна формула вуглеводнів ряду
алкенів СnH2n,
де n=2,3,4…
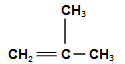
Ізомерія. Для алкенів характерні два види ізомерії. Структурна ізомерія пов’язана з різним положенням подвійного зв’язку у вуглеводневому ланцюгу і з розгалуженням ланцюга. Наприклад, бутен має такі ізомери:
 ;
;
 ;
;
Назви алкенів утворюються так. Вибирають найдовший вуглеводневий ланцюг, який містить подвійний зв’язок. Нумерують атоми вуглецю в цьому ланцюгу, починаючи з того кінця, до якого ближче розміщений подвійний зв’язок. За основу назви ізомера беруть назву алкену, що відповідає головному ланцюгу. Наприклад: бутен, якщо головний ланцюг містить 4 атоми вуглецю, пентан – 5 атомів С, октен – 8 атомів С.
Другий характерний вид ізомерії вуглеводнів з подвійним зв’язком – це просторова ізомерія або стереоізомерія. Вона зумовлена різним положенням замісників відносно площини, в якій розміщені подвійні зв'язки. Для позначення стереоізомерів алкенів використовують префікси цис- і транс-. У молекулі цис- ізомеру алкільні радикали розміщені по один бік від площини подвійного зв'язку, в молекулі транс- ізомеру- по різні боки.
Цис- і транс- ізомери різняться за властивостями. Наприклад: температура кипіння цис- бутену-2 дорівнює 3,7°С, а транс-бутену-2 - +1°С.
Сполуки з подвійним зв'язком вуглець-вуглець можуть мати циклічну будову. Ці сполуки належать до циклоалкенів. Циклоалкени не є гомологами етилену.
Властивості алкенів. Етен, пропен і бутени - це безбарвні гази. Алкени нормальної будови від С5Н10 до С18Н36 - рідини, а починаючи з С19Н38 - тверді речовини. Алкени мало розчинні у воді, густина їх менша від 1г/см.
На відміну від алканів етилен і його гомологи виявляють високу реакційну здатність, що зумовлено наявністю в їхніх молекулах подвійного зв'язку. Алкени здатні вступати в реакції приєднання за рахунок розриву π-зв'язку. Крім того, π-зв'язок під дією окислювачів руйнується легше, ніж σ-зв'язок, тому для алкенів характерна участь у ролі відновників в окислювального-відновних реакціях.
1. Гідрування. Приєднуючи водень, алкени переходять у алкани:
СН2 = СН2 + Н2 → СН3 – СН3
Реації гідрування алкенів відбуваються при наявності каталізаторів (платини, паладію, нікелю).
2. Галогенування. Алкени легко приєднують галогени, особливо хлор і бром:
![]()
На цій реакції базується якісне визначення ненасичених сполук: бромна вода під час пропускання крізь неї етилену та інших алкенів знебарвлюється.
3. Гідрогалогенування. Галогеноводні також легко приєднуються до алкенів, наприклад:
![]()
Ця реакція є гетеролітичною, що відбувається з утворенням іонів в результаті гетеролітичного розриву подвійного зв’язку. Подвійний зв’язок має підвищену електронну густину, тому він легко приєднує електрофільні частинки.
Молекула
HBr
може відщеплювати іон водню
 ,
який виступає як електрофільна частинка.
Іон водню взаємодіє з молекулою етилену,
при цьому утворюється органічний катіон,
який далі реагує з бромід-іонами:
,
який виступає як електрофільна частинка.
Іон водню взаємодіє з молекулою етилену,
при цьому утворюється органічний катіон,
який далі реагує з бромід-іонами:
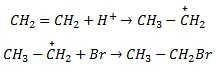
Приєднання
галогеноводнів до гомологів етилену
може відбуватися двома шляхами,
наприклад:![]()
Під час цієї реакції утворюється переважно 2-бромбпоропан. Вивчення подібних реакцій дало змогу російському хіміку В.В.Морковникову сформувати таке правило: атом водню галогеноводнів та інших несеметричних водневих сполук приєднується до найбільш гідрогенізованого атома вуглецю біля подвійного зв’язку (тобто до атома вуглецю, який сполучений з великою кількістю атомів водню).
4. Гідрація. Під час гідрації алкенів при наявності каталізаторів (сірчаної кислоти чи інших) утворюють спирти; приєднання води до гомологів етилену відбувається з правилом Морковникова, наприклад:

5.
Алкінування.
Алкени
можуть приєднувати насичені вуглеводні
з утворенням вищих алканів. Реакції
алкілування відбуваються при наявності
каталізаторів ( ).
Наприклад,
під час взаємодії етилену з пропаном
утворюються два нових алкани:
).
Наприклад,
під час взаємодії етилену з пропаном
утворюються два нових алкани:
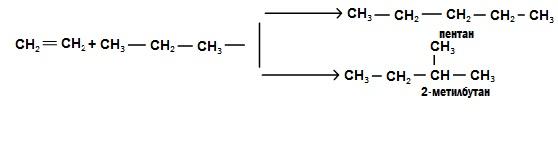
6. Полімеризація. Молекули алкенів можуть сполучатися одна з одною з утворенням макромолекули з розімкненням π- зв’яком.
7. Окислення. Алкени легко окислюються, при чому залежно від сили окмслювачів реакції можуть відбуватися з розривом тільки π- зв’язку або з повним розривом подвійного зв’язку.
Перманганат калію в нейтральному і слабко лужному середовищах окислює алкени розімкненням π-зв’язку. Цю реакцію можна зобразити схемою:
![]()
Якщо алкени пропускати крізь водний розчин перманганату калію, то відбування забарвлення розчину. Цю реакцію, як і реакцію бромування використовують для якісного визначення алкенів.
Сильні окиснювачі (перманганат калію або дихромат калію при наявності сірчаної кислоти) окислюють алкени з розривом молекули за місцем подвійного зв’язку. В результаті утворюються різні кисневмісні органічні сполуки, наприклад:

Під час високотемпературного окислення алкенів у кисні або на повітрі вони згорають:
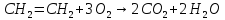
В результаті завжди утворюються оксид вуглецю (IV) і вода.
Добування алкенів. Лабораторним способом добування етилену та його гомологів є дегідратація (відщеплення води) спиртів при наявності концентрованої сірчаної кислоти чи інших водовідбірних агентів. Так, етилен можна добути з етиленового спирту при нагріванні його з сірчаною кислотою:
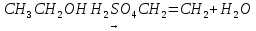
У промисловості алкени добувають з насичених вуглеводнів під час термінового розкладання (крекінгу) нафти, наприклад:

Інший промисловий спосіб добування алкенів базується на дегідруванні (відщеплення водню) алканів при наявності каталізаторів, наприклад нікелю:
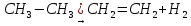
Застосування алкенів. Етилен та інші алкени є важливою сировиною для хімічної промисловості. З етилену, пропілену виробляють пластмаси – поліетилен і поліпропілен. Етилен є вихідною речовиною для промислового добування багатьох органічних речовин.
Алкілуванням алкенів добувають насичені вуглеводні, які використовують як моторне паливо.
Етилен прискорює достигання деяких плодів, для чого його вводять в атмосферу сховищ, де знаходяться недостиглі овочі та фрукти. Етилен також запобігає передчасного скиданню плодів рослинами в теплицях.
Алкіни
– вуглеводні,
в молекулах яких є два атоми вуглецю,
сполучені потрійним зв’язком -
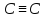 -. Алкіни називають такожацетиленовими
вуглеводнями.
-. Алкіни називають такожацетиленовими
вуглеводнями.
Ацетилен та його гомологічний ряд. Найпростішим алкіном є ацетилен, або етин:
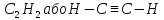 .
.
Розглянемо природу зв’язків у молекулі ацетилену згідно з електронною теорією. Під час утворення хімічних зв’язків у молекулі ацетилену гібридизації зазнають тільки дві орбіталі зовнішнього енергетичного рівня атома вуглецю: одна s- і одна p- орбіталі. Цей тип гібридизації називається sp- гібридизацією. Дві p- орбіталі вуглецевого атома залишаються в незмінному вигляді.
Потрійний
зв’язок у молекулі ацетилену складається
з одного
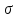 -
і двох π- зв’язків. Потрійний зв’язок
міцніший наж подвійний, а відстань між
вуглецевими атомами в ацетилені менша,
ніж в етилені.
-
і двох π- зв’язків. Потрійний зв’язок
міцніший наж подвійний, а відстань між
вуглецевими атомами в ацетилені менша,
ніж в етилені.
Ацетилен
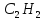 – перший член гомологічного ряду.
Формули наступних алкінів одержують
додаванням до формули ацитилену
гомологічної різниці
– перший член гомологічного ряду.
Формули наступних алкінів одержують
додаванням до формули ацитилену
гомологічної різниці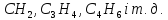
Назви алкінів за міжнародною номенклатурою утворюють з назв алканів з тим самим числом атомів вуглецю, замінюючи закінчення –ан на –ін (-ин). Приклади:
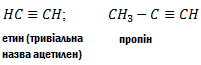
Назви алкінів з розгалуженим ланцюгом і структурних ізомерів алканів, які утворюються внаслідок різного положення потрійного зв’язку в ланцюгу і бічних замісників, будують аналогічно до назв складних алкенів; цифра в кінці назви означає найменший номер атома вуглецю ланцюга, який знаходиться біля потрійного зв’язку.
Приклади:
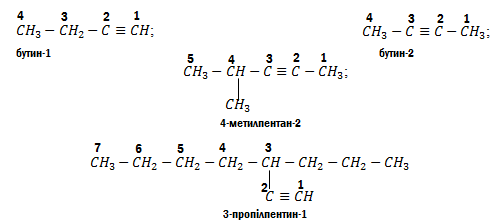
Загальна
формула гомологічного ряду алканів
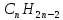 -,
де
n
= 2,3,4,5… .
-,
де
n
= 2,3,4,5… .
Властивості.
Ацетилен
–
це безбарвний газ без запаху, температура
кипіння – 83,8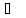 .
Розчинний у воді. Технічний ацетилен
має неприємний запах, зумовлений
наявністю домішок.
.
Розчинний у воді. Технічний ацетилен
має неприємний запах, зумовлений
наявністю домішок.
Як і алкени, ацетилен легко вступає в реакції приєднання і окислення. Крім, того для алкінів характерні реакції заміщення водню, сполученого з атомом вуглецю біля потрійного зв’язку.
1. Гідрування. Алкіни приєднують водень при наявності каталізатора з утворенням алканів або алкенів (неповне гідрування). Так, якщо як каталізатор застосовують нікель або платин, то при гідруванні ацетилену утворюється насичена сполука етан , а з каталізатором паладій або залізо – етилен.
![]()
2. Галогенування. Алкіни легко приєднують хлор і бром. Реакція відбувається в дві стадії:
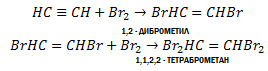
Як і етилен, ацетилен знебарвлює бромну воду. Ця реакція є якісною на ацетилен на інші алкіни.
3. Гідрогалогенування. Процес приєднання галогеноводнів до алканів відбувається легко в дві розділимі стадії. На першій стадії утворюється галогенопохідна алкену, на другій до цієї похідної приєднується друга молекула галоген оводню згідно з правилом Морковникова:
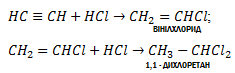
4.
Гідратація. Ацетилен
та його гомологи гідруються при наявності
каталізаторів – солей ртуті (ІІ)
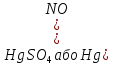 .
При
гідратації ацетилену утворюється
оцтовий альдегід:
.
При
гідратації ацетилену утворюється
оцтовий альдегід:
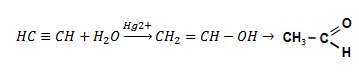
Взаємодія відбувається через стадію утворення нестійкої сполуки – вінілового спирту, який піддається ізомеризації і утворює стійку сполуку – оцтовий альдегід. Цю реакцію відкрив російський вчений М.Г.Кучеров у 1881 р. вона лежить в основі промислового добування оцтового альдегіду.
5. Окислення. Алкіни легко окислюються. Так, вони знебарвлюють розчин перманганату калію:
![]()
Цю реакцію використовують як якісну на потрійний зв’язок.
6. Реакції зміщення. Водень, сполучений з атомом вуглецю біля потрійного зв’язку, дуже рухливий, внаслідок чого для ацетилену та його гомологів характерні реакції зміщення. Наприклад, ацетилен та його гомологи, які містять потрійний зв’язок біля першого атома вуглецю, взаємодіє з аміачними розчинами гідроксидів або солей срібла і міді (І):
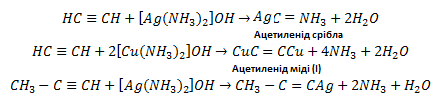
До
похідних ацетилену – ацителинідів
металів – належать карбід кальцію
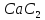 структура якого містить потрійні зв’язки
вуглець – вуглець.
структура якого містить потрійні зв’язки
вуглець – вуглець.
Добування. Для добування ацетилену в лабораторних умовах використовують реакцію карбіду кальцію з водою:
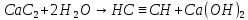
У промисловості ацетилен добувають з технічного карбіду карбіду кальцію або метану при нагріванні:
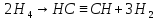
Гомологи ацетилену можна добути з дигалогенопохідних алканів, діючи на них спиртовим розчином лугу, наприклад:
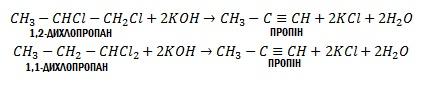
Застосування. Ацетилен є вихідною сировиною для багатьох органічних синтезів. У хімічній промисловості його застосовують для добування оцтового альдегіду і оцтової кислоти, вінілхлориду та інших речовин.
Ацетилен
використовують для автогенного зварювання
і різання металів, він згоряє в кисні,
виділяючи велику кількість теплоти
(температура полум’я досягає 3500 ).
).
Ароматичними вуглеводнями називаються сполуки, молекули яких містять стійкі циклічні структури – бензольні ядра. Термін “ароматичні сполуки” виник у початковий період розвитку органічної хімії, коли встановили, що речовини ряду бензолу виділяються з природних ароматичних речовин.
Бензол.
Бензол
є найпростішим ароматичним вуглеводнем.
Його склад відповідає формулі
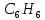 .
.
Будова молекули бензолу. Перша найбільша вдала структурна формула бензолу була запропонована в 1865 р. німецьким хіміком Кекуле. Ця формула показує рівноцінність усіх атомів вуглецю і водню, які входять молекулу бензолу, що було доведено експериментально (див. формулу 1). Використовуючи формулу 1, слід врахувати, що бензол не можна відносити до звичайних ненасичених сполук, оскільки він значно відрізняється від них за властивостями, наприклад, не приєднує бром.
Для позначення бензолу прийнято також формулу 2 і спрощено формулу Кекуле 3. Остання формула використовується при подальшому викладенні матеріалу:
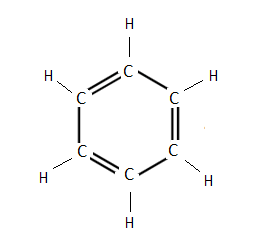
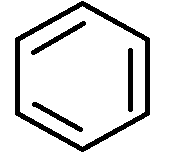
1 2 3
Згідно
з сучасними електронними уявленнями
будова молекули бензолу пояснюється
так. У цій молекулі орбіталі зовнішнього
енергетичного рівня кожного атома
вуглецю перебувають у стані
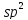 – гібридизації.
Електрони, що перебувають на гібридизованих
орбіта лях, утворюють
– гібридизації.
Електрони, що перебувають на гібридизованих
орбіта лях, утворюють
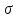 – зв’язки між сусідніми атомами вуглецю
і
– зв’язки між сусідніми атомами вуглецю
і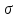 – зв’язки вуглець – вуглець.
– зв’язки вуглець – вуглець.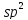 –
Гібридизовані орбіталі розміщуються
під кутом
–
Гібридизовані орбіталі розміщуються
під кутом
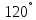 одна до одної, тому в молекулі бензолу
атоми вуглецю розміщуються в кутах
правильного шестикутника.
одна до одної, тому в молекулі бензолу
атоми вуглецю розміщуються в кутах
правильного шестикутника.
Р-Орбіталі шести атомів вуглецю в бензолі, які не беруть участь в гібридизації, розміщуються перпендикулярно до площини бензольного кільця і перекриваються одна з одною зверху і знизу цієї площини. Електрони, що перебувають на них орбіталях, утворюють єдину стійку π-електронну систему. Так виникає хімічний зв’язок, який об’єднує всі шість атомів вуглецю в молекулі бензолу.
Молекула
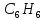 плоска, всі атоми вуглецю розміщені на
однакових віддалях один від одного,
утворюючі правильний шестикутник.
плоска, всі атоми вуглецю розміщені на
однакових віддалях один від одного,
утворюючі правильний шестикутник.
Властивості.
Бензол
– це
безбарвна рідина, що має характерний
запах. Легко переходить у твердий стан:
температура плавлення бензолу становить
+5,5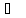 ,
температура кипіння +80,1
,
температура кипіння +80,1 .
У воді бензол практично не розчиняється
але є хорошим розчинником багатьох
органічних речовин.
.
У воді бензол практично не розчиняється
але є хорошим розчинником багатьох
органічних речовин.
Хімічні
властивості бензолу та інших ароматичних
сполук характеризується рядом
особливостей. Для бензолу характерні
реакції заміщення атомів водню в
бензольному кільці. Ці рекції відбуваються
за механізмом електрофільного
заміщеня.
Електрофільна частинка
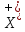 взаємодіє з π – електронами молекули
бензолу, утворюючи π-комплекс, який
переходить у
взаємодіє з π – електронами молекули
бензолу, утворюючи π-комплекс, який
переходить у
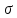 – комплекс. В
– комплекс. В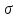 – комплексі частинка
– комплексі частинка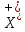 сполучена з одним з атомів вуглецю, в
результаті ароматичний характер молекули
порушується. Далі від
сполучена з одним з атомів вуглецю, в
результаті ароматичний характер молекули
порушується. Далі від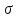 – комплексу відщеплюється протон і
відновлюється ароматичний характер
ядра. Механізм цієї реакції можна
проілюструвати такою схемою:
– комплексу відщеплюється протон і
відновлюється ароматичний характер
ядра. Механізм цієї реакції можна
проілюструвати такою схемою:

На відміну від ненасичених сполук типу алкенів і алкінів, бензол дуже стійкий проти окислення, важко вступає в реакції приєднання. Розглянемо найбільш характерні для ароматичних вуглеводів реакції.
1.
Нітрування. При
дії на бензол нітруючої суміші (суміш
концентрованих азотної і сірчаної
кислот) відбувається заміщення водню
в ядрі бензолу на групу
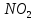 ;
цей процес називаєтьсянітруванням:
;
цей процес називаєтьсянітруванням:
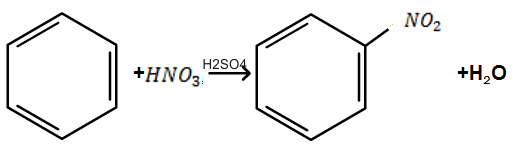
Реакція
відбувається за механізмом електрофільного
заміщення. Роль електрофільної частинки
відіграє іон
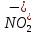 ,
який утворюється в результаті реакції:
,
який утворюється в результаті реакції:
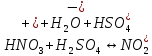
2.
Сульфування. Водень
в бензольному ядрі може бути заміщений
на сульфогрупу
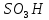 під дією концентрованої сірчаної
кислоти; цей процес називаєтьсясульфування:
під дією концентрованої сірчаної
кислоти; цей процес називаєтьсясульфування:
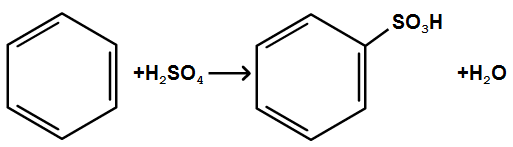
3.
Алкілування. В
молекулу бензолу замість водню можна
ввести алкільний радикал. Процес
алкілування можна здійснити дією на
бензол галогенопохідної алкану чи
олефіну при наявності каталізатора
(хлорид алюмінію
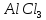 ):
):
4.
Галогенування.
Заміщення
водню в бензольному ядрі на хлор чи бром
здійснюється при взаємодії бензолу з
галогенами за участю каталізатора.
Реакцію можуть каталізувати
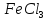 (або
(або
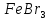 )
I
)
I
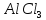 ,при
цьому утворюються різні продукти:
,при
цьому утворюються різні продукти:
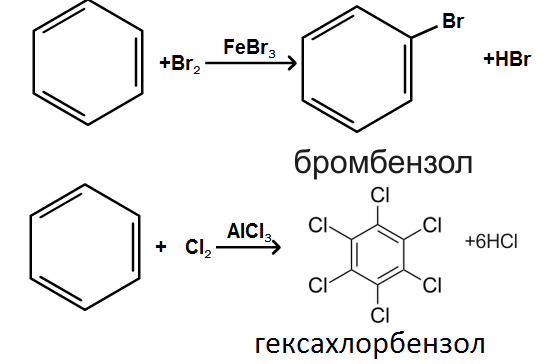
Під час інтенсивного опромінення реакційної системи світлом бензол може приєднувати хлор:
На відміну від наведених вище реакцій галогенування, в який атом хлору чи брому заміщує водень в бензольному ядрі, в цій реакції атоми хлору приєднуються до всіх атомів вуглецю. В результаті руйнується π-електронна система бензолу і утворюється галогенопохідна алкану циклоалкану.
5. Гідрування. Одна з небагатьох реакцій приєднання, в яку може вступати бензол, - реакція гідрування при наявності платинових або нікелевих каталізаторів:
С6Н6
+ 3Н2 C6H12
C6H12
Добування. Бензол виділяють переважно з нафти та кам’яного вугілля при виробництві коксу.
Бензол
можна добути з циклогексану за реакцією
дегідрування з участю платини як
каталізатора або шляхом циклізації і
дегідрування нормального гексану при
наявності
 :
:
C6H12 C6H6
+ H2
C6H6
+ H2
CH3
– (CH2)
– CH3 C6H6
+ 4H2
C6H6
+ 4H2
Бензол утворюється також під час пропускання ацетилену над розжареним активним вугіллям:
3CH =CH→C6H6
Застосування. Бензол є важливою сировиною для органічного синтезу, його використовують при добуванні багатьох інших ароматичних сполук. Бензол застосовують в виробництві барвників, пластмас, пестицидів, вибухових речовин, ліків; його використовують як розчинник лаків, фарб.
Бензол входить до складу палива, яке використовується в двигунах внутрішнього згорання.
Гомологи
бензолу – це
ароматичні вуглеводні, в бензольному
кільці яких один чи кілька атомів водню
заміщені на алкільні радикали.
Загальна формула
сполук гомологічного ряду бензолу
 ,
де
n
= 6, 7, 8, 9… .
,
де
n
= 6, 7, 8, 9… .
Найпростішим
гомологом
бензолу, який відрізняється від нього
на одну групу
 ,
є метилбензол, аботолуон
,
є метилбензол, аботолуон
 .
.
Ізомерія
та номенклатура. Наступний
за толуолом гомолог бензолу має склад
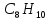 ,
якому відповідають чотири сполуки:
,
якому відповідають чотири сполуки:
C6H5 - C2H5 C6H4(CH3)2
Етилбензол 1,2 - диметилбензол
Як видно з наведених формул, гомологи бензолу, що мають у ядрі два однакових замісника, розрізняються розміщенням цих замісників один відносно одного, тобто є ізомерами.
Назви гомологів бензолу складаються з назви замісника з додаванням кореня бензол, наприклад етилбензол. Якщо гомолог містить кілька замісників, то їхнє положення позначають цифрами, що означають номери атомів вуглецю в бензольному ядрі, біля яких знаходяться ці замісники, наприклад 1,2-диметилбензол. Нумерацію починають з одного з атомів вуглецю, біля якого є замісник.
Для багатьох гомологів широко використовують тривіальні назви (толуол, ксилол).
Для позначення ізомерів з двома однаковими замісниками використовують префікси: орто-, мета-, пара-. В орто-ізомері замісники мають положення 1,2 в мета-ізомері – положення 1,3 і в пара-ізомері – положення 1,4.
Ароматичні вуглеводні утворюють радикали, які є складовими частинами складніших сполук, наприклад:
С6H5 C6H5 – CH2
Феніл бензіл
Загальна назва радикалів ароматичних вуглеводнів – арил.
Властивості. Найпростіші гомологи бензолу за звичайних умов – це рідини з характерним запахом, вищі гомологи – тверді речовини.
Для гомологів характерні ті самі реакції, що і для самого бензолу.
1. Нітрування, сульфування та алкілування. Ці реакції відбуваються як і для бензолу, за механізмом електрофільного заміщення.
Особливості перебігу цих реакцій для гомологів бензолу виявляється в тому, що замісник, який є в ядрі, впливає на положення другого замісника.
Звичайно при зміщені водню в ядрі гомологів бензолу утворюється суміш орто-, мета-, і пара-замісників, у якій переважають орто- і пара-сполуки. Наприклад, при нітруванні толуолу реакція йде таким шляхом:
С6H5
– CH3
+ HNO3
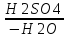 →C6H4
– CH3
– NO2
→C6H4
– CH3
– NO2
2. Галогенування. Підчас галогенування гомологів бензолу з участю каталізаторів утворюються продукти заміщення водню в бензольному ядрі.
Якщо хлорування здійснюють на світлі, то можуть заміщуватися на хлор атоми водню в бічному ланцюгу, наприклад:
C6H5 – CH3 + Cl2→C6H5CH2Cl + HCl
Можливе
також утворення сполук
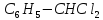 і
і
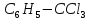 .
.
3. Окислення. Толуол, етилбензол, ксилоли та інші гомологи бензолу окислюються легше, ніж сам бензол. Окислення зазнають бічні замісники, наприклад:
C6H5CH3 + 3[O]→C6H5COOH + H2O
C6H5 – C 2H5 + 6[O]→C6H5COOH + CO2 + 2H2O
Добування. У промислових масштабах гомологи бензолу виділяють переважно з нафти та кам’яного вугілля.
Ці сполуки можна добути синтетичним шляхом, наприклад за реакцією алкілування бензолу:
C6H6
+ CH3Cl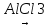 C6H5
– CH3
+ HCl
C6H5
– CH3
+ HCl
Алкіл бензоли можна добути під час циклізації алканів:
CH3-(CH2)5-CH3→ C6H5 – CH3 + 4H2
гептан
Застосування. Гомологи бензолу використовують у промисловому органічному синтезі. Толуол, наприклад, застосовують для синтезу бензойної кислоти. З пара-кислоти добувають терефталеву кислоту, яка використовується в виробництві хімічних волокон. Багато гомологів бензолу застосовують як розчинник органічних речовин та полімерів.
