
Лекція № 10
Тема: Одноосновні карбонові кислоти, вищі карбонові кислоти, мила, складні ефіри, жири.
Мета: Вивчити класифікацію карбонових кислот, їх властивості, добування застосування. Навчитися складати структурні формули ізомерів кислот, та називати їх по замістниковій номенклатурі. Навчитися складати структурні формули складних ефірів. Вивчити властивості складних ефірів. їх добування та застосування. Вивчити властивості жирів.
План.
1. Номенклатура та ізомерія насичених одноосновних кислот.
2. Властивості і добування насичених одноосновних кислот.
3. Ненасиченіодноосновнікарбонові кислоти.
4. Ароматичні кислоти. Двохосновні карбонові кислоти.
5. Мила.
Складні ефіри, їх характеристика.
Основні представники складних ефірів.
Властивості складних ефірів та їх добування.
Жири.
Література.
Хомченко І.Г., Загальна хімія., К.: Виша школа, 1993. С.358-379,381
Карбоновим кислотами - називаються органічні речовини, до складу яких входять карбоксильна трупа -СООН. Карбоксильна група складається із сполучених карбонільної і гідроксильної груп, що визначило її назву.
У карбоновим кислотах карбоксильна група сполучена з вуглеводневим радикалом К, тому в загальному вигляді формулу карбонової кислоти можна записати гак: R—СООН.
У карбонових кислотах карбоксильна група може сполучатися з різними вуглеводневими радикалами — насиченими, ненасиченими, ароматичними. У зв'язку з цим виділяють насичені, ненасичені та ароматичні карбонові кислоти, наприклад:
C2H5-COOH;
CH2=CH-COOH,
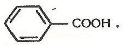
Насичена кислота Ненасичена кислота Ароматична кислота
Залежно від числа карбоксильних груп, що містяться в молекулах карбонових кислот, розрізняють одноосновні та двохосновні кислоти, наприклад:
СH3-COOH;
HOOC-COOH;
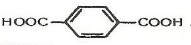
Одноосновна кислота Двохосновні кислоти
Одноосновні кислоти називають також монокарбоновіти, а двохосновні — дикарбоновими кислотами.
Гомологічний ряд насичених одноосновних кислот
Загальна формула членів гомологічного ряду насичених одноосновних карбонових кислот CnH2n+1COOH, де n= 0, 1,2, 3....
Номенклатура. Назви карбонових кислот за замісниковою номенклатурою будують з назви відповідного алкану з додаванням закінчення -ова і слова «кислота». Якщо вуглецевий ланцюг розгалужений, то па початку назви кислоти записують замісник, зазначаючи його положення в ланцюгу. Нумерацію атомів вуглецю в ланцюгу починають з вуглецю карбоксильної групи. Приклади:
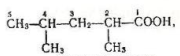
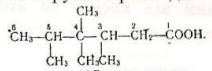
2 4 Диметрилпентанова 3 4 4 5 Тетраметилгексанова
(2 4 диметилвалеріанова (3 4 4 5 тетраметилкапронова
кислота) кислота) Для деяких членів гомологічного ряду насичених карбонових кислот застосовують тривіальні назви. В табл. 26.1 наведено формули деяких насичених одноосновних кислот і їх назви за замісниковою номенклатурою та тривіальні назви.
Таблиця 26.1 Деякі насичені одноосновні кислоти
|
Формула |
Назва | |
|
за замісниковою номенклатурою |
тривіальна | |
|
НСOOH |
Метанова |
Мурашина |
|
СН3СООН |
Етанова |
Оцтова |
|
С2Н5СООН |
Пропанова |
Пропюнова |
|
С3Н7СООН |
Бутанова |
Масляна |
|
С4Н9СООН |
Пектанова |
Валеріанова |
|
С5Н11СООН |
Гексанова |
Капронова |
|
С6Н13СООН |
Гегтганова |
Енантова |
|
С15Н31СООН |
Пентадеканова |
Пальмітинова |
|
С16Н33СООН |
Гексадєканова |
Маргаринова |
|
С17Н35СООН |
Гептадеканова |
Стеаринова |
Iзомери. Починаючи з бутанової кислоти С3Н7СООН, члени гомологічного ряду насичених одноосновних кислот мають ізомери, їх ізомерія зумовлена розгалуженістю вуглецевого ланцюга вуглеводневих радикалів. Так, бутанова кислота має такі два ізомери (у дужках дано тривіальну назву):
![]()
![]()
Бутанова(масляна)кислота 2-Метилпропанова(ізомасляна)кислота
Властивості насичених одноосновиих кислот. Кислоти гомологічного ряду з нормальною будовою від мурашинної до С8НІ7СООН за звичайних умов – безбарвні рідини, що мають різкий запах. Вищі члени ряду, починаючи з С9Н19СООН,- тверді речовини. Мурашина, оптова і проліонова кислоти добре розчиняються в воді в будь-яких співвідношеннях. Інші рідкі кислоти обмежено розчиняються у воді. Тверді кислоти у воді практично нерозчинні.
Особливості хімічних властивостей карбонових кислот зумовлені сильними взаємним впливом карбонільної С=0 і гідроксильної ОН-груп. У карбоксильній групі зв'язок між вуглецем й карбонільним киснем сильнополярний. Проте позитивний заряд на атомі вуглецю частково зменшується внаслідок притягання електронів атома кисню гідроксильної групи. Тому в карбонових кислотах карбонільний вуглець менш схильний до взаємодії з нуклеофільними частинками, ніж в альдегідах і кетонах. З іншого боку, під впливом карбонільної групи підсилюється полярність зв'язку О-Н за рахунок зміщення електронної густини від кисню до атома вуглецю. Всі зазначені особливості карбоксильної групи можна проілюструвати такою схемою:
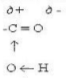
Розглянутий характер електронної будови карбоксильної групи зумовлює відносну легкість відщеплення атома водню цієї групи. Тому у карбонових кислот добре виявленні кислотні властивості. У безводному стані і особливо у водних розчинах карбонові кислоти дисоціюють на іони:
СН3 - СН2 - СООН ↔ СН3 - СН2 – СOO- + H+.
Кислотний характер розчинів карбонових кислот можна встановити за допомогою індикаторів. Карбонові кислоти є слабкими електролітами, причому сила карбонових кислот зменшується зі збільшенням молекулярної маси кислоти.
Для насичених одноосновних кислот найбільш характерні реакції, зумовлені кислотними властивостями, а також реакції заміщення гидроксильної групи.
1. Взаємодія з металами. Карбонові кислоти реагують з деякими металами з утворенням солей і водню, наприклад: 2СH3СООН + Мg → Мg(СНзСОО)2 + Н2
2.Взаємодія з основними оксидами і основами. Як усі кислоти, карбоксильні сполуки реагують з основними оксидами і основами, наприклад:
2С2Н5СООН + МgО → Мg(С2Н5СОО)2 + Н20;
С2Н,СООН + КОН → С2Н5СООК + Н20 з водним розчином аміаку, який виявляє властивості основ, карбонові кислоти також утворюють солі: С2Н5СООН + КН3→ С2Н5СООNH4,.
3.Взаємодія зі спиртами. Карбонові кислоти реагують зі спиртами при наявності сильних неорганічних кислот. Від молекули кислоти відщеплюється група ОН, від молекули спирту - атом Н, в результаті утворюються складні ефіри:
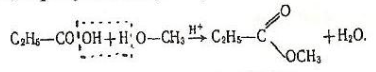
Метилпропіонат
4.Взаємодія з галогенідами фосфору і сірки. Галогеніди фосфору (РBr3, РСІ3) і сірки (SОС12) взаємодіють з карбоновими кислотами, утворюючи хлорангідриди кислот, наприклад:
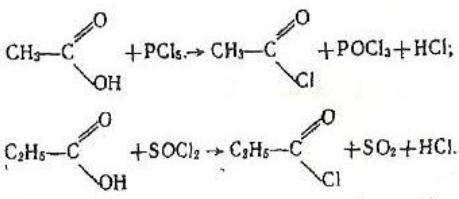
5.Взаємодія з водовідбірними агентами. Під дією сильних водовідбірних речовин, наприклад Р203 на карбонові кислоти утворюються ангідриди кислот:
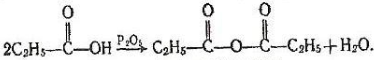
Пропіоновий антідрид
6.Взаємодія з галогенами. Як і в альдегідах, хлор і бром можуть заміщувати атом водню біля другого вуглецевого атома з утворенням галогенозаміщених кислот, наприклад:
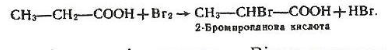
7.Відновлення і каталітичне гідрування. Відновлюючи карбонові кислоти, можна добути альдегіди і первинні спирти, наприклад:
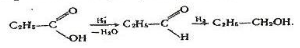
Відновлення кислот відбувається дуже важко.
Добування насиченнх одноосновних кислот. Основні методи добування карбонових кислот такі.
1.Окислення первинних спиртів і альдегідів. Спирти і альдегіди окислюються досить легко, наприклад:
O
║
С2H5-C+[O]→C2H5COOH
│
H
Під час окислення кетонів, вторинних і третинних спиртів у жорстких умовах (сильні окислювачі, нагрівання) відбувається розщеплення вуглецевого ланцюга молекул і утворюється, як правило, суміш карбонових кислот. Наприклад, окислюючи ацетон, можна добути суміш мурашиної і оцтової кислот.
2.Окислення алканів. Суміш нижчих алканів (бутан-октан) окислюється при наявності каталізаторів переважно до оцтової кислоти. Алкани, що містять 9-20 вуглецевих атомів, окислюються до вищих кислот.
3.Гідроліз нітрилів. Нітрили - сполуки типу R— С=N. Під час нагрівання нітрилів з водою, в яку добавлено неорганічні кислоти, утворюються карбонові кислоти, наприклад:
![]()
Ацетонiтрил
4.Карбонілування алкенів. Кислоти, починаючи з пропіонової. можна добути приєднанням оксиду вуглецю (II) і води до алкенів. Каталізатором реакції є фосфорна кислота, процес відбувається при температурі 300-350°С і тиску 20-30 МПа. Наприклад:
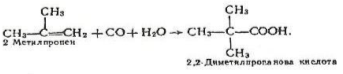
2 Метилпропен 2,2 – Диметилпропанова кислота
Ненасичені одноосновні кислоти
У ненасичених карбонових кислотах карбоксильна група сполучена з ненасиченим вуглеводневим радикалом. Назви ненасичених кислот, у яких вуглеводневий радикал містить подвійний зв'язок, за замісниковою номенклатурою складаються з назви відповідного алкену із зазначенням цифрою положення подвійного зв'язку у вуглецевому ланцюгу, закінчення -ова і слова «кислота». Для деяких кислот застосовують тривіальні назви. Нижче наведені приклади ненасичених одноосновних кислот (у дужках подано тривіальну назву):
![]()
![]()
Пропенова Бутен-2-ова
(акрилова) (кротонова)
кислота кислота
![]()
![]()
Бутен-3-ова Метилпропенова
(вiнiлоцтова) (метакрилова)
кислота кислота
З наведених формул видно, шо ізомерія ненасичених кислот зумовлена розгалуженістю вуглецевого ланцюга і положенням подвійного зв'язку.
Важливим представником ненасичених карбонових кислот є олеїнова кислота С17H33СООН. Ця кислога має нормальну будову вуглецевого ланцюга, в середині якого розташований подвійний зв'язок:
СH3-(CH2)7-CH═CH-(CH2)7-COOH.
Властивості. За звичайних умов акрилова і метакрилова кислоти – безбарвні рідини, кротонова кислота - тверда речовина, олеїнова кислота - оліїста рідина. Характерні хімічні властивості ненасичених кислот зумовлені наявністю в їх молекулах карбоксильної групи і подвійного зв'язку. Ненасичені кислоти сильніші, ніж насичені з таким самим числом вуглецевих атомів. Так, акрилова кислота сильніша від пропіонової.
1.Типові реакції карбонових кислот. Як і насичені кислоти, ненасичені карбонові кислоти реагують з лугами з утворенням солей і зі спиртами з утворенням складних ефірів, наприклад:
![]()
2.Реакції приєднання за подвійним зв'язком. Ненасичені карбонові кислоти легко приєднують галогени, наприклад:
![]()
2,3 Дихлорпропiолова
кислота
Вони можуть також приєднувати воду і галогеноводні. Якщо в молекулі ненасиченої кислоти подвійний зв'язок розташований біля другого вуглецевого атома, то вона приєднує воду і галогеноводні проти правила Марковникова, наприклад:
![]()
3-Бромпропiонова кислота
З участю каталізаторів ненасичені кислоти гідролізуються воднем. Наприклад, гідруванням олеїнової кислоти добувають насичену стеаринову кислоту:
![]()
3.Окислення. На відміну від насичених кислот ненасичені кислоти легко окислюються, шо зумовлено наявністю в них подвійних зв'язків. Під час окислення ненасичених кислот перманганатом калію в лужному середовищі можна добути дигідроксикислоти, наприклад:
![]()
2,3-Дигiдроксипропiонова кислота
Під дією сильніших окислювачів відбувається розрив молекул за подвійним зв'язком і утворюється суміш різних карбонових кислот.
Добування. Важливий промисловий метод добування ненасичених кислот полягає в каталітичному окисленні алкенів з проміжним добуванням ненасичених альдегідів. Сумарне рівняння однієї з таких реакцій:
![]()
Iзобутилен Метакрилова кислота
Каталітичному окисленню можна піддавати безпосередньо альдегіди, наприклад:
![]()
Акролеїн Акрилова кислота
Ненасичені кислоти утворюються також під час дегідрохлорування (відщеплення молекул НС1) хлорпохідних насичених карбонових кислот при наявності лугів, на- приклад:
![]()
Багато ненасичених кислот, наприклад олеїнову кислоту, можна виділити з природних жирів.
Застосування. Акрилова i метакрилова кислоти є вихідною сировиною для добуваняя різних полімерних матеріалів: органічного скла, каучуків, іонообмінних смол. Олеїнову кислоту використовують у виробництві технічних масел, барвників, реагентів для флотації, косметичних засобів.
Ароматичні кислоти. До ароматичних кислот належать карбонові кислоти, молекули яких містять бензольні кільця. Найпростішою ароматичною карбоновою кислотою є бензойна кислота С6Н5—СООН. Це безбарвна кристалічна речовина, малорозчинна у воді. Бензойну кислоту добувають переважно окисленням толуолу перманганатом калію, дихроматом калію або киснем:
![]()
її можна також добути гідролізом трихлорпохідної толуолу:
![]()
Похідною бензойної кислоти є орто-гідроксибензойна або саліцилова, кислота
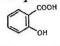
Саліцилову кислоту добувають дією оксиду вуглецю (IV) на фенолят натрію при підвищеному тиску:
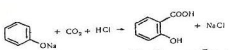
Бензойну кислоту використовують як засіб боротьби зі шкідниками рослин у сільському господарстві, як антисептичний засіб, у виробництві барвників та ліків. Деякі похідні саліцилової кислоти є ефективними лікарськими препаратами, наприклад аспірин - жарознижувальний засіб, салол - шлунковий.
Двохосновні карбонові кислоти
Насичені двохосновні кислоти. Молекули двохосновних карбонових кислот містять дві карбоксильні групи. Найпростіша двохосновна кислота – щавелева – це сполучення двох карбоксильних груп:
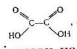 ,
або НООС-СООН
,
або НООС-СООН
За міжнародною номенклатурою назви насичених двохосновних кислот будують з назви відповідного алкану з додаванням закінчення – діова. Найбільш застосовні для цих кислот тривіальні назви. В табл. наведені деякі найбільш поширені насичені двохосновні кислоти.
|
НООС-СООН Етандінова Щавелева |
|
НООС-СН 2 –СООН Пропандінова Малонова |
|
НООС-СН 2 –СН 2- СООН Бутандіова Янтарна |
|
НООС-(СН 2) 3 –СООН Пентандіова Глутарова |
|
НООС-(СН 2)4 – СООН Гександіова Адипінова |
Щавелева кислота - це безбарвна кристалічна речовина, розчинна у воді. Виділяється з водних розчинів у вигляді кристалогідрату Н2С2О4 • 2Н20.
Найважливіший метод добування щавелевої кислоти заснований на нагріванні до 400°С - форміату натрію (сіль мурашиної кислоти). В результаті цього процессу утворюється натрієва сіль щавелевої кислоти - оксалат натрію:
![]()
Дією неорганічних кислот на оксалат натрію добувають щавелеву кислоту. Щавелева кислота утворюється також під час окислення багатьох органічних речовин: етилену, етиленгліколю, сахарів, деревини. У водному розчині шавелева кислота дисоціює на іони, причому як двохосновна кислота ступінчасто:
Iступінь НООС-СООН = Н++НООС-СОО-
IIступінь НООС-СОО- -= Н++-ООС-СОО2-
Щавелева кислота - одна з найсильніших карбонових кислот, її дисоціація відбувається переважно за першим ступенем. Щавелева кислота виявляє багато хімічних властивостей, характерних для карбонових кислот. При цьому в реакцію можуть вступати як одна, так і дві карбоксильні іруни, наприклад:
![]()
Щавелева кислота виявляє і особливі властивості. Так, вона легко окислюється перманганатом в кислому середовищі;
![]()
Під час нагрівання щавелева кислота розкладається:
![]()
Солі щавелевої кислоти – оксалати, наприклад К2С2О4 – оксалат калію. Оксалати трапляються в природі. Щавелеву кислоту застосовують для очистки металів від продуктів корозії, накипу та інших забруднень. Її використовують також як протраву при вичинці шкіри.
Милами називаються солі високомолекулярних карбонових кислот, розчини яких мають миючі властивості. Для добування мила жир або суміш жирних кислот, у тому числі добутих синтетичним шляхом, оброблюють при кип’ятінні розчином їдкого натра (варка мила). При цьому відбувається гідроліз гліцеридів та нейтралізація утворених жирних кислот. Добутий продукт отримав назву мильного клею. Після його охолодження та розділки добувають клеєне мило. Для добування ядрового мила до мильного клею додають концентрований розчин повареної солі (висолювання); утворюються два шари, верхній шар - ядро, після відділення, промивки та охолодження є високоякісним милом. Властивості мил залежать від складу жирних кислот, солі ненасичених кислот мають більшу розчинність, чим насичені. Рідкі мила - це калієві солі вищих жирних карбонових кислот, а тверді мила- це натрієві солі вищих жирних карбонових кислот.
Складні ефіри- це речовини, які мають загальну формулу R - О - R', де R і R'-
вуглеводневі радикали. Складні ефіри утворюються під час взаємодії карбонових кислот зі спиртами, наприклад:
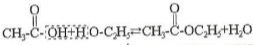
При відщепленні молекули води від молекули кислоти відщеплюється гідроксильна група, а атом водню - від спирту. Отже, складні ефіри - це похідні кислот, у яких гідроксильна група замінена на групу - О R' спирту.
За сучасною міжнародною номенклатурою назву ефіру будують з назви вуглеводного радикалу, що відповідає спирту, і кореня латинської назви кислоти з додаванням закінчення -ат. Застосовують також назви, які складаються з назв спирту і кислоти, шо утворюють ефір. Приклади:
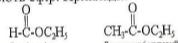
Етилформіат Етилацетат(етиловий
(етиловий ефір ефір оцтової кислоти)
Мурашиної кислоти)
Реакція добування складного ефіру з кислоти і спирту називається етерифікацією. Ця реакція оборотна. Для зміщення рівноваги в бік утворення складного ефіру необхідна наявність сильних неорганічних кислот. Розглянемо коротко механізм реакції етерифікації. Спочатку іони водню (від неорганічної кислоти) взаємодіють з карбонільним киснем кислоти з утворенням карбокатіона, який потім реагує з молекулою спирту:
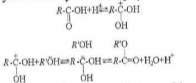
Для добування складних ефірів крім реакції етерифікації можна використати реакції ангідридів і хлорангідридів кислот зі спиртами, наприклад:
![]()
Етилформіат
![]()
Метилпропіонат
Ненасичені та ароматичні кислоти також утворюють сладні ефіри, наприклад:
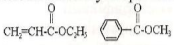
Етилакрилат(етиловий ефір Метилбензоат(метиловий
Акрилової кислоти) ефір бензойної кислоти)
Двохосновні карбонові кислоти можуть утворювати моно- та діефіри; наприклад, терефталева кислота має такі складні ефіри:
НООС
![]() СО-ОСН3
СНзО-СО
СО-ОСН3
СНзО-СО
![]() СО-ОСН3
СО-ОСН3
Метилтерефталат Диметилтерефталат
Сладні ефіри можна добути і для неорганічних кислот. Так, сірчана кислота з метанолом дає два складних ефіри:

Метилсульфат Диметилсульфат
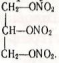
Сладним ефіром азотної кислоти і гліцерину є тринітрогліцерин
Складні ефіри найпростіших кислот і спиртів - рідини, більшість з яких має приємний запах, наприклад, для ізо- пентилацетату характерний запах груші, бутилфенілацетату - запах меду. Багато складних ефірів міститься у квітах, ягодах, фруктах, надаючи їм характерного аромату.
Складні ефіри є хорошими розчинниками багатьох органічних речовин, у тому числі полімерів.
Найбільш характерною хімічною реакцією складних ефірів є розкладання їх водою (гідроліз):
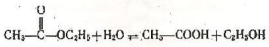
Ця реакція (зворотна етерифікації) називається реакцією омилення. Практично необоротна реакція омилення складних ефірів відбувавається при наявності лугів. Складні ефіри застосовують у харчовій промисловості для приготування фруктових вод і есенцій, кондитерських виробів, а також парфюмерних виробів.
Етилацетат (етиловий ефір оцтової кислоти) СН3СООС2Н5 - це безбарвна рідина з характерним запахом. Кипить при температурі 77,2°С. Незначною мірою розчиняється у воді. У промисловості етилацетат добувають за реакцією етерифікації між етанолом і оцтовою кислотою. Етилацетат застосовують переважно як розчинник органічних речовин, у тому числі полімерів. Він входить до складу харчових фруктових есенцій і парфюмерних виробів (мила).
Діетилмалонат (малоновий ефір) С2Н5ОСО-СН2-СООС2Н5 - ефір двохосновної малонової кислоти. Це рідина з приємним фруктовим запахом. У малоновому ефірі атоми водню середньої групи -СН2- дуже рухливі: вони можуть бути заміщені на метал (натрій):
2С2Н5ОСО-СН2-СООС2Н5+2Na2→(С2Н5ОСО-СН-СООС2Н5)Na++Н2.
Його добувають за реакцією етерифікації між малоновою кислотою і етанолом. Малоновий ефір використовують в органічному синтезі.
Метилметакрилат (метиловий ефір метакрилової кислоти) СН2=С(СН3)-СООСН3 добувають етерифікацією метакрилої кислоти з метанолом. Завдяки наявності подвійного зв'язку цей ефір може полімеризуватися з утворенням поліметилметакрилату:
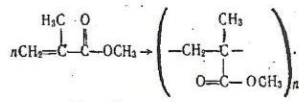
Поліметилметакрилат - прозора безбарвна скловидна речовина. Має високу міцність, добре обробляється. Прозорі листи поліметилметакрилату називають органічним склом. Воно переважає за міцністю звичайне скло і застосовується як замінник скла в різних галузях техніки.
Практичне застосування знаходять співполімери метилметакрилату з іншими органічними речовинами. Поліметилметакрилат та полімери інших ефірів метакрилової кислоти (етилового, «-бутилового) входять до складу лаків і клеїв.
Диметилтерефталат (диметиловий ефір терефталевої кислоти) СН3ОСО-С6Н4СООСН3 добувають етерифікацією терафталевої кислоти метанолом. Це безбарвна кристалічна речовина.
Диметилтерефталат є вихідним реагентом для добування технічно важливого полімеру - поліетилентерефталату. Виробництво цього полімеру складається з двох основних стадій. Ефір нагрівають з етиленгліколем, потім утворений етиленгліколевий ефір терефталевої кислоти піддають поліконденсації:
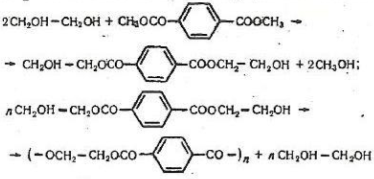
З поліетилентерефталату виробляють штучне волокно лавсан. Лавсан має високу міцність, стійкість проти стирання та дії хімічних речовин. З нього виробляють міцні технічні тканини. В текстильній промисловості використовують суміш лавсаного волокна з вовною.
Ліпіди - це речовини, що входять до складу тваринних і рослинних тканин і є похідними вищих карбоновних кислот, спиртів та інших сполук. Ліпіди діляться на дві великі групи: прості і складні ліпіди. Прості ліпіди не містять азоту, фосфору і сірки. До них у першу чергу відносяться нейтральні ліпіди, які є похідними вищих жирних кислот і одно- чи багатоатомних спиртів. У склад складних ліпідів входять фосфоліпіди, сульфоліпіди, сфінголіпіди.
Жири є різновидом класу природних органічних сполук, які називаються ліпідами. За хімічною будовою жири - складні ефіри гліцеріну і вищих карбонових кислот їх називають також тригліцеридами.
Число вуглецевих атомів у кислотах, шо входять до сладу жирів, як правило, більше восьми (іноді менше). Приклади жирів:
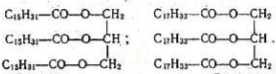
Тригліцерид Тригліцерид
Гальцимітинової кислоти алеїнової кислоти
Тригліцериди насичених кислот за звичайних умов є твердими речовинами, Важливою хімічною властивістю жирів є їх здатність гідролізуватися, тобто всупати в реакцію омилення. Наприклад, під час омилення змішанного гліцериду, шо містить залишки пальмітинової (С15Н31СООН) і стеаринової (С17Н35СООН) кислот, виділяються гліцерин і ці кислоти:
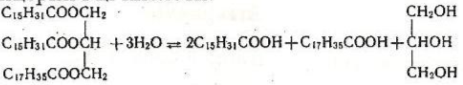
Омилення жирів відбувається необоротно при наявності лугів, при цьому утворюються гліцерин і сіль кислоти. Жири широко поширені в природі, вони є складовою частиною рослинних і тваринних організмів. Тригліцериди можна добути за реакцією етерифікації, проте в промисловості їх виділяють переважно з природних речовин. У тваринних жирах переважають тригліцериди насичених кислот, тому ці жири за звичайних умов є твердими речовинами (наприклад, вершкове масло, сало). У рослинних жирах переважають тригліцериди ненасичених кислот, ці жири є рідинами (соняшникова олія, маслинова олія). Такі жири називаються оліями. У промисловості рідкі рослинні олії часто переробляють на тверді жири, які за властивостями нагадують тваринні. Для цього рослинні олії піддають каталітичному гідруванню, наприклад:
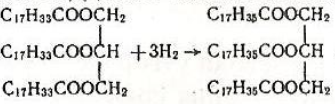
З гідрованих рослинних жирів виробляють важливий харчовий продукт - маргарин, який за хімічним складом аналогічний тваринним жирам. Жири є важливою складовою частиною продуктів харчування людини і тварин. У процесі травлення відбувається гідроліз жирів, продукти гідролізу всмоктуються тканинами кишок. В ораганізмі продукти гідролізу жирів знов утворюють потрібні жири. Жири в організмі людини і тварин постійно замінюються новими в процесі обміну речовин. Відпрацьовані жири поступово окислюються до вуглекислого газу і води.
Жири мають широке застосування в промисловості. Вони є вихідними речовинами для добування мила і гліцерину, використовуються для приготування мастил, косметичних засобів, розчинників олійних фарб - оліф. Крім жирів до ліпідів належать воски - складні ефіри вищих карбонових кислот і виших спиртів. Наприклад, воском є ефір метилового спирту (С15Н31СН2ОН) і пальмітинової кислоти С15Н31СООС15Н31. Цей воск входить до складу бджолиного воску і речовини спермацету, що міститься в голові кита.
