
- •Лабораторний практикум
- •Фізична хімія
- •Передмова
- •Оформлення результатів вимірювань
- •Складання таблиць
- •Молярна електрична провідність водних розчинів
- •Побудова графіків
- •Розділ і термохімія
- •Лабораторна робота №1 визначення теплової сталої калориметра
- •Запис вимірювання температури під час досліду
- •Лабораторна робота №2 визначення теплоти гідратоутворення купрум (II) сульфату
- •Визначення теплоти нейтралізації сильної кислоти сильною основою у воді
- •Контрольні питання
- •Будова атома і молекули, електричні та оптичні властивості Рефрактометрія
- •Визначення рефракції речовини і встановлення його структури
- •Контрольні питання
- •Хімічна рівновага
- •Визначення залежності константи рівноваги від температури в гомогенній системі
- •Послідовність виконання роботи
- •Розрахунок рівноважних концентрацій речовин
- •Експерементальні данні
- •Контрольні питання
- •Розділ іv фазові рівноваги
- •Побудова та аналіз діаграм плавкості і3 простою евтектикою
- •Типи термопар
- •Визначення кристалізації речовини 3 розчину при низьких температурах
- •Послідовність виконання роботи
- •Лабораторна робота №7 кристалізація бінарних сумішей (система NaNо3 – kno3)
- •Контрольні питання
- •Розділ V розчини
- •Лабораторна робота №8 розподіл речовини між двома рідкими фазами
- •Послідовність виконання роботи
- •Визначення ступеня асоціації оцтової кислоти в бензолі (чи хлороформі)
- •Вивчення процесу екстрагування
- •Контрольні питання
- •Кріоскопія, ебуліоскопія
- •Установка термометра Бекмана для кріоскопії.
- •Лабораторна робота №11 визначення молекулярної маси речовини кріоскопічним методом
- •Послідовність виконання роботи.
- •Визначення молекулярної маси речовини ебуліоскопічним методом (метод визначення молекулярної маси по Сиволобову)
- •Послідовність виконання роботи.
- •Завдання до лабораторної роботи
- •Контрольні питання
- •Електрохімія
- •Водневий показник як кількісна характеристика кислотності-основності розчинів
- •Потенціометрія
- •Визначення рН буферних розчинів
- •Послідовність виконання роботи
- •Контрольні питання
- •Хімічна кінетика
- •Вивчення швидкості йодування ацетону
- •Послідовність виконання роботи
- •Контрольні питання
- •Вивчення швидкості інверсії цукру
- •Теоретичні відомості
- •Послідовність виконання роботи
- •Підготовка до роботи поляриметра
- •Контрольні питання
- •Вивчення кінетики розчинення твердої кислоти у воді
- •Дифузія
- •Послідовність виконання роботи
- •Котрольні питання
- •Додатки
- •Значення деяких фундаментальних сталих
- •Знаки деяких математичних дій
- •Множники і префікси для утворення десяткових кратних і дольних одиниць
- •Густина води при різних температурах
- •Питома електрична провідність 0,01м розчину kСl при різних температурах
- •Інтегральна теплота розчинення солей, які утворюють кристалогідрати, при температурі 18°с.
- •Йонні електричні провідності при нескінченному розведені λ∞
- •Йонні електричні провідності при нескінченному розведені при температурі 25°c
- •Література
- •Періодична система елементів д. І. Менделєєва
Лабораторна робота №1 визначення теплової сталої калориметра
Завдання.
Визначити зміну температури в калориметрі в результаті розчинення певної наважки KCl.
Обчислити моляльну концентрацію розчину і за табличними даними визначити кількість теплоти, що виділилася.
Обчислити теплову сталу калориметра.
Виконання роботи. Ретельно розтерти в фарфоровій ступці 6 г калій хлориду. Зважити з точністю до 0,001г порожню пробірку з пробкою, висипати в неї наважку солі і знову зважити. По різниці обчислити наважку. Зважити в калориметричну склянку чи в посудину Дьюара 300 г дистильованої води (з точністю до 0,1 г). Зібрати калориметр, закрити його кришкою, вставити в неї пробірку так, щоб низ пробірки був покритий водою. В другий отвір опустити термометр Бекмана. Перед початком роботи перевірити настройку термометра, опустивши його в розчин у калориметрі. Кінець стовпчика ртуті повинен встановитися біля середини шкали. Записати показання термометра в попередньому періоді. Після десятого відліку висипати сіль у воду і зважити пробірку. При розчиненні солі температура падає, потім починає рівномірно зростати. Початок підвищення температури відповідає кінцю головного періоду. Визначити графічно T і обчислити теплову сталу Ck за рівнянням (1.18). Інтегральна теплота розчинення калій хлориду (Н, кДж/моль) визначається за табличними даними (додаток табл.7), для цього заздалегідь розрахувати концентрацію розчину
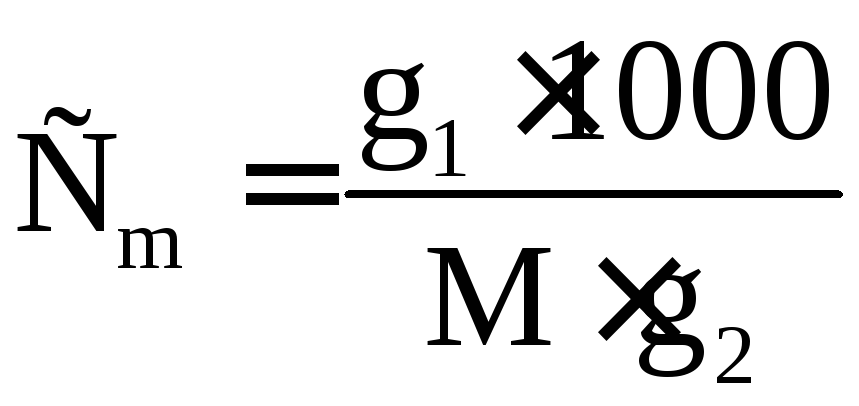 (1.19)
(1.19)
g1 – маса речовини (солі), г;
g2 – маса розчинника, г;
М – молекулярна маса речовини, г/моль.
Результати вимірювань записати в табл. 1.1:
Таблиця 1.1
Запис вимірювання температури під час досліду
|
Період |
Час, хв. |
Показання термометру, °С |
|
1) Попередній
|
1 2 3 4 5 6 |
|
|
2) Головний
|
7 8 |
|
|
3) Заключний |
9 10 11 12 13
|
|
Лабораторна робота №2 визначення теплоти гідратоутворення купрум (II) сульфату
Завдання:
Визначити інтегральну теплоту розчинення безводної солі та кристалогідрату і по різниці обчислити теплоту утворення кристалогідрату.
Виконання роботи. Теплову сталу калориметра розрахувати, як зазначено в роботі 1. Зібрати прилад (рис.1.1). Мідний купорос CuSO45H2O подрібнити у фарфоровій ступці. Близько 7,5 г його зважити з точністю до 0,1 г і помістити в зважену пробірку. Пробірку з сіллю зважити з точністю до 0,001 г. По різниці з порожньою пробіркою обчислити наважку. В склянку відважити 300 г води з точністю до 0,01 г. Реакція йде з поглинанням тепла. Вимірювання і запис результатів аналогічні роботі 1. По формулі (1.17) розрахувати Н2.
Близько 10 г мідного купоросу роздрібнити в фарфоровій чашці і нагріти, помішуючи, поки не утвориться біла безводна сіль. Отриману сіль негайно пересипати в пробірку і закрити гумовою пробкою і охолодити. Взяти наважку 4,5 г безводної солі і провести вимірювання аналогічно першому. Вимірювання і запис результатів аналогічні роботі 1. По формулі (1.17) розрахувати Н1.
Зіставити експерементально отримані теплоти розчинення з довідковими значеннями (додаток табл.7). Розрахувати відносну похибку.
Теплоту гідратоутворення (∆Hгідр.)Дж/моль, розрахувати за формулою: ∆Hгідр.= Н1 - Н2
Лабораторна робота №3
