
- •Лабораторний практикум
- •Фізична хімія
- •Передмова
- •Оформлення результатів вимірювань
- •Складання таблиць
- •Молярна електрична провідність водних розчинів
- •Побудова графіків
- •Розділ і термохімія
- •Лабораторна робота №1 визначення теплової сталої калориметра
- •Запис вимірювання температури під час досліду
- •Лабораторна робота №2 визначення теплоти гідратоутворення купрум (II) сульфату
- •Визначення теплоти нейтралізації сильної кислоти сильною основою у воді
- •Контрольні питання
- •Будова атома і молекули, електричні та оптичні властивості Рефрактометрія
- •Визначення рефракції речовини і встановлення його структури
- •Контрольні питання
- •Хімічна рівновага
- •Визначення залежності константи рівноваги від температури в гомогенній системі
- •Послідовність виконання роботи
- •Розрахунок рівноважних концентрацій речовин
- •Експерементальні данні
- •Контрольні питання
- •Розділ іv фазові рівноваги
- •Побудова та аналіз діаграм плавкості і3 простою евтектикою
- •Типи термопар
- •Визначення кристалізації речовини 3 розчину при низьких температурах
- •Послідовність виконання роботи
- •Лабораторна робота №7 кристалізація бінарних сумішей (система NaNо3 – kno3)
- •Контрольні питання
- •Розділ V розчини
- •Лабораторна робота №8 розподіл речовини між двома рідкими фазами
- •Послідовність виконання роботи
- •Визначення ступеня асоціації оцтової кислоти в бензолі (чи хлороформі)
- •Вивчення процесу екстрагування
- •Контрольні питання
- •Кріоскопія, ебуліоскопія
- •Установка термометра Бекмана для кріоскопії.
- •Лабораторна робота №11 визначення молекулярної маси речовини кріоскопічним методом
- •Послідовність виконання роботи.
- •Визначення молекулярної маси речовини ебуліоскопічним методом (метод визначення молекулярної маси по Сиволобову)
- •Послідовність виконання роботи.
- •Завдання до лабораторної роботи
- •Контрольні питання
- •Електрохімія
- •Водневий показник як кількісна характеристика кислотності-основності розчинів
- •Потенціометрія
- •Визначення рН буферних розчинів
- •Послідовність виконання роботи
- •Контрольні питання
- •Хімічна кінетика
- •Вивчення швидкості йодування ацетону
- •Послідовність виконання роботи
- •Контрольні питання
- •Вивчення швидкості інверсії цукру
- •Теоретичні відомості
- •Послідовність виконання роботи
- •Підготовка до роботи поляриметра
- •Контрольні питання
- •Вивчення кінетики розчинення твердої кислоти у воді
- •Дифузія
- •Послідовність виконання роботи
- •Котрольні питання
- •Додатки
- •Значення деяких фундаментальних сталих
- •Знаки деяких математичних дій
- •Множники і префікси для утворення десяткових кратних і дольних одиниць
- •Густина води при різних температурах
- •Питома електрична провідність 0,01м розчину kСl при різних температурах
- •Інтегральна теплота розчинення солей, які утворюють кристалогідрати, при температурі 18°с.
- •Йонні електричні провідності при нескінченному розведені λ∞
- •Йонні електричні провідності при нескінченному розведені при температурі 25°c
- •Література
- •Періодична система елементів д. І. Менделєєва
Вивчення швидкості йодування ацетону
Ціль роботи- визначити значення константи швидкості реакції йодування ацетону в кислому середовищи при двох температурах і вирахувати енергію активації цієї реакції.
Послідовність виконання роботи
Реакцію йодування
ацетону проводять при двох температурах
- кімнатній
і 40 ° C (термостат). У дві мірні колби на
250 см3
наливають
0,1 н. розчину
І2
в 4%-му розчині KІ, додають 25 см3
1н. розчину HCl, доливають дистильованою
водою, щоб до мітки залишилося приблизно
20 см3.
Одну з колб поміщають у термостат.
Зважують на аналітичних вагах конічну
колбочку з притертою пробкою, куди
наливають 10![]() 15
см3
води. Вливають в колбочку градуюваною
піпеткою приблизно 1,5 г ацетону (щільність
ацетону ρ20
= 0,792 г/см3).
Знову зважують колбочку на аналітичних
вагах і визначають за різницею масу
взятого ацетону.
15
см3
води. Вливають в колбочку градуюваною
піпеткою приблизно 1,5 г ацетону (щільність
ацетону ρ20
= 0,792 г/см3).
Знову зважують колбочку на аналітичних
вагах і визначають за різницею масу
взятого ацетону.
Для реакції, що протікає при кімнатній температурі, виливають розчин ацетону у мірну колбу, обполіскують колбочку однієї - двома невеликими порціями дистильованої води, які також виливають у мірну колбу і доливають до мітки останню.
Для реакції, що йде в термостаті, необхідно попередньо помістити колбочку з водним розчином ацетону і колбу з дистильованою водою в той же термостат і витримати 10-15 хв. Момент змішування розчину з ацетоном вважається моментом початку реакції. Колби з реакційними сумішами повинні бути закриті пробками, щоб уникнути випаровування ацетону.
Проби для аналізу відбирають відразу ж після початку реакції, потім беруть їх через кожні півгодини ще 4-5 разів (при кімнатній температурі) і через 5-15 хв при температурі термостата. Витрата гіпосульфіту на кожну наступну пробу повинен змінюватися на 1-3мл. Під час відбору проб колбу з термостата не виймати. Відібрані проби (за 25см3) виливають у 0,1 н. розчин ΝаНСО3 (25см3) і титрують розчином 0,01 н. Νа2S2О3 в присутності крохмалю. Результати вимірювань записати .
Таблиця 7.1
|
Кімнатна температура, ° C |
Температура термостата, ° C | ||
|
Концентрація, моль/ л |
|
|
|
|
розчину НCl |
|
|
|
|
розчину I2 |
|
|
|
|
Маса колбочки, г |
|
|
|
|
з водою і ацетоном |
|
|
|
|
з водою |
|
|
|
|
Наважка ацетону, г |
|
|
|
|
Еквівалентна концентрація, моль / л |
|
|
|
|
ацетону (С0А) |
|
|
|
|
Н + (С0В) |
|
|
|
|
Час змішення, год. |
|
|
|
Таблиця 7.2
|
Номер проби |
Час астрономічний |
Час від початку досвіду, хв |
nt
|
Cх |
k |
|
Кімнатна температура | |||||
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
4 |
|
|
|
|
|
|
Температура термостата | |||||
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
Величина Cх визначається з рівняння
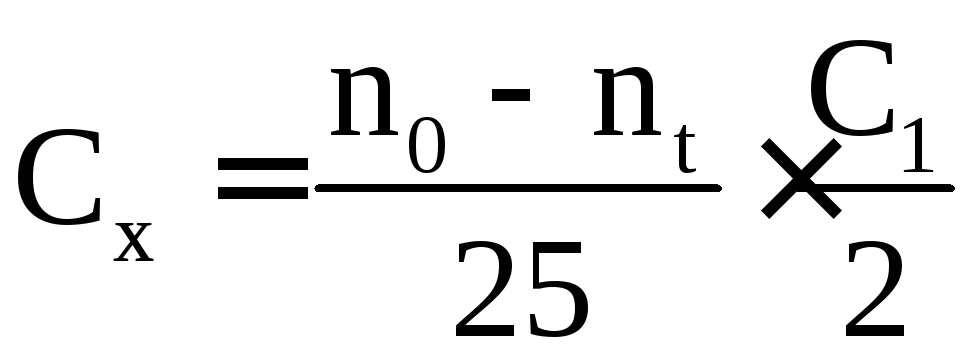 ,
(7.17)
,
(7.17)
де n0 - кількість 0,01н. розчину Νа2S2О3, яке мало бути витрачено на титрування в момент початку реакції, мл. Значення n0 практично визначити не вдається, тому що від моменту вливання ацетону до моменту взяття першої проби протікає значний час, тому n0 визначають за графіком. Для цього на міліметровому папері будують графіки в координатах n - t і екстраполяцією отриманих прямих до
t = 0 визначають n0 реакції);
nt - кількість 0,01 н. розчину Νа2S2О3, витрачений на титрування даної проби, мл;
С1 – молярна концентрація еквівалентів розчину Νа2S2О3 , моль/л.
Використовуючи розрахункове рівняння (7.12) і значення C0А, C0В, Cх і t, обчислити константу швидкості k. Після цього визначити величину kср, обчислити температурний коефіцієнт Вант-Гоффа і енергію активації.
