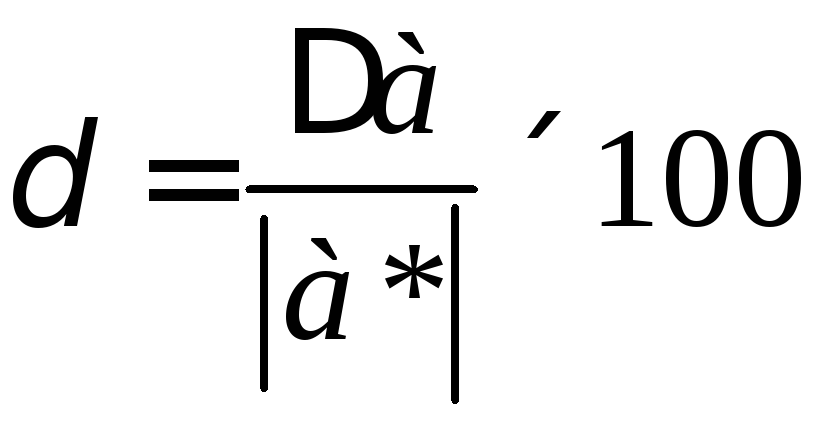- •Лабораторний практикум
- •Фізична хімія
- •Передмова
- •Оформлення результатів вимірювань
- •Складання таблиць
- •Молярна електрична провідність водних розчинів
- •Побудова графіків
- •Розділ і термохімія
- •Лабораторна робота №1 визначення теплової сталої калориметра
- •Запис вимірювання температури під час досліду
- •Лабораторна робота №2 визначення теплоти гідратоутворення купрум (II) сульфату
- •Визначення теплоти нейтралізації сильної кислоти сильною основою у воді
- •Контрольні питання
- •Будова атома і молекули, електричні та оптичні властивості Рефрактометрія
- •Визначення рефракції речовини і встановлення його структури
- •Контрольні питання
- •Хімічна рівновага
- •Визначення залежності константи рівноваги від температури в гомогенній системі
- •Послідовність виконання роботи
- •Розрахунок рівноважних концентрацій речовин
- •Експерементальні данні
- •Контрольні питання
- •Розділ іv фазові рівноваги
- •Побудова та аналіз діаграм плавкості і3 простою евтектикою
- •Типи термопар
- •Визначення кристалізації речовини 3 розчину при низьких температурах
- •Послідовність виконання роботи
- •Лабораторна робота №7 кристалізація бінарних сумішей (система NaNо3 – kno3)
- •Контрольні питання
- •Розділ V розчини
- •Лабораторна робота №8 розподіл речовини між двома рідкими фазами
- •Послідовність виконання роботи
- •Визначення ступеня асоціації оцтової кислоти в бензолі (чи хлороформі)
- •Вивчення процесу екстрагування
- •Контрольні питання
- •Кріоскопія, ебуліоскопія
- •Установка термометра Бекмана для кріоскопії.
- •Лабораторна робота №11 визначення молекулярної маси речовини кріоскопічним методом
- •Послідовність виконання роботи.
- •Визначення молекулярної маси речовини ебуліоскопічним методом (метод визначення молекулярної маси по Сиволобову)
- •Послідовність виконання роботи.
- •Завдання до лабораторної роботи
- •Контрольні питання
- •Електрохімія
- •Водневий показник як кількісна характеристика кислотності-основності розчинів
- •Потенціометрія
- •Визначення рН буферних розчинів
- •Послідовність виконання роботи
- •Контрольні питання
- •Хімічна кінетика
- •Вивчення швидкості йодування ацетону
- •Послідовність виконання роботи
- •Контрольні питання
- •Вивчення швидкості інверсії цукру
- •Теоретичні відомості
- •Послідовність виконання роботи
- •Підготовка до роботи поляриметра
- •Контрольні питання
- •Вивчення кінетики розчинення твердої кислоти у воді
- •Дифузія
- •Послідовність виконання роботи
- •Котрольні питання
- •Додатки
- •Значення деяких фундаментальних сталих
- •Знаки деяких математичних дій
- •Множники і префікси для утворення десяткових кратних і дольних одиниць
- •Густина води при різних температурах
- •Питома електрична провідність 0,01м розчину kСl при різних температурах
- •Інтегральна теплота розчинення солей, які утворюють кристалогідрати, при температурі 18°с.
- •Йонні електричні провідності при нескінченному розведені λ∞
- •Йонні електричні провідності при нескінченному розведені при температурі 25°c
- •Література
- •Періодична система елементів д. І. Менделєєва
Потенціометрія
Потенціометрія – це методи,які дозволяють визначити різні фізико-хімічні величини і проводити кількісний аналіз на основі вимірювань ЕРС різних електрохімічних елементів.
Потенціометричний вимір рН виконують за допомогою гальванічного елементу, один з електродів якого (індикаторний) оборотний щодо йонів водню, другий має постійний потенціал, що не залежить від властивостей досліджуваного розчину (електрод порівняння).
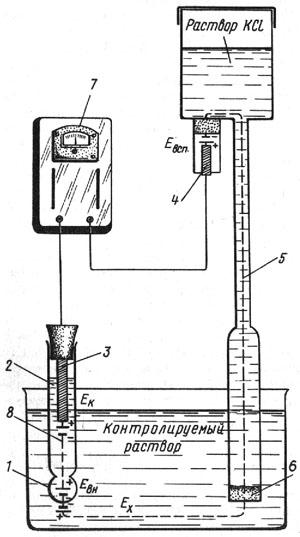
Рис.6.1 Схема електродної системи p-метра :
1 - порожня кулька з електродного скла; 2 - розчин, що заповнює внутрішню порожнину електрода; 3 - внутрішній контактний електрод; 4 - допоміжний електрод; 5 - електролітичний контакт; 6 - пориста перегородка; 7 - pНметр; 8 - скляний електрод.
Для виміру величини рН використовують електродну систему зі скляним електродом, електрорушійна сила якої залежить від активності йонів водню в розчині.
Скляний електрод 8 являє собою трубку з напаяною на корпус порожньою кулькою 1 з літієвого електродного скла.
При зануренні електрода в розчин, між поверхнею кульки електрода й розчином, відбувається обмін йонами, в результаті якого йони літію в поверхневих шарах скла заміщаються йонами водню, і скляний електрод здобуває властивості водневого електрода. Між поверхнею скла й контрольованим розчином виникає різниця потенціалів, обумовлена активністю йонів водню в розчині:
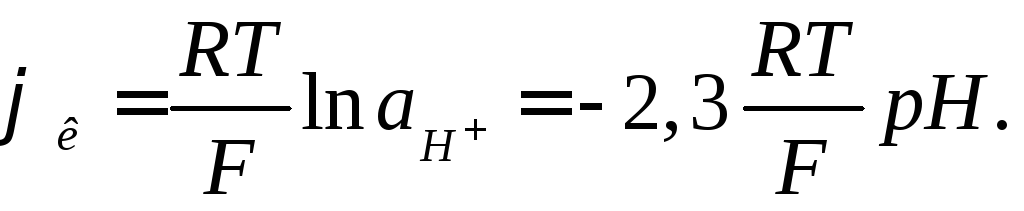 (6.12)
(6.12)
Для створення електричного кола при вимірі застосовуються контактні електроди: внутрішній контактний електрод 3 – хлорсрібний, здійснюючий електричний контакт із розчином HCl, що заповнює внутрішню частину скляного електрода, і зовнішній контактний електрод 4 (так званий електрод порівняння) – хлорсрібний електрод, здійснюючий електричний контакт із контрольним розчином.
Для захисту від впливу високих температур (при вимірі рН гарячих розчинів) електрод порівняння поміщають поза контрольним розчином і з'єднують із ним за допомогою електричного ключа 5 – трубки, наповненої насиченим розчином KCl , що закінчується пористою перегородкою 6. Розчин KCl безупинно просочується через пористу перегородку, запобігаючи проникненню з контрольного розчину в систему електрода сторонніх йонів, які могли б змінити потенціал електроду. Електрорушійна сила електродної системи дорівнює алгебраїчній сумі контактних потенціалів φк і φвсп, потенціалу, що виникає на внутрішній поверхні скляного електроду φвн і обумовленого величиною рН внутрішнього розчину і потенціалу, що виникає на зовнішній поверхні скляного електроду φх. Величини φк і φвсп, φвн не залежать від вмісту контрольного розчину й міняються тільки при зміні температури.
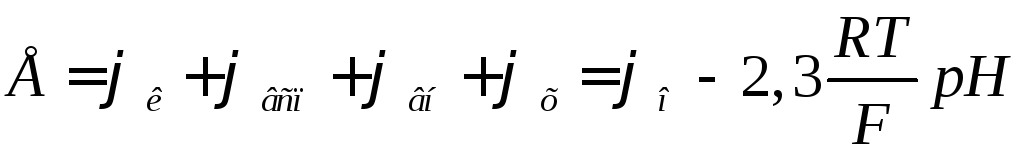 ,
(6.13)
,
(6.13)
де φ0 = φк + φвсп+ φвн .
Електрорушійна сила електродної системи лінійно залежить від величини рН розчину.
Замірюючи ЕРС електродної системи електронним мілівольтметром 7, шкала якого градуйована в одиницях рН, визначають величину рН контрольного розчину.
Лабораторна робота №13
Визначення рН буферних розчинів
ПОТЕНЦІОМЕТРИЧНИМ МЕТОДОМ
Ціль роботи: Визначити рН буферних розчинів потенціометричним методом.
Послідовність виконання роботи
Використовуючи 0,1н. розчин оцтової кислоти й оцтово-кислого натрію приготувати п'ять буферних розчинів. Загальна кількість буферної суміші й кількості CH3COOH і CH3COONa задає викладач. Визначити величини рН буферних розчинів на рН-метрі.
Розрахувати величини рН по вищенаведеному рівнянню (6.11, 6.10, 6.9) й порівняти з отриманими эксперементально значеннями.
Дані занести в таблицю 6.1.
Таблиця 6.1
Склад і рН буферних розчинів
|
Варіанти |
1 |
2 |
3 |
4 |
5 |
|
|
10 |
20 |
25 |
30 |
40 |
|
|
40 |
30 |
25 |
20 |
10 |
|
рН (пр) |
|
|
|
|
|
|
рН (теор) |
|
|
|
|
|
|
|
|
|
|
|
|
Контрольні питання
Що таке йонний добуток води?
Що таке рН розчину? Які значення має рН?
Як розрахувати рН розчину, якщо відома концентрація гідроксид-йонів?
За допомогою яких електродів визначають рН розчину?
Розповісти про будову скляного електроду.
Розповісти про будову хлорсрібного електроду.
Буферні розчини та їх властивості.
Що таке буферна ємність розчину?
Як розрахувати коефіцієнт активності?
Що таке йонна сила розчину?
Лабораторна робота №14
ВИЗНАЧЕННЯ СТУПЕНЯ Й КОНСТАНТИ ДИСОЦІАЦІЇ СЛАБКОГО ЕЛЕКТРОЛІТУ МЕТОДОМ ЕЛЕКТРИЧНОЇ ПРОВІДНОСТІ
Ціль роботи – установити залежності питомої й еквівалентної електричних провідностей від концентрації розчину (або розведення) і визначити ступені й константи дисоціації слабких електролітів.
Теоретичні відомості
Молекули електролітів у водних розчинах дисоціюють на йони, які і є носіями зарядів. Електрична провідність слабких електролітів, які дисоціюють у водних розчинах частково, визначається в основному ступенем дисоціації, що залежить від концентрації електроліту та температури.
Ступінь дисоціації α можна визначити методом виміру електричної провідності. Розрізняють питому й еквівалентну електричні провідності. Питома електрична провідність χ - величина, зворотна питомому опору:
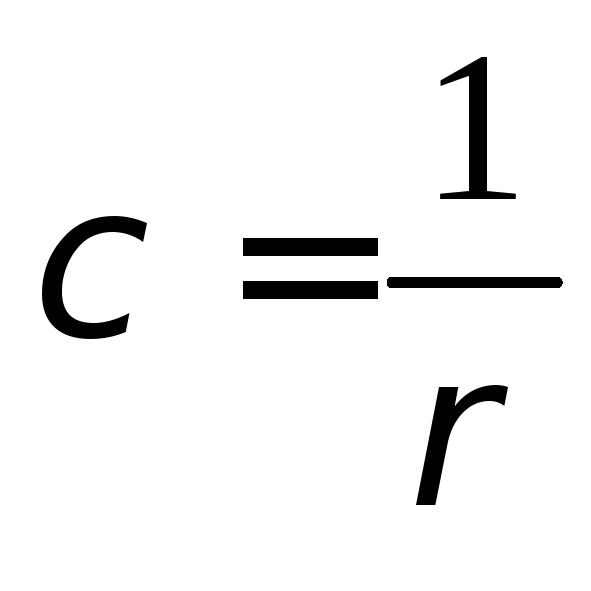 (6.14)
(6.14)
Електричний опір провідника R пов'язаний з питомим опором ρ рівнянням
R
═ ρ![]() ,
(6.15)
,
(6.15)
де ℓ - довжина провідника; s - площа поперечного переріза.
Таким
чином,
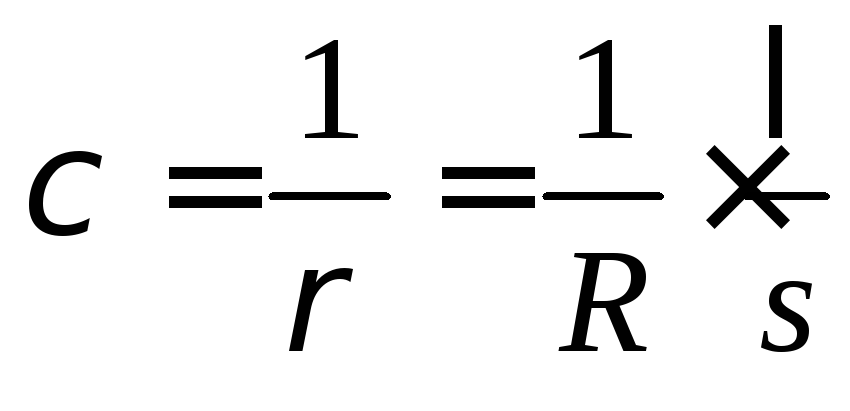 (6.16)
(6.16)
Відповідно
до закону Ома
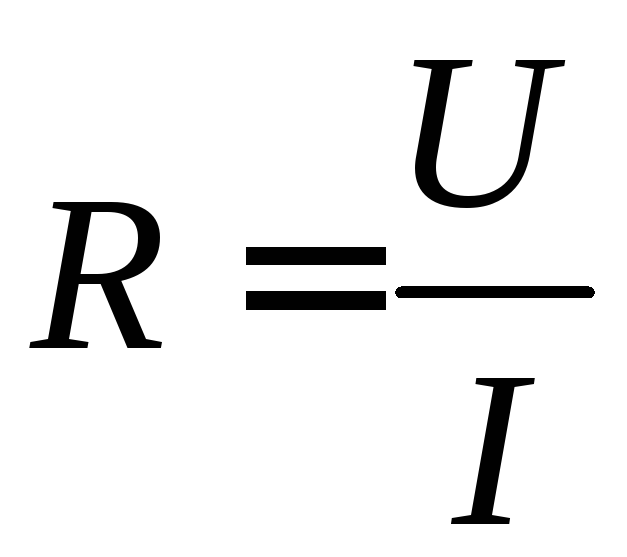 ,
(6.17)
,
(6.17)
де U – напруга; I – сила струму.
Отже,
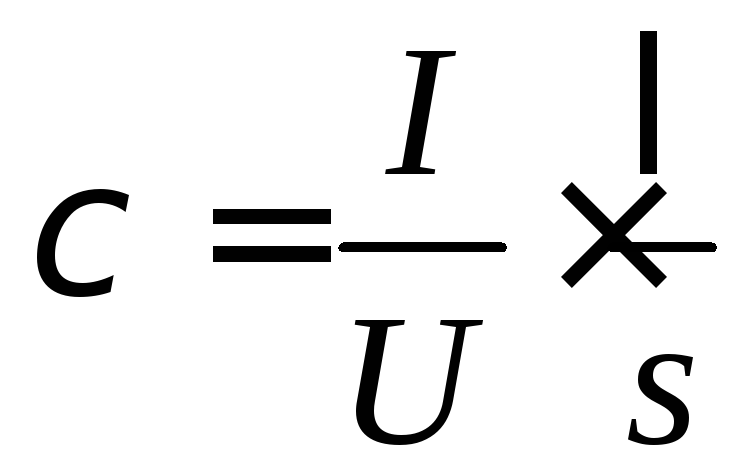 (6.18)
(6.18)
Питома електрична провідність χ дорівнює електричній провідності 1 см3 розчину, який міститься між плоскими паралельними електродами, що знаходяться на відстані 1 см один від одного провідники з одиничними розмірами (Ѕ = 1, ℓ = 1), її виражають в Ом-1м-1.
Еквівалентна (молярна) електрична провідність λ – це провідність розчину такого об’єму, в якому міститься один моль електроліту, і розчин вміщений між плоскими паралельними електродами, що знаходяться на одиничній відстані один від одного, і розраховується за рівнянням
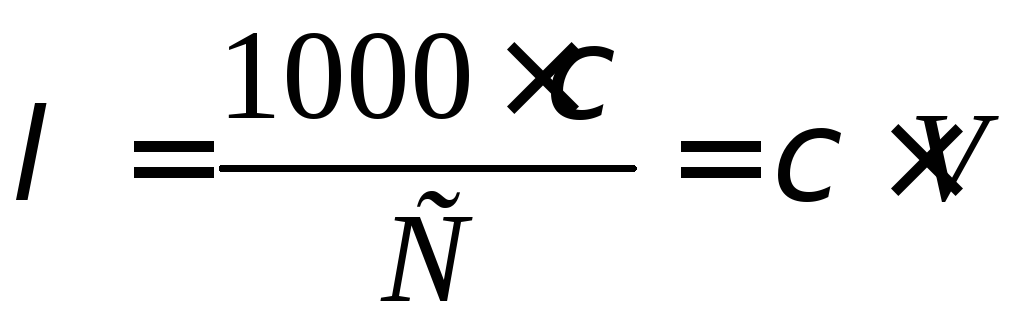 ,
(6.19)
,
(6.19)
де С – еквівалентна концентрація, моль/л; V – розведення (об'єм розчину, який містить 1 моль розчиненої речовини, см3).
Еквівалентна електрична провідність слабких електролітів збільшується з розведенням внаслідок зростання ступеня дисоціації електроліту.
Відповідно до закону незалежного руху йонів у розведених розчинах (закон Кольрауша)
![]() ,
(6.20)
,
(6.20)
де λ+∞ і λ-∞ йонні електричні провідності при нескінченному розведенні або рухливості йонів. Рухливості йонів пропорційні абсолютним швидкостям руху йонів:
λ+ ═ Fυ+, λ- ═ Fυ-, (6.21)
де υ+ і υ- - абсолютні швидкості руху, см2·с-1·В-1 ( F = 96500 Кл – стала Фарадея).
Абсолютною швидкістю руху йонів називається швидкість, з якої йони рухаються в електричному полі з градієнтом потенціалу 1В/см. Рухливості йонів залежать від температури, природи йона та природи розчинника. Обчислимо значення λ за рівнянням (6.19) і λ∞ для слабкого електроліту за рівнянням (6.20), використовуючи значення йонних электрорухливостей (додаток табл. 8, 9) і перераховуємо для відповідної температури. Розрахуємо його ступінь дисоціації
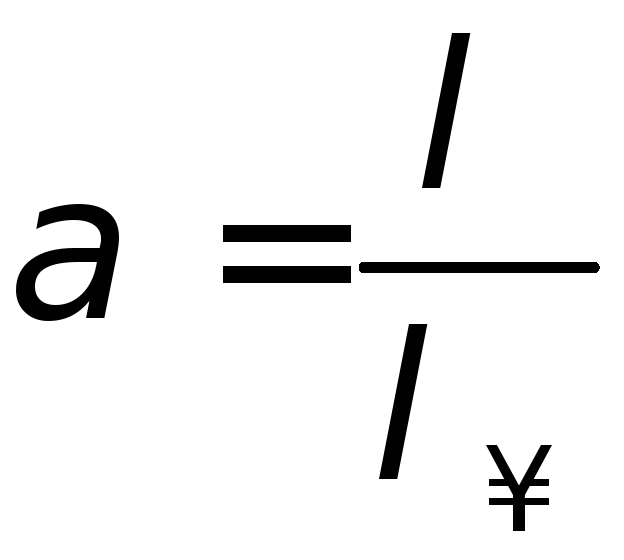 (6.22)
(6.22)
За законом розведення Оствальда визначимо константу дисоціації слабкого електроліту К, що залежить від температури, природи розчиненої речовини й природи розчинника. Для бінарного електроліту (КА ↔К++ А-)
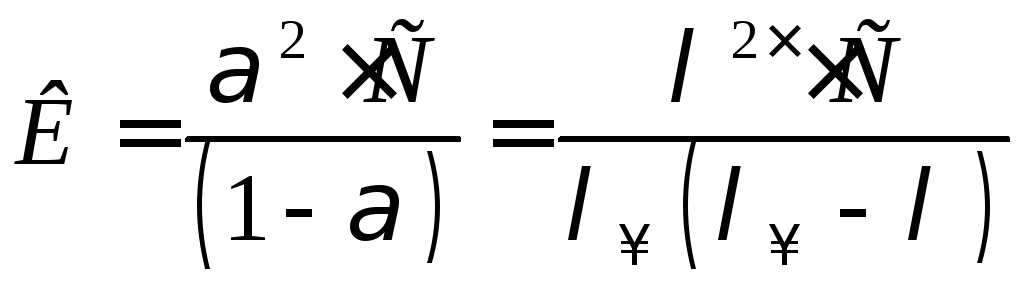 ,
(6.23)
,
(6.23)
де С – концентрація електроліту.