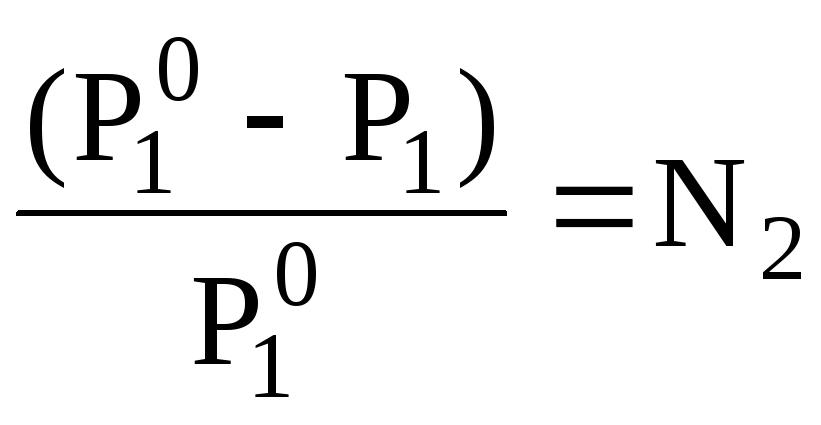- •Лабораторний практикум
- •Фізична хімія
- •Передмова
- •Оформлення результатів вимірювань
- •Складання таблиць
- •Молярна електрична провідність водних розчинів
- •Побудова графіків
- •Розділ і термохімія
- •Лабораторна робота №1 визначення теплової сталої калориметра
- •Запис вимірювання температури під час досліду
- •Лабораторна робота №2 визначення теплоти гідратоутворення купрум (II) сульфату
- •Визначення теплоти нейтралізації сильної кислоти сильною основою у воді
- •Контрольні питання
- •Будова атома і молекули, електричні та оптичні властивості Рефрактометрія
- •Визначення рефракції речовини і встановлення його структури
- •Контрольні питання
- •Хімічна рівновага
- •Визначення залежності константи рівноваги від температури в гомогенній системі
- •Послідовність виконання роботи
- •Розрахунок рівноважних концентрацій речовин
- •Експерементальні данні
- •Контрольні питання
- •Розділ іv фазові рівноваги
- •Побудова та аналіз діаграм плавкості і3 простою евтектикою
- •Типи термопар
- •Визначення кристалізації речовини 3 розчину при низьких температурах
- •Послідовність виконання роботи
- •Лабораторна робота №7 кристалізація бінарних сумішей (система NaNо3 – kno3)
- •Контрольні питання
- •Розділ V розчини
- •Лабораторна робота №8 розподіл речовини між двома рідкими фазами
- •Послідовність виконання роботи
- •Визначення ступеня асоціації оцтової кислоти в бензолі (чи хлороформі)
- •Вивчення процесу екстрагування
- •Контрольні питання
- •Кріоскопія, ебуліоскопія
- •Установка термометра Бекмана для кріоскопії.
- •Лабораторна робота №11 визначення молекулярної маси речовини кріоскопічним методом
- •Послідовність виконання роботи.
- •Визначення молекулярної маси речовини ебуліоскопічним методом (метод визначення молекулярної маси по Сиволобову)
- •Послідовність виконання роботи.
- •Завдання до лабораторної роботи
- •Контрольні питання
- •Електрохімія
- •Водневий показник як кількісна характеристика кислотності-основності розчинів
- •Потенціометрія
- •Визначення рН буферних розчинів
- •Послідовність виконання роботи
- •Контрольні питання
- •Хімічна кінетика
- •Вивчення швидкості йодування ацетону
- •Послідовність виконання роботи
- •Контрольні питання
- •Вивчення швидкості інверсії цукру
- •Теоретичні відомості
- •Послідовність виконання роботи
- •Підготовка до роботи поляриметра
- •Контрольні питання
- •Вивчення кінетики розчинення твердої кислоти у воді
- •Дифузія
- •Послідовність виконання роботи
- •Котрольні питання
- •Додатки
- •Значення деяких фундаментальних сталих
- •Знаки деяких математичних дій
- •Множники і префікси для утворення десяткових кратних і дольних одиниць
- •Густина води при різних температурах
- •Питома електрична провідність 0,01м розчину kСl при різних температурах
- •Інтегральна теплота розчинення солей, які утворюють кристалогідрати, при температурі 18°с.
- •Йонні електричні провідності при нескінченному розведені λ∞
- •Йонні електричні провідності при нескінченному розведені при температурі 25°c
- •Література
- •Періодична система елементів д. І. Менделєєва
Контрольні питання
Дайте визначення закону розподілу.
Чим пояснюється відхилення від закону розподілу?
В чому полягає процес екстрагування, теоретичне пояснення?
Як вести процес екстрагування, щоб досягти більшої повноти витягу речовини, що екстрагується, визначеним об'ємом екстрагуючої речовини?
Чим визначається число порцій екстрагуючої речовини?
Кріоскопія, ебуліоскопія
В стані рівноваги між рідиною і парою кількість молекул, що випаровується в одиницю часу дорівнює кількості, що конденсується. Якщо в леткій рідині розчинити невелику кількість будь-якої нелеткої речовини, то концентрація молекул розчинника зменшиться, відповідно до цього зменшиться і кількість молекул, що випаровуються, тобто тиск насиченої пари.
Відповідно до закону Рауля, при постійній температурі відносне зниження тиску насиченої пари розчинника над розчином дорівнює мольній частці розчиненої речовини:
|
|
(5.10) |
де Р10 і Р1 - тиск насиченої пари над чистим розчинником і розчином;
N2 - мольна частка розчиненої речовини.
Співвідношення між тиском насиченої пари і температурою для розчинника і розчинів різної концентрації показано на рис. 5.1. Крива ОА виражає залежність від температури тиску насиченої пари над чистим розчинником, криві ВС і ДЕ - тиск пари розчинника над розчинами нелеткої речовини різної концентрації. Чим вище концентрація розчиненої речовини, тим нижче тиск пари над розчином при даній температурі.
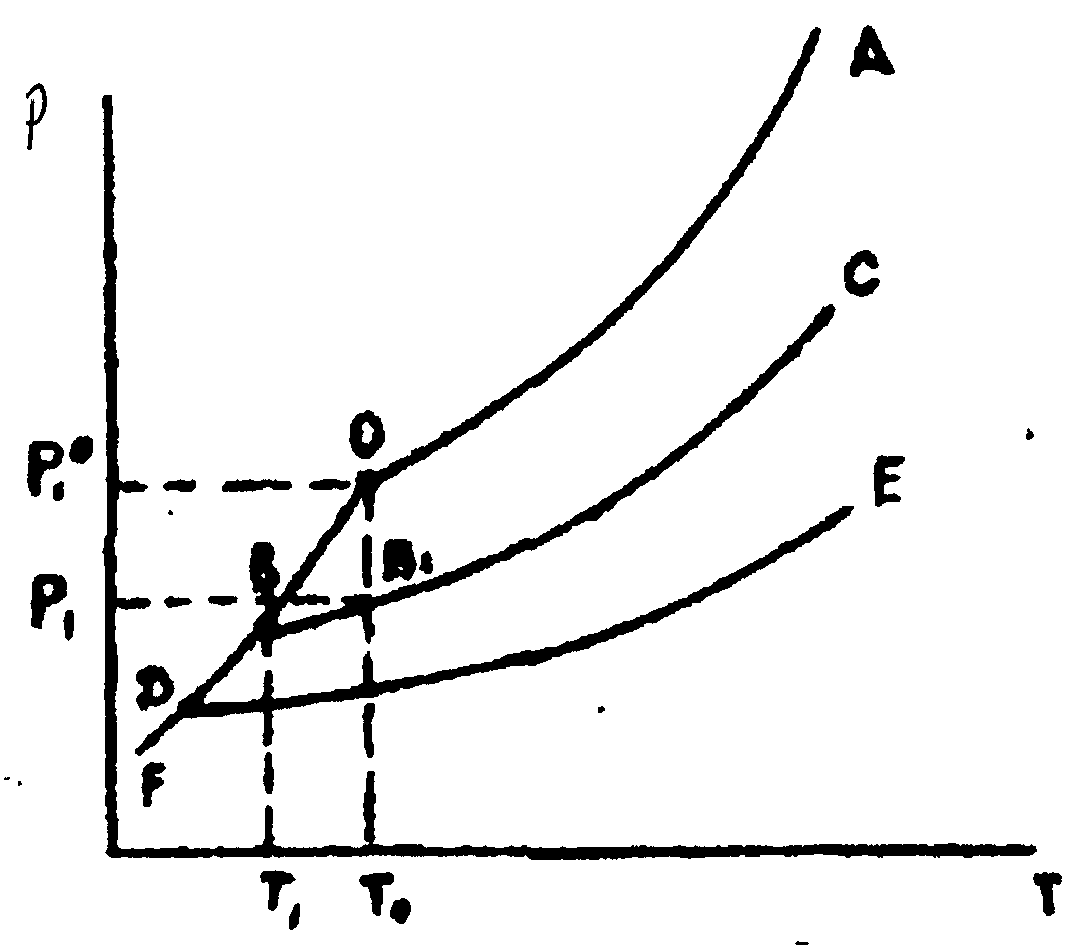
Рис. 5.1. Залежність тиску насиченої пари над розчинником і розчинами від температури
Крива OF показує залежність тиску насиченої пари над твердою фазою від температури. Крива OF завжди крутіше, ніж крива ОА, тому що теплота сублімації більше теплоти випаровування. Точка замерзання рідини характеризується рівноважним існуванням рідкої, кристалічної і газової фаз, при цьому тиск насиченої пари над рідкою і кристалічною фазами повинен бути рівний, тобто точка замерзання розчинника повинна лежати на перетині кривих FO і ОА. При замерзанні розведеного розчину з нього викристалізовується чистий розчинник. У точці замерзання повинні бути рівні тиски пари над розчином і над кристалічним розчинником (у випадку водного розчину - над льодом). При температурі замерзання чистого розчинника Т0 тиск пари над розчином Р1 (точка В) нижче, ніж над твердим розчинником Р10 (точка О), і рівноваги немає. Рівновага може бути досягнута лише при більш низькій температурі — в точці перетину кривої ВР із кривої FO (точка В). Чим вище концентрація розчиненої речовини, тим нижче температура замерзання розчину (точка Д). При виділенні з розчину кристалів розчинника концентрація розчиненої речовини в розчині підвищується, а температура замерзання розчину все більш знижується.
Зниження температури замерзання прямо пропорційно зниженню тиску пари, що за законом Рауля пропорційно концентрації розчиненої речовини:
|
|
(5.11) |
де
![]() -
молярна концентрація, рівна
-
молярна концентрація, рівна
![]() ;
;
q0 і q1 - маси розчинника і розчиненої речовини;
М - молярна маса розчиненої речовини.
Кріоскопічна стала (константа замерзання) Ккр є величиною, характерною для даного розчинника, яка залежить від природи розчиненої речовини. Фізичний зміст її пояснюється наведеним рівнянням: Ккр - це зниження температури замерзання розчину, що містить 1 моль речовини в 1000 г розчинника, за умови, що розчин цієї концентрації має властивості ідеального, і розчинена речовина не дисоціює і не асоціює. Для експериментального визначення слід виміряти зниження температури замерзання розведених розчинів, а потім перерахувати ці дані на 1 моль. Ккр можна обчислити теоретично, знаючи температуру замерзання чистого розчинника Т0 (Тводи = 273,15 К) і його питому теплоту плавлення за рівнянням ∆Нпл / ∆Нпл.льоду = 333 ,34 Дж/г
|
|
(5.12) |
де R = 8,314 Дж/мольК, Ккр .води = 1,86.
Якщо розчинена речовина розпадається в розчині на йони, то число частинок у розчині збільшується. Тому зниження тиску пари, підвищення температури кипіння і зниження температури замерзання в розчині електроліту більше, ніж у розчині неелектроліту з такою ж молярною концентрацією.
Для кріоскопічних вимірювань застосовують прилад, запропонований Бекманом, схему якого наведено на рис.5.2. Прилад складається зі скляної широкогорлої пробірки 1 для розчинника. У верхній частині її роблять відросток 2 для внесення речовини, що розчиняється. Пробірку закривають корковою пробкою 3, в яку вставлено термометр Бекмана 4 і латунну мішалку 5. За допомогою гумової прокладки 6 пробірку вміщують у повітряну скляну муфту 7, що занурюють у кріостат 8. Кріостат являє собою товстостінну скляну чи металеву банку, наповнену охолоджувальною сумішшю (лід + сіль), всередині якої встановлено мішалку 9 і термометр.
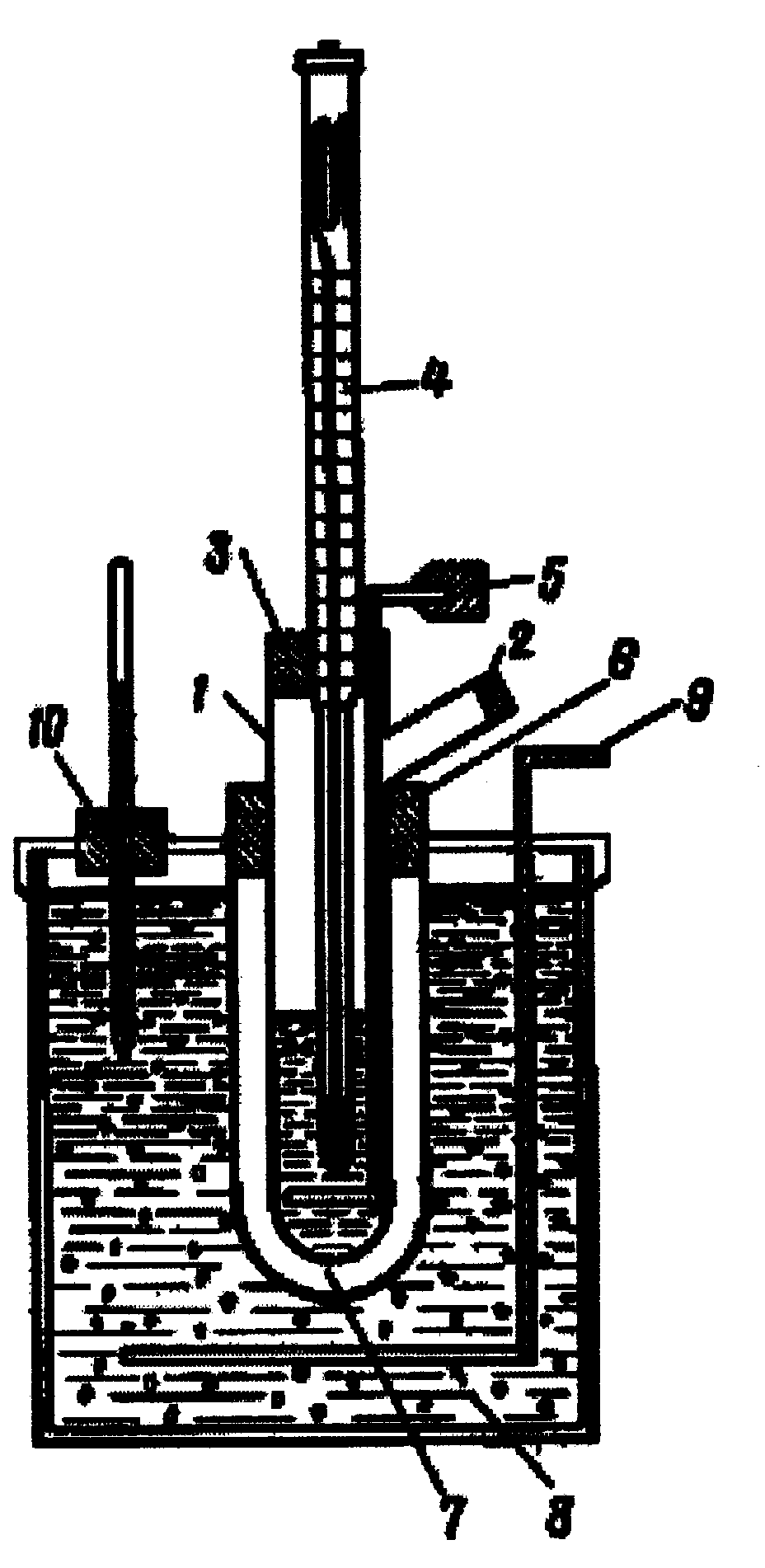
Рис. 5.2. Схема приладу для визначення температури замерзання
Попередньо декілька разів визначають температуру замерзання розчинника, потім, після внесення визначеної кількості розчиненої речовини в даний розчинник — температуру замерзання отриманого розчину. Процес кристалізації чистого розчинника, починаючи з появи першого кристалика до повного затвердіння всієї рідини, протікає при постійній і визначеній температурі.
Кріоскопічний метод застосуємо до сильно розведених розчинів бінарних неізоморфних систем. Отже, при затвердінні такого розчину спочатку випадають кристали чистого розчинника і розчин стає більш концентрованим, а температура кристалізації більш низькою. Тому, при визначенні температури затвердіння розчину, слід визначати температуру початку кристалізації. Іноді рідина може переохолодитися і фактично кристалізація почнеться при більш низькій температурі, що приводить до помилки у вимірюванні величини Тзам. Для більш точного визначення істинної температури початку кристалізації не можна сильно переохолоджувати розчин. Кількість розчинника, що відмірюють з бюретки чи відважують на аналітичних вагах, повинна бути такою, щоб у пробірці вона могла покрити всю голівку термометра Бекмана. Кількість розчину чи розчинника звичайно беруть близько 20 мл. На пробірку з розчинником надягають повітряну муфту, після чого пробірку вставляють у приготовлену охолоджувальну суміш і дають розчиннику охолонути, а в цей час настроюють термометр Бекмана.