
- •Міністерство аграрної політики та продовольства україни
- •Розділ 1. Статична біохімія
- •Тема 2. Динамічна біохімія
- •Тема 3. Технічна біохімія
- •Загальні вимоги до виконання індивідуального завдання
- •Перелік тем рефератів для виконання індивідуального завдання
- •Рекомендована література
- •Зразок оформлення титульного аркуша
- •Таблиця для визначення номерів питань за номером залікової книжки для реферату з розділу № 2 (Динамічна біохімія)
- •Таблиця для визначення номерів питань за номером залікової книжки для реферату з розділу № 3 (Технічна біохімія)
- •Вступ . . . . . . . . . . . . . . . . . . . . . . . . . . . 4
Розділ 1. Статична біохімія
Білки становлять основну масу органічних азотистих речовин рослин. Білки – це складні високомолекулярні сполуки, що перебувають в організмі в колоїдному стані. Молекула білка складається із залишків амінокислот, зв'язаних пептидними зв'язками в поліпептидні ланцюги, які можуть бути з’єднані між собою дисульфідними, ефірними, водневими та іншими зв'язками.
Молекула білка є амфотерним з'єднанням, тобто містить карбоксильні (кислі) і аміні (основні) групи.
Білкова молекула дуже лабільна, легко денатурує, в результаті чого змінюються її біологічні та фізико-хімічні властивості. Під дією ферментів, а також кислот, білки розщеплюються, утворюючи ряд проміжних продуктів дезагрегації (протеози, пептони, пептиди) і кінцеві продукти гідролізу – амінокислоти.
Білки розділяють на дві великі групи: прості білки – протеїни та складні – протеїди. Прості білки не містять небілкових груп, вони в основному складаються з амінокислот; складні – містять крім власно білка, ще й небілкову (простетичну) групу.
До простих білків відносяться альбуміни, глобуліни, проламіни, глютеліни, протаміни і гістони. Найбільша кількість альбумінів міститься в зелених частинах рослин.
Глобуліни є найпоширенішою групою природних білкових тіл. У рослинах глобуліни зустрічаються у великій кількості у вигляді відкладень у насінні. Глобуліни на відміну від альбумінів нерозчинні у воді. У насінні пшениці та жита із проламінів міститься гліадин; в насінні ячменя – гордеїн. В насінні злакових і зелених частинах рослин поряд з іншими білками містяться глютеліни. Гліадин і глютенін становлять білки клейковини.
До складних білків належать хромопротеїди (сполуки білка з пігментами); нуклеопротеїди, простетичною частиною яких є нуклеїнові кислоти; фосфопротеїди – білки, що містять фосфорну кислоту; глюкопротеїди – сполуки білка зі складними вуглеводами; ліпопротеїди – білки, з'єднані з жироподібними речовинами ліпоїдами.
До складу хромопротеїдів входять такі життєво важливі, близькі за хімічною структурою, речовини як хлорофіл і гем.
У зародках насіння і в ядерній речовині клітин міститься велика кількість нуклеопротеїдів. Вони мають високу специфічність, беруть участь у синтезі білка, у передачі спадковості та в ряді інших важливих життєвих функціях рослинних і тваринних організмів. У цих процесах велику роль відіграють нуклеїнові кислоти, яких не менше, ніж індивідуальних білків.
Нуклеїнові кислоти являють собою полінуклеотиди, - полімери що складаються з великої кількості різних зв'язаних між собою мононуклеотидів, а кожен з них в свою чергу складається з пуринової або піримідинової основи, пятивуглецевого цукру – рибози або дезоксирибози та фосфорної кислоти.
До мононуклеотидів відноситься аденозинмонофосфат, що відіграє велику роль в обміні речовин і в диханні. Аденозинмонофосфат (аденілова кислота), скорочено АМФ, може приєднувати до свого радикалу один або два залишки фосфорної кислоти, утворюючи при цьому аденозиндифосфат (АДФ) або аденозинтрифосфат (АТФ). У макроергічних зв'язках цих сполук акумулюється велика кількість енергії, яка використовується в реакціях біосинтезу, дихання та ін.
Нуклеопротеїди мають високу молекулярну масу, яка сягає 10000000. Другий небілковий компонент нуклеопротеїдів – нуклеїнові кислоти – також високомолекулярні сполуки з молекулярною масою до декількох мільйонів.
Розрізняють два типи нуклеїнових кислот: рибонуклеїнову (РНК) і дезоксирибонуклеїнову кислоту (ДНК). До складу першої входить рибоза, другої – дезоксирибоза. Встановлено, що дезоксирибонуклеїнова кислота є важливою складовою частиною клітинних ядер, а рибонуклеїнова кислота в основному входить до складу протоплазми клітин.
До складу мононуклеотидів входять такі важливі пуринові основи, як аденін і гуанін, які є похідними пурину:

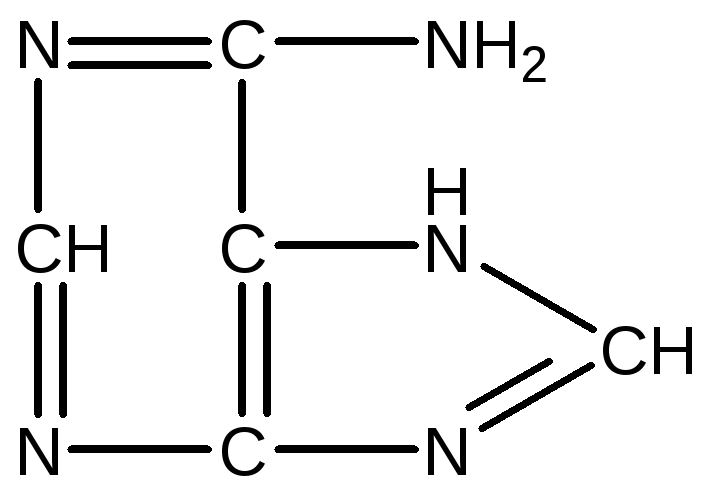
Пурин Аденін
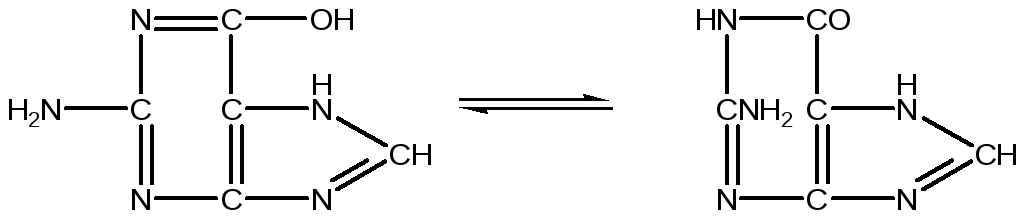
Енольна форма Кетоформа
![]()
Гуанін
Похідними піримідину є цитозин, урацил і тимін:
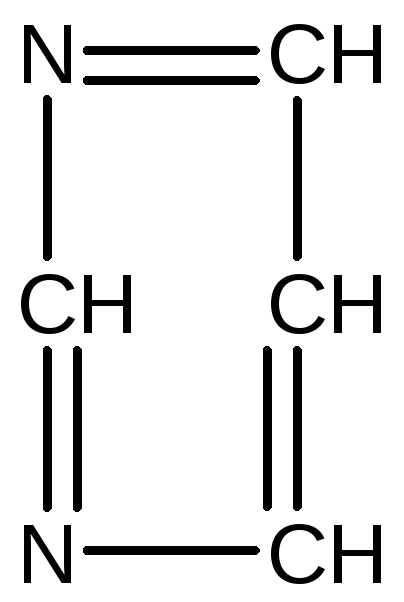

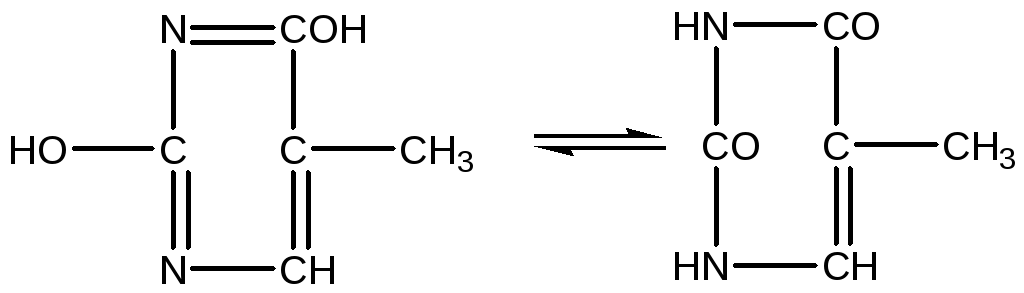
ПіримідинЕнольна форма Кетоформа
![]()
Цитозин
Енольна форма Кетоформа
![]()
Тимін


Енольна форма КетоформаРибоза
![]()
Урацил
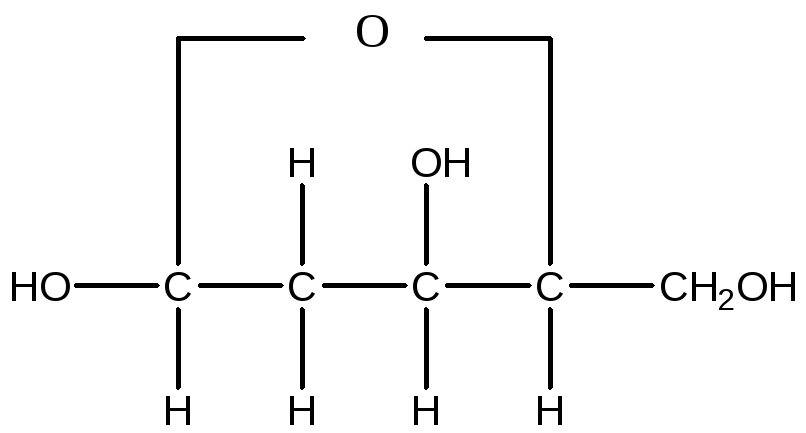
Дезоксирибоза
Сполука, що складається з тієї або іншої пуринової чи піримідинової основи, зв'язаних з вуглеводом (рибоза або дезоксирибоза), називається нуклеозидом. Нуклеозид, що складається з аденіну, зв'язаного з рибозою, називається аденозином:
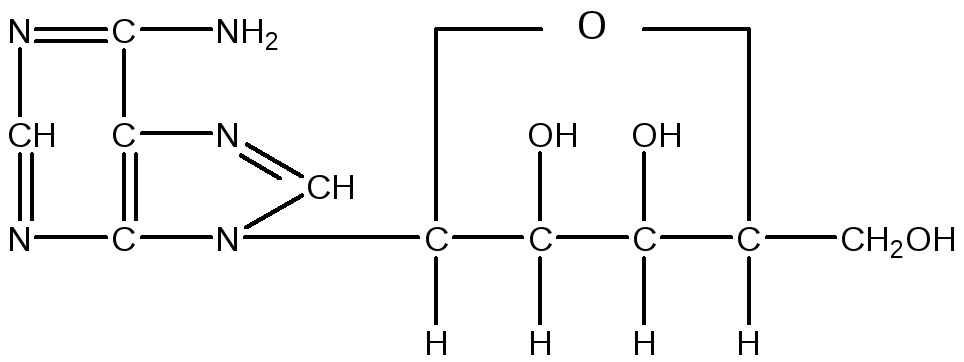
Аденозин
Аденозин, зв'язаний із залишком фосфорної кислоти, є мононуклеотидом, що називається аденозинмонофосфатом, скорочено АМФ:
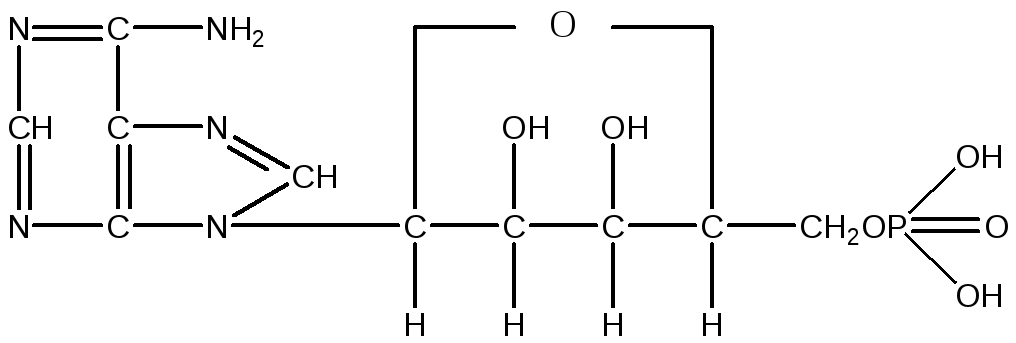
АМФ
Одним із дуже важливих представників мононуклеотидов, який містить три залишки фосфорної кислоти, є аденозинтрифосфат (АТФ), що відіграє надзвичайно важливу роль в обмінних процесах синтезу й розпаду, що ідуть в організмі:
Макроергічні зв’язки
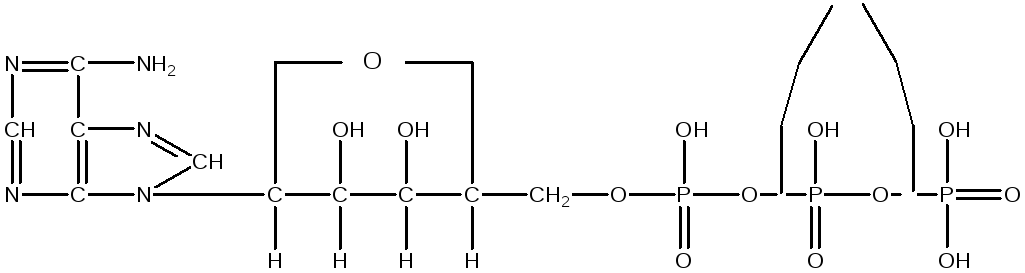 АТФ
АТФ
АТФ не тільки містить значну кількість фосфорної кислоти, але і великий запас теплової енергії у вигляді макроергічних зв'язків, при розриві яких звільняється в 5 разів більше енергії, чим при розриві простого зв'язку. Ця енергія передається разом з фосфатними залишками сполукам, що вступають в різні обмінні процеси, пов'язані з диханням і бродінням.
Ферменти (ензими) являють собою речовини білкової природи і є специфічними біологічними каталізаторами життєвих процесів рослинного й тваринного організму. Вони входять до складу всіх клітин і тканин та обумовлюють здатність живих організмів здійснювати величезну кількість різноманітних хімічних реакцій, пов'язаних з обміном речовин. Ферменти здатні прискорювати хімічні реакції в 106-109 разів.
Ферменти поділяються на однокомпонентні й двохкомпонентні. Однокомпонентні відносяться до простих білків-протеїнів; двохкомпонентні, що складаються з білкового і небілкового компонентів, відносяться до складних білків-протеїдів. До складу молекули цих ферментів як небілковий компонент нерідко входять вітаміни. Більшість гідролітичних ферментів відносяться до простих білків. Ферменти, які каталізують окислювально-відновлювальні процеси, звичайно належать до числа складних білків.
Активність ферментів залежить від реакції середовища, температури, від фізико-хімічного складу субстрату, деяких специфічно діючих на ферменти речовин (активатори і інгібітори) і інших факторів. Кожний фермент має свій температурний і рН-оптимум, при якому він проявляє максимальну активність.
Хімічний склад ферментів, так само як і білків, ще далеко не вивчений повністю, а тому визначення їхньої кількості викликає великі труднощі. Про активність ферментів судять по силі дії їх на певні речовини – субстрати. Кількість продуктів розпаду або синтезу, що утворюються при дії ферменту на субстрат, служить критерієм для визначення ступеня активності його.
При порівняльному визначенні ступеня активності тих або інших ферментів користуються строго певною методикою, тому що незначні відхилення від її супроводжуються значними розбіжностями отриманих результатів. Дані, що визначають ступінь активності ферменту, виражають у відносних одиницях, що залежать від прийнятого часу інкубації, реакції середовища, температурних умов, характеру субстрату, на який діє фермент, і від ряду інших факторів.
У такий спосіб дослідження активності ферментів є одним зі складних завдань.
Протеази (протеолітичні ферменти) відносяться до групи гідролаз, вони каталізують гідролітичне розщеплення білкових речовин за місцем пептидних зв'язків:
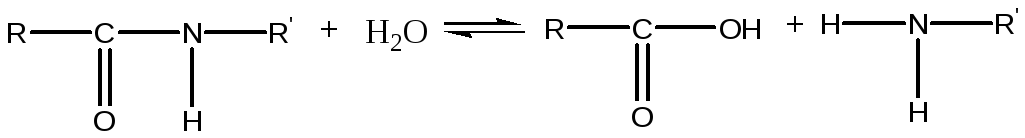
Реакція ферментативного гідролізу білків оборотна.
Протеази прийнято підрозділяти на протеїнази і пептидази. Протеїнази ведуть гідроліз безпосередньо нативных (природних) білків. Представниками протеїназ є рослинні папаїни, пепсин, трипсин і ін. При цьому слід зазначити, що вони, крім гідролізу білків, гідролізують і різні поліпептиди і дипептиди.
Пептидази діють тільки на пептиди і при тому мають велику специфічність дії. Їхня дія на субстрат залежить від розташування в ньому певних хімічних угрупувань. Так, наприклад, за характером своєї дії вони діляться на амінопептидази і карбоксипептидази. Перші зкорочують поліпептидний ланцюжок з амінного кінця, другі – з карбоксильного.
Місце дії Місце дії
карбоксипептидази амінопептидази
Крім того, є дипептидази, які гідролізують дипептиди.
Зміна активності рослинних протеїназ залежить від періоду розвитку рослини. Так, наприклад, при проростанні насіння спостерігається підвищення їх протеолітичної активності поряд з підвищенням активності інших ферментів. Незрілі насінини також мають підвищену ферментативну активність.
Підвищена ферментативна активність пророслого або недозрілого зерна пшениці нерідко негативно впливає на якість борошна і готового хліба. З підвищенням протеолітичної активності знижується еластичність клейковини борошна за рахунок гідролізу її білків.
Крім того, підвищення протеолітичної активності зерна супроводжується інтенсивним нагромадженням амінокислот у продуктах його переробки.
Амінокислоти ж є джерелом ряду з'єднань (меланоідини, ефіри, сивушні масла і т.п.), що утворюються при різних технологічних процесах (у хлібопеченні, у бродильному виробництві і ін.), які обумовлюють смак, колір і аромат готових продуктів і впливають на якість їх.
Протеолітичні ферменти дуже впливають на якість дріжджів. З підвищенням протеолітичної активності дріжджів підвищується ступінь автолізу і різко знижується їхня якість.
Таким чином, визначення протеолітичної активності рослинної сировини і продуктів його переробки має винятково важливе значення.
Протеолітичну активність ферментів визначають за характером розщеплення білкових речовин і за кількістю продуктів, що утворюються. Є наступні способи визначення кількості амінокислот:
- за вмістом азоту аміногруп або карбоксильних груп;
- за наростанням кількості водорозчинних білкових речовин;
- за виміром в'язкості розчинів желатину;
- за збільшенням кількості небілкових азотистих з'єднань, осаджуваних характерними осаджувачами білків;
- за індивідуальним обліком деяких амінокислот, що утворюються при гідролізі білкового субстрату (наприклад, сіркомістких амінокислот, тирозину).
Про інтенсивність протеолізу можна судити за кількістю зниклого субстрату або за кількістю продуктів гідролізу.
Вуглеводи є найпоширенішими органічними речовинами в природі. Вони становлять до 85-90 % сухих речовин, що містяться в рослинному організмі, і якщо врахувати, що основна частина маси живої речовини на земній кулі припадає на частку рослин, то можна уявити ту величезну роль, що відіграють вуглеводи в живій природі.
Синтез вуглеводів у рослині відбувається за рахунок світлової енергії й засвоєння вуглекислого газу в присутності хлорофілу. Цей процес одержав назву фотосинтез, що є джерело утворення органічних сполук на Землі. Сумарне рівняння фотосинтезу має такий вигляд:
Світло
6CO2+12H2 O ––––––→ C6H12O6+6H2O+6O2
Хлорофіл
Фотосинтез є єдиним джерелом вільного кисню на нашій планеті.
Вуглеводи в живому організмі використовуються для найрізноманітніших процесів обміну речовин. З них утворюються органічні кислоти, спирти, жири й ряд інших органічних сполук. За рахунок вуглеводів розвиваються нові органи і тканини рослин. Вуглеводи відкладаються у вигляді запасних речовин у зерні, бульбах, коренеплодах і т.п. Вони є опорним матеріалом рослинних клітин і тканин, що забезпечують міцність. Харчова цінність рослинних продуктів як джерела енергії визначається головним чином вмістом в них вуглеводів, які поповнюють енергетичні витрати організму людини й тварин.
По хімічному складу вуглеводи діляться на прості й складні. До простих вуглеводів відносяться моносахариди, до складних – полісахариди. Складні вуглеводи ще підрозділяються на полісахариди першого й другого порядку.
До моносахаридів відносяться гексози (глюкоза, фруктоза, маноза й галактоза) і пентози (ксилоза, арабіноза, рибоза, дезоксирибоза і рамноза). Моносахариди завдяки вільному кетонному або альдегідному угрупуванню здатні окислятися до відповідних кислот мають, таким чином, редуцируючі властивості, які використовуються для ряду якісних реакцій і кількісних визначень. Редуцирують не тільки моносахариди, але і деякі дисахариди, що мають у своїй структурі полуацетальний (глюкозидний) гідроксил.
Складні вуглеводи побудовані з моносахаридів. Дисахариди складаються із двох залишків моносахаридів, зв'язаних глюкозидним зв'язком по тому або іншому вуглецевому атому (мальтоза, сахароза, целлюбіоза, гентібіоза, мелібіоза й ін.). Трисахариди складаються із трьох залишків моносахаридів (рафіноза), тетрасахариди – із чотирьох залишків (стахиоза). Ця група ди-, три- і тетрасахаридів відносяться до полісахаридів першого порядку, або олігосахаридів. Всі представники легко розчиняються у воді і у чистому виді є кристалічними речовинами.
Вуглеводи, що складаються з великої кількості залишків моносахаридів, відносяться до полісахаридів другого порядку. Це складні високомолекулярні сполуки, кількість залишків простих сахаридів для багатьох з них ще точно не встановлена. У воді вони або не розчиняються, або утворять колоїдні розчини. До них належать такі важливі вуглеводи, як крохмаль, глікоген, геміцелюлози, пектинові речовини, клітковина, інулін і ін.
Вітамінами називають біологічно активні органічні сполуки, які мають порівняно низьку молекулярну масу, різноманітні за хімічною природою і необхідні людині і тварині в дуже невеликій кількості відносно основних поживних речовин. Вони широко поширені в живій природі й відіграють значну роль у процесах обміну речовин. Відкриття вітамінів належить нашому вітчизняному вченому Н.І. Луніну, який в 1880 р. показав у своїх дослідах на мишах, що вітаміни є обов'язковою складовою частиною їжі.
Відсутність вітамінів у їжі супроводжується глибокими фізіологічними порушеннями, які ведуть до захворювань, що отримали назву авітамінози. Якщо хвороба виникає внаслідок відсутності декількох вітамінів, то її звичайно називають поліавітамінозом. При недоліку того або іншого вітаміну виникає захворювання, називане гіповітамінозом. При надмірно надлишковому вживанні вітамінів може виникнути захворювання, назване гіпервітамінозом. Залежно від нестачі того або іншого вітаміну виникають такі захворювання, як цинга, рахіт, куряча сліпота й ряд інших.
Вчення про вітаміни в цей час перетворилося в самостійну науку – вітамінологію, так само як вчення про ферменти – у ферментологію (ензимологію). Великою кількістю досліджень показано, що біологічна активність вітамінів пояснюється їхнім нерозривним зв'язком з ферментами.
Вітаміни необхідні не тільки тваринам, але й рослинам та мікроорганізмам.
Основним джерелом вітамінів для людини й тварин є рослини, де вони синтезуються в значних кількостях. Деякі тканини вищих рослин (корінь, камбіальні тканини й ін.) не синтезують вітамінів, але вони потрібні для їхнього росту й розвитку. Так, наприклад, було встановлено, що вітаміни B1 і В2 (тіамін і рибофлавін) стимулюють ріст корінців багатьох рослин.
Нижчі рослини, гриби й бактерії також мають потребу у вітамінах. Деякі види нижчих рослин мають надзвичайно сильно виражену здатність до синтезу певних вітамінів, що має велике практичне значення. Певні види дріжджів у відповідних умовах харчування (з додаванням тіазолу) синтезують значну кількість вітаміну B1. Дріжджі здатні не тільки інтенсивно синтезувати вітамін B1, але й концентрувати його. Велику кількості вітаміну В2 синтезують дріжджеподібні мікроорганізми. Синтез рибофлавіну особливо інтенсивно протікає при вмісті в поживних солях середовища заліза. Підбираючи певні раси, можна досягти досить великого вмісту рибофлавіну й у пекарських дріжджах, а у зв'язку із цим у значній мірі збагатити хліб вітаміном B2, якого в борошні міститься досить мало.
Вітаміни ділять на дві групи. До першої групи відносять вітаміни, розчинні в жирах, а до другої – вітаміни, розчинні у воді. До жиророзчинних відносять вітаміни A, D, Е, К, а до водорозчинних – B1, В2, В6, РР, Н, С і ін. Спочатку, коли хімічна природа вітамінів була ще недостатньо вивчена, їх назвали початковими буквами латинського алфавіту. У цей час ці позначення заміняють назвами хімічних сполук. Так, наприклад, вітамін С називають аскорбіновою кислотою, РР – нікотиновою кислотою, В2 – рибофлавіном і т.д. Крім того, існують назви вітамінів, які дані по їхній здатності запобігати те або інше захворювання, що виникає при їхній відсутності або недоліку. Звичайно до назви захворювання додають приставку анти: антирахітичний, антицинготний, антиневритний і т.д.
Органічні кислоти широко поширені в рослинному світі, вони містяться у всіх рослинах і часто накопичуються у великих кількостях у насінні, стеблах, листках, корінні або плодах. Органічні кислоти утворюються в результаті багатьох процесів обміну речовин у рослинах, серед яких основним варто вважати дихання.
Органічні кислоти беруть участь у побудові молекул ряду складних речовин – жирів, похідні цукру, вітамінів і інших біологічно активних сполук. У рослинах кислоти перебувають у вільному стані, а також у вигляді кислих і нейтральних солей. У багатьох плодах і ягодах більша частина припадає на вільні кислоти й лише незначну кількість представлено солями. У деяких рослинах (наприклад: щавлю, бегонії, сукулентах) багато вільних кислот міститься й у листках. У зв'язаному стані органічні кислоти виявлені у великих кількостях у листках бобових рослин, де на їхню частку може припадати до 25 % сухої речовини.
Питання для самоконтролю:
1. Як утворюються білки в рослині?
2. Яку відіграють роль ферменти у реакції рослини на зовнішні умови?
3. В чому схожість та відмінність між вітамінами і ферментами?
4. Як регулюється активність ферментів в рослині?
5. Яка відмінність в фізико-хімічних властивостях між полісахаридами першого та другого порядків?
Література: 1, 2, 4, 5, 6, 9.
