
TMS / Лекция_12
.pdf12 РАСТВОРИМОСТЬ КИСЛОРОДА, АЗОТА И ВОДОРОДА В ЖЕЛЕЗЕ. ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ПРОЦЕССОВ РАСКИСЛЕНИЯ И ДЕГАЗАЦИИ МЕТАЛЛА
12.1 Растворимость кислорода в железе
Экспериментально установленная зависимость между содержанием рас-
творенного в железе кислорода и величиной парциального давления кислорода в газовой фазе над металлом показана на рисунке 12.1.
Анализ рисунка 12.1 позволяет выделить две характерные области, в пре-
делах которых вид зависимости между содержанием растворенного в железе кислорода и парциальным давлением его над металлом существенно различает-
ся.
В области малых парциальных давлений кислорода концентрация его в железе является линейной функцией от квадратного корня из парциального давления кислорода в газовой фазе. По мере увеличения парциального давле-
ния кислорода над металлом содержание его в железе достигает некоторого максимального для данной температуры значения и в дальнейшем сохраняется на неизменном уровне. Такой характер зависимости обусловлен тем, что в мо-
мент, когда парциальное давление кислорода над расплавом становится выше упругости диссоциации FeO, на поверхности жидкого железа образуется ок-
сидная пленка. Поэтому в дальнейшем концентрация растворенного в железе кислорода определяется протеканием реакции
(FeO) = Fe + [O] |
(12.1) |
и не зависит от величины парциального давления кислорода в газовой фазе над металлом.
Чтобы различать растворимость кислорода в железе в двухфазной облас-
ти и концентрацию его металле в равновесии с оксидом, последнюю обычно называют пределом растворимости.
Рассмотрим особенности термодинамики реакций растворения кислорода

2
в железе в каждой из названных областей. В области малых парциальных дав-
лений кислорода концентрация газа в железе линейно увеличивается с ростом квадратного корня из парциального давления кислорода в газовой фазе. Эта за-
висимость, которую принято называть законом Сивертса, выполняется в тех случаях, когда молекулы двухатомных газов в процессе растворения диссоции-
руют на отдельные атомы. Следовательно, растворение газообразного кислоро-
да в жидком железе может быть описано уравнением реакции
0,5{O2 } = [O] , |
(12.2) |
константа равновесия которой определятся из выражения
K = fo[O] . (12.3)
P
O2
Для случая, когда коэффициент активности растворенного в железе кислорода равен единице, из уравнения (12.3) зависимость между содержанием кислорода в металле и парциальным давлением его в газовой фазе над расплавом может быть получена в виде
[O] = K |
|
. |
(12.4) |
P |
|||
|
O2 |
|
|
В области повышенных концентраций кислорода в железе наблюдается некоторое отклонение экспериментальных зависимостей от прямых, отражаю-
щих закон Сивертса. Это свидетельствует о том, что по мере увеличения кон-
центрации растворенного в металле кислорода коэффициент активности его снижается. Количественно эта зависимость может быть описана при помощи уравнения
lg fo = − 0,2[%O] . |
(12.5) |
Согласно результатам термодинамических исследований стандартное значение изменения энергии Гиббса реакции (12.2) может быть получено из уравнения
ΔG o = −117200 − 2,89T Дж/моль. |
(12.6) |
Из уравнения (12.6) формула для расчета константы равновесия реакции (12.2)

|
|
|
|
|
|
|
|
|
|
3 |
может быть получена в виде |
|
|
|
|
|
|
|
|
|
|
lg K = |
lg |
f |
o |
[O] |
= |
6120 |
+ 0,151 . |
(12.7) |
||
|
|
|
|
|||||||
|
|
|
|
|
T |
|||||
|
P |
|||||||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
O2 |
|
|
|
|
|
Анализируя уравнение (12.6), следует обратить внимание на то, что рас-
творение газообразного кислорода в жидком железе является сильной экзотер-
мической реакцией. Следовательно, согласно уравнению изобары Вант Гоффа,
с ростом температуры растворимость кислорода в железе при прочих равных условиях будет уменьшаться.
При высоких парциальных давлениях кислорода в газовой фазе на по-
верхности жидкого железа появляется оксидная пленка. В этих условиях кон-
центрация кислорода в металле определяется протеканием реакции (12.1) и за-
висит только от температуры. Константа равновесия реакции (12.1) может быть записана в виде
K = |
a[O] |
. |
(12.8) |
a(FeO)
Если значения коэффициентов активности растворенного в железе кислорода и оксида железа в шлаке близки к единице, выражение (12.8) может быть приве-
дено к виду
K = [O]max , |
(12.9) |
где [O]max – концентрация кислорода в металле в равновесии со шлаком из чистого FeO, %.
Результаты экспериментальных исследований влияния температуры на содержание кислорода в железе в равновесии со шлаком из чистого FeO пока-
заны на рисунке 12.2. Анализируя эти данные, следует обратить внимание на то, что с ростом температуры предел растворимости кислорода в металле быст-
ро увеличивается. Это свидетельствует о том, что растворение кислорода в ме-
талле из оксида железа в шлаке является сильной эндотермической реакцией.
Обработка приведенных на рисунке 12.2 результатов экспериментального исследования показывает, что они могут быть описаны зависимостью
|
|
|
4 |
|
lg [O]max = |
− 6320 |
+ 2,734 . |
(12.10) |
|
T |
||||
|
|
|
Из уравнения (12.10) выражение для определения стандартного значения изме-
нения энергии Гиббса при протекании реакции (12.1) может быть получено в виде
G o = 121000 − 52,38T Дж/моль. |
(12.11) |
Если в качестве коэффициента распределения кислорода между металлом и шлаком принять отношение активности FeO в шлаке к концентрации раство-
ренного в металле кислорода, то для определения его численного значения мо-
жет быть использована зависимость
lg Lo |
= |
lg |
a(FeO) |
= |
6320 |
− 2,734 . |
(12.12) |
|
[%O] |
T |
|||||||
|
|
|
|
|
|
Расчеты по уравнению (12.12) показывают, что при температурах заключитель-
ного периода плавки значения коэффициента распределения кислорода между шлаком и металлом изменяются в пределах 4 – 5.
12.2 Растворимость азота и водорода в железе
Экспериментально установлено, что растворимость азота и водорода в железе подчиняется закону Сивертса, согласно которому концентрация раство-
ренного в металле азота пропорциональна квадратному корню из величины парциального давления его в газовой фазе над металлом. Известно, что такой характер зависимости наблюдается в тех случаях, когда растворение газа в же-
лезе сопровождается диссоциацией его двухатомных молекул на отдельные атомы.
Исходя из этой зависимости, реакции растворения азота и водорода в жидком железе можно записать в виде
0,5{N2 } |
= |
[N] , |
(12.13) |
0,5{H 2 } |
= |
[H] . |
(12.14) |
Влияние температуры на величину констант равновесия реакции (12.13) и

5
(12.14) может быть описано при помощи уравнений
lg K |
|
= |
− |
770 |
|
− |
0,95 , |
(12.15) |
|||
N |
T |
||||||||||
|
|
|
|
|
|
|
|
||||
lg K |
|
|
= |
− |
1907 |
− |
1,59 . |
(12.16) |
|||
H |
|
||||||||||
|
|
|
|
T |
|
|
|
||||
Из уравнений (12.15) м (12.16) выражения для расчета стандартного зна-
чения изменения энергии Гиббса при протекании реакции (12.13) и (12.14) мо-
гут быть получено в виде
Go |
= |
14749 |
+ |
18,2T Дж/моль , |
(12.17) |
N |
|
|
|
|
|
Go |
= |
36528 |
+ |
30,5T Дж/моль . |
(12.18) |
H |
|
|
|
|
|
Из уравнений (12.17) и (12.18) видно, что реакции растворения азота и
водорода в жидком железе являются эндотермическими. Поэтому повышение температуры приводит к увеличению растворимости газов в металле.
Расчеты по уравнениям (12.15) и (12.16) показывают, что при 1600оС и парциальном давлении газов равном 105 Па растворимость азота и водорода в железе составляет соответственно 0,044 и 0,0025%. Следовательно, при этой температуре зависимость между концентрацией азота и водорода в железе и
парциальным давлением газов над металлом может быть описана уравнениями
|
= |
|
|
|
|
|
|
|
[N] |
0,044 PN2 |
, |
(12.19) |
|||||
|
= |
|
|
|
, |
(12.20) |
||
[H] |
0,0025 PH2 |
|||||||
где [N] и [H] - концентрации азота и водорода в железе, %; PN2 |
и PH2 |
|||||||
-парциальные давления азота и водорода в газовой фазе ×10-5, Па.
Внаучно-технической литературе данные о концентрации водорода в стали часто приводятся также в см3/100 г металла (0,0001% = 1,14 см3/100 г).
При использовании этих единиц уравнение (12.20) будет иметь вид
[H] = 28,5 |
|
. |
(12.21) |
PH2 |
6
12.3. Термодинамическая оценка возможной глубины дегазации металла при вакуумной обработке
Из уравнения Сивертса следует, что понижение содержания азота и водо-
рода в стали может быть достигнуто путем уменьшения их парциального дав-
ления в контактирующей с металлом газовой фазе. Технически эта задача мо-
жет быть реализована при обработке стали в вакууме или при продувке ее ней-
тральным газом (химическое вакуумирование).
Определение возможной глубины дегазации металла при вакуумной об-
работке проводят, сравнивая расчетные значения равновесного парциального давления газа над расплавом с величиной остаточного давления в вакуумной камере. В случаях, когда расчетная величина равновесного парциального дав-
ления газа над металлом превышает давление в вакуумной камере, дегазация металла считается возможной.
Результаты расчета равновесных парциальных давлений кислорода, азота и водорода в газовой фазе при различном содержании газов в железе показаны на рисунке 12.3. Штриховкой на рисунке отмечена область остаточных давле-
ний, которые могут быть получены в промышленных вакуумных камерах.
Из рисунка видно, что при вакуумировании расплавов железа в промыш-
ленных условиях возможно глубокое рафинирование металла от водорода, ос-
таточное содержание которого может быть получено равным 0,0001% и менее.
Условия удаления азота менее благоприятны и не позволяют понизить концентрацию его в металле менее 0,001%.
Удаление кислорода из расплава в газовую фазу в молекулярной форме не возможно, так как при любой его концентрации равновесное парциальное давление газа над расплавом на несколько порядков меньше остаточного дав-
ления в вакуумных камерах.
7
12.4 Основные способы раскисления металла
Для понижения концентрации растворенного в металле кислорода в про-
мышленных условиях чаще других используют следующие три различающихся по принципу удаления кислорода из металла способа раскисления: осаждаю-
щее, экстракционное (диффузионное) и вакуумно-углеродное.
Осаждающее раскисление заключается в том, что основную часть раство-
ренного в металле кислорода переводят в нерастворимые оксиды элементов-
раскислителей, которые вводят непосредственно в жидкий металл. Плотность абсолютного большинства оксидов меньше плотности жидкой стали, поэтому они всплывают из металла и частично удаляются в шлак.
Этот способ раскисления стали получил наиболее широкое распростра-
нение главным образом благодаря простоте его реализации. Главным его не-
достатком является то, что за время отстаивания ковша из металла всплывают только наиболее крупные неметаллические включения. Значительная часть об-
разовавшихся при раскислении неметаллических включений остается в стали вплоть до ее затвердевания.
Экстракционное раскисление состоит в том, что металл выдерживают в контакте со шлаком, содержание оксидов железа в котором во много раз мень-
ше, чем в шлаке периода окислительного рафинирования. При этом по мере приближения системы к состоянию равновесия концентрация кислорода в ме-
талле уменьшается, приближаясь к равновесной с новым раскислительным шлаком. Этот процесс протекает путем диффузионного переноса части кисло-
рода из металла в шлак, поэтому этот способ обработки называют также диф-
фузионным раскислением.
Преимущество экстракционного раскисления перед осаждающим состоит в том, что металл не загрязняется продуктами раскисления. Однако этот способ обработки требует дополнительного расхода шлакообразующих материалов,
энергии и значительно увеличивает продолжительность плавки.
Вакуумно-углеродное раскисление основано на смещении равновесия ре-
8
акции
[C] + [O] = {CO} |
(12.22) |
в направлении образования дополнительного количества оксида углерода при понижении парциального давления СО в продуктах реакции.
Главным преимуществом вакуумно-углеродного раскисления является то,
что газообразные продукты реакций полностью удаляются из металла. Однако реализация этого способа обработки связана с необходимостью наличия доста-
точно сложного и дорогостоящего оборудования.
12.5 Дегазация металла при продувке инертным газом
При продувке стали инертным газом парциальное давление азота и водо-
рода в пузырьках газа в момент образования их в металле близко к нулю. По-
этому в процессе удаления пузырей из расплава растворенные в стали газы
диффундируют в объем пузырей и выносятся ими в атмосферу.
Для приблизительной оценки расхода нейтрального газа на дегазацию стали может быть использована формула Геллера. При выводе этой зависимо-
сти сделано допущение, согласно которому за время пребывания пузырей в ме-
талле между расплавом и газовой фазой достигается состояние термодинамиче-
ского равновесия. Поэтому формула позволяет теоретически оценить мини-
мально необходимый расход нейтрального газа для дегазации стали. Если в ре-
альных процессах за время пребывания пузырей в металле равновесное состоя-
ние не достигается, необходимое для дегазации стали количество нейтрального
газа изменяется только в сторону увеличения.
Ниже приведен вывод формулы Геллера для случая, когда продувка про-
водится с целью удаления из металла водорода. Общее давление удаляющейся из металла смеси газов P состоит из суммы парциальных давлений водорода
PH2 и аргона PAr , поэтому
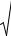
|
|
|
|
|
|
|
9 |
|
|
dVH2 |
= |
PH2 |
, |
(12.23) |
|
|
|
|
|
||||
|
|
dV Ar |
P − |
PH2 |
|
|
|
где VH |
- объем выделяющегося из металла водорода, м3/т; V Ar - объем |
||||||
|
2 |
|
|
|
|
|
|
продуваемого через металл аргона, м3/т.
Объемное количество удаленного из металла водорода VH2 связано с
приведенной в массовых процентах концентрацией водорода в стали соотно-
шением
dVH |
= − |
224 |
d[H] , |
(12.24) |
|
M |
|
||||
|
2 |
|
H2 |
|
|
|
|
|
|
|
|
где M H2 - относительная молекулярная масса удаляемого газа.
Если за время движения пузырей газа в стали распределение водорода между металлом и газовой фазой достигает состояния равновесия, зависимость между концентрацией газа в стали и парциальным давлением его в удаляющих-
ся из расплава пузырях описывается уравнением Сивертса
|
|
[H ] = |
|
|
|
, |
|
|
( 12.25) |
|||||
|
|
K H |
PH2 |
|
|
|||||||||
Подставляя зависимости (12.24) и (12.25) в (12.23), получим |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= − |
224 |
|
|
P |
|
|
|
− |
|
= |
|||
|
|
|
|
|
|
|
||||||||
dVAr |
|
|
|
|
d[H] |
|
|
|
|
|
1 |
|||
|
M |
H |
|
P |
|
|
|
|||||||
|
|
|
|
2 |
|
|
H |
2 |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|||
= − |
224 |
|
2 |
d[H] |
− |
|
|
|||
PK |
d[H] . |
(12.26) |
||||||||
|
|
|
|
|||||||
|
M |
|
|
H |
[H] |
2 |
|
|
|
|
|
|
H2 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||||
Интегрирование уравнения (12.26) позволяет получить зависимость для оценки необходимого на обработку количества аргона в виде
|
|
= |
224 |
|
2 |
|
1 |
− |
1 |
|
V |
|
PK |
||||||||
Ar |
M |
|
[H] |
[H] |
||||||
|
|
|
|
H |
|
|
||||
|
|
|
|
H2 |
|
|
|
|
|
o |
|
|
|
|
|
|
|
|
|
|
|
|
+ |
([H] − [H] |
|
|
) , (12.27) |
||
|
|
o |
|
|
|
|
|
где [H]o - исходная концентрация водорода в стали, %.
10
Результаты проведенного в соответствии с уравнением (12.27) расчета количества необходимого для дегазации металла аргона показаны на рисунке
12.4.
Анализ приведенных на рисунке данных показывает, что для получения в стали остаточного содержания водорода менее 2 см3/100 г необходим расход аргона 1,5 – 2 м3/т. На практике при продувке стали инертным газом с целью усреднения химического состава и температуры, а также интенсификации пе-
ремешивания металла с ковшевым шлаком удельный расход аргона обычно со-
ставляет 0,05 – 0,2 м3/т. В связи с этим продувка стали аргоном в открытых ковшах обычно не сопровождается существенной дегазацией металла.
Анализ уравнения (12.27) свидетельствует также о том, что необходимое для дегазации металла количество аргона быстро уменьшается, по мере умень-
шения давления над поверхностью расплава. В связи с этим сочетание продув-
ки стали инертным газом и вакуумной обработки может быть весьма эффектив-
ным средством дегазации металла.
