
TMS / Лекция_2
.pdf
2 ОСНОВЫ КИНЕТИКИ МЕТАЛЛУРГИЧЕКИХ РЕАКЦИЙ
2.1 Лимитирующее звено химической реакции
Обычно химические реакции являются результатом последовательного протекания большого количества отдельных их звеньев, связанных с массопе- реносом реагентов в объеме взаимодействующих фаз к месту протекания реак- ции, адсорбцией и десорбцией их на межфазных поверхностях, химическим взаимодействием атомов или молекул участвующих в реакции веществ, массо- переносом продуктов взаимодействия и др.
Из условия стационарности перемещения вещества уравнение, которое связывает суммарную скорость химической реакции со скоростью отдельных ее звеньев, может быть получено в виде
1 |
= |
1 |
+ |
1 |
+ ...+ |
1 |
, |
(2.1) |
|
|
|
|
|||||
vΣ |
|
v1 |
v2 |
vn |
|
|
||
где vΣ – суммарная скорость химической реакции; v1, v2 , vn – скорости отдельных звеньев реакции.
Согласно уравнению (2.1) обратная скорость химической реакции равна сумме обратных скоростей отдельных ее звеньев.
Анализ уравнения (2.1) показывает, что суммарная скорость химической реакции всегда меньше скорости наиболее медленного ее звена.
При соизмеримой скорости отдельных звеньев химической реакции рез- кое уменьшение скорости какого-либо ее звена приводит к аналогичному уменьшению суммарной скорости реакции. Допустим, например, что в первом из звеньев процесс практически прекратится ( v1 → 0 ). Тогда 1 v1 → ∞ и
vΣ → 0 , то есть прекратится и реакция в целом.
Однако в тех же условиях резкое увеличение скорости одного из звеньев реакции не может вызвать аналогичного роста суммарной ее скорости. Так, на-
2
пример, при v1 → ∞ и 1 v1 → 0 скорость химической реакции по-прежнему оп-
ределяется скоростью наиболее медленных ее звеньев.
Если скорость одного из звеньев реакции намного (в 100 раз и более) меньше скорости других ее звеньев, остальными слагаемыми в правой части уравнения (2.1) с достаточной точностью можно пренебречь и считать, что суммарная скорость реакции определяется скоростью наиболее медленного ее звена. Это звено, определяющее скорость реакции в целом, принято называть лимитирующим звеном химической реакции.
Одной из главных задач при изучении кинетики металлургических реак- ций обычно является определение их лимитирующего звена, воздействуя на ко- торое можно добиться значительного роста скорости процесса.
2.2 Порядок химической реакции
С точки зрения формальной кинетики порядком химической реакции на- зывают сумму показателей степени при концентрациях взаимодействующих веществ в ее кинетическом уравнении. Так, например, для реакции
aA + bB = dD + eE |
(2.2) |
скорости прямой и обратной реакций определяются из уравнений
v |
= |
k × C a |
× Cb |
, |
(2.3) |
|||
|
1 |
|
|
1 |
A |
B |
|
|
v |
2 |
= |
k |
2 |
× C d |
× C e . |
(2.4) |
|
|
|
|
D |
E |
|
|
||
При этом формально определяемый порядок прямой реакции будет равен сум- ме коэффициентов a и b, а обратной реакции – сумме коэффициентов d и e.
На практике определение порядка химической реакции по сумме стехио- метрических коэффициентов в ее уравнении не представляется возможным. Это связано с тем, что реакции, уравнения которых записываются с участием боль- шого количества молекул или атомов взаимодействующих веществ, обычно яв- ляются результатом последовательного протекания нескольких частных реак- ций, в каждой из которых участвует значительно меньшее количество частиц.
3
По этой причине истинный порядок химической реакции определяется только на основании экспериментальных данных, характеризующих кинетику изучаемого процесса. С этой целью экспериментально полученные зависимости сравнивают с известными решениями кинетических уравнений реакций нулево- го, первого, второго и более высоких порядков. Если характер теоретической и экспериментальной зависимостей совпадает, порядок химической реакции счи- тается установленным.
Кинетическое уравнение реакции нулевого порядка может быть записано в виде
− |
dC |
|
= |
kC 0 = |
k , |
(2.5) |
|
dτ |
|||||||
|
|
|
|
|
|||
где τ – время, с. |
|
|
|
|
|||
Решением уравнения (2.5) является зависимость |
|
||||||
|
C |
= |
Co − kτ |
, |
(2.6) |
||
где Co – постоянная интегрирования, численно равная концентрации ве-
щества в момент начала реакции.
Из уравнения (2.6) видно, что решение кинетического уравнения реакции нулевого порядка в координатах С – τ представляет собой линейную зависи- мость.
Чтобы установить, описывается ли реальный процесс кинетическим уравнением реакции нулевого порядка, необходимо провести эксперименталь- ное исследование его кинетики и обработать полученные данные в координатах С – τ. Если при этом будет установлен линейный характер изменения концен- трации вещества во времени, можно утверждать, что ход процесса описывается кинетическим уравнением реакции нулевого порядка. Если экспериментально полученная зависимость отличается от линейной, следует сделать вывод, что кинетическое уравнение реакции нулевого порядка кинетику рассматриваемого процесса не описывает. В этом случае чтобы установить порядок реакции необ- ходимо сравнить экспериментальные данные с решениями кинетических урав- нений реакций первого, второго и более высоких порядков.
|
|
|
|
|
4 |
|
Кинетическое уравнение реакции первого порядка имеет вид |
|
|||||
− |
dC |
|
= |
kC . |
(2.7) |
|
dτ |
||||||
|
|
|
|
|||
Решением уравнения (2.7) является зависимость |
|
|||||
C = |
C |
e−kτ , |
(2.8) |
|||
|
|
|
o |
|
|
|
которая представляет собой линейную функцию в координатах ln C − τ .
Если при обработке экспериментальных данных в координатах ln C − τ будет установлен линейный характер зависимости, можно утверждать, что про- цесс описывается кинетическим уравнением реакции первого порядка. Если экспериментально установленная зависимость отличается от линейной, следует сделать вывод, что кинетическое уравнение реакции первого порядка кинетику рассматриваемого процесса не описывает. В этом случае необходимо продол- жить сравнение экспериментальных данных с известными решениями кинети- ческих уравнений реакций более высоких порядков до тех пор, пока порядок реакции не будет установлен.
В некоторых случаях порядок химической реакции определяют на осно- вании зависимости
τ0,5 |
= |
|
k |
, |
(2.9) |
C |
n−1 |
||||
|
|
|
|
|
где τ0,5 – время полупревращения, которое необходимо для уменьшения
концентрации вещества в два раза;
n – показатель степени, численно равный порядку реакции.
При этом экспериментально установленный порядок химической реакции может оказаться дробной величиной. Если причиной этого не являются ошибки при сборе и обработке экспериментальных данных, дробный порядок химиче- ской реакции позволяет сделать один из следующих выводов:
-процесс протекает по нескольким параллельным направлениям с образова- нием одних и тех же продуктов взаимодействия;
-в исследованном интервале концентраций взаимодействующих веществ ме- ханизм реакций изменяется.
5
-используемая в расчетах аналитически определяемая концентрация вещества отличается от истинной его концентрации.
2.3Способы определения лимитирующего звена химической реакции
При исследовании реальных металлургических процессов установить ли- митирующее звено реакции можно следующими способами.
1. По порядку химической реакции.
Если экспериментально установленный порядок химической реакции от- личается от первого, с большой вероятностью можно говорить о протекании ее в кинетической области.
При первом порядке реакции сделать окончательный вывод о ее лимити- рующем звене не представляется возможным, так как кинетическое уравнение реакции первого порядка в равной мере может описывать процессы, протекаю- щие как в кинетической, так и в диффузионной области. В этом случае для оп- ределения лимитирующего звена реакции требуется дополнительная информа- ция, например, сведения о величине энергии активации реакции.
При повышении температуры и неизменных концентрациях взаимодейст- вующих веществ скорость химической реакции увеличивается. Зависимость константы скорости реакции от температуры описывается уравнением Арре- ниуса
d ln k |
= |
E |
|
, |
(2.10) |
dT |
RT |
2 |
|||
|
|
|
|
|
где Е – энергия активации химической реакции, Дж/моль.
Из уравнения (2.10) можно получить формулу, которая позволяет опреде- лить численное значение энергии активации химической реакции по известным величинам констант скорости реакции при различных температурах
k |
2 |
|
|
|
|
1 |
|
1 |
|
|
||
|
|
|
= |
E |
− |
|
|
|||||
ln |
|
|
|
|
|
|
|
. |
(2.11) |
|||
k |
R |
T |
T |
|||||||||
|
|
1 |
|
|
|
|
1 |
|
2 |
|
|
|
6
Найденную таким способом величину энергии активации сравнивают с энергиями активации хорошо изученных реакций, лимитирующее звено кото- рых точно установлено. Например, для реакций, лимитирующим звеном кото- рых является диффузия реагентов в жидком металле, величина энергии актива- ции обычно находится в пределах 40 – 170 кДж/моль, для реакций, протекаю- щих в кинетической области, – свыше 420 кДж/моль и т.д.
2. По виду кинетической кривой.
Определение лимитирующего звена реакции по виду кинетической кри- вой выполняется в следующей последовательности:
–мысленно выделяют те звенья реакции, которые в данных условиях мо- гут выступать в роли лимитирующих;
–для каждого из выделенных звеньев аналитическим путем получают за- висимости, которые описывают характер изменения концентрации взаимодей- ствующих веществ во времени или связь между параметрами технологического процесса;
–проводят экспериментальное исследование кинетики реакции;
–сравнивают характер аналитических и экспериментально установлен- ной зависимостей. Если характер теоретической и экспериментальной зависи- мостей совпадает, лимитирующее звено реакции считается установленным.
Рассмотрим пример определения таким способом лимитирующего звена реакции растворения газообразного азота в жидком железе.
Реакция поглощения азота жидким металлом включает следующие наи- более очевидные звенья: внешнюю диффузию – массоотдачу азота в газовой фазе к поверхности жидкого металла; химико-адсорбционное звено, которое включает диссоциацию двухатомных молекул азота на отдельные атомы, ад- сорбцию и десорбцию азота на межфазной поверхности; внутреннюю диффу- зию – массоотдачу азота от поверхности раздела газ-металл в объем расплава.
Ввиду высокой скорости диффузии азота в газовой фазе первое из пере- численных выше звеньев наиболее медленным звеном процесса, скорее всего, не является.
7
Допустим, что лимитирующим звеном реакции является диссоциация мо- лекул азота на атомы и адсорбция последних на поверхности металла. В этом случае изменение концентрации растворенного в железе азота описывается уравнением
d[N] |
= k P |
− k |
|
[N] 2 |
, |
(2.12) |
|
dτ |
2 |
||||||
1 |
|
|
|
|
где [N] – концентрация растворенного в металле азота; Р – парциальное давление азота в газовой фазе;
k1 и k2 – константы скорости прямой и обратной реакций.
После некоторых преобразований решение уравнения (2.12) можно полу- чить в виде
|
[N] p + [N] |
+ |
|
[N] p − [N]o |
= |
|
k |
|
|
|
||
ln |
|
ln |
|
2 |
|
1 |
[N] |
p |
τ , |
(2.13) |
||
[N] p − [N] |
[N] p + [N]o |
K |
|
|||||||||
|
|
|
|
|
N |
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||
где [N]p – равновесная концентрация азота в железе при заданной вели-
чине парциального давления газа над металлом; [N]o – исходная концентрация азота в железе;
KN – константа равновесия химической реакции.
При неизменных значениях температуры и парциального давления азота в газовой фазе константа скорости и константа равновесия реакции, а также равновесное содержание азота в железе являются постоянными величинами. Поэтому, если лимитирующим звеном реакции является химико-адсорбционное звено, выражение в левой части уравнения (2.13) должно быть линейной функ- цией продолжительности взаимодействия.
Если лимитирующим звеном реакции является массоотдача азота в жид- ком железе, изменение концентрации растворенного в металле азота описыва- ется уравнением
d[N] |
= |
βF |
([N] |
p |
− [N] ) , |
(2.14) |
dτ |
|
|||||
|
M |
|
|
|||
|
|
|
|
|||
где β – коэффициент массопереноса азота в жидком металле; F – площадь поверхности раздела металл-газ;

|
|
|
|
|
8 |
|
М – масса металлического расплава. |
|
|
|
|||
Решение уравнения (2.14) имеет вид |
|
|
|
|
||
ln |
[N] p − [N]o |
= |
βF |
τ . |
(2.15) |
|
[N] p − [N] |
M |
|||||
|
|
|
|
|||
При неизменной температуре коэффициент массопереноса азота в железе является постоянной величиной. Поэтому, если лимитирующим звеном реак- ции является массоотдача азота в жидком металле, выражение в левой части уравнения (2.15) также является линейной функцией продолжительности взаи-
модействия. |
|
|
|
|
|
||||
|
|
Имея |
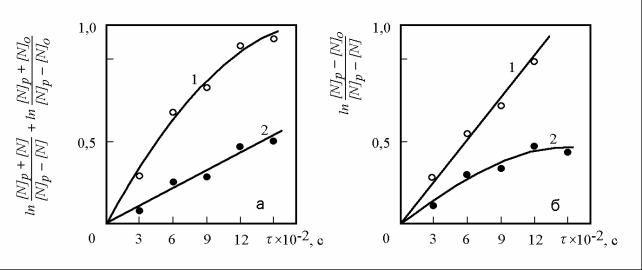
экспериментальные данные, строим зависимость величины |
||||||
ln |
[N] p + [N] |
+ ln |
[N] p − [N]o |
от продолжительности взаимодействия (рисунок |
|||||
[N] |
p |
− [N] |
[N] |
p |
+ [N] |
||||
|
|
|
|||||||
|
|
|
|
|
o |
|
|||
2.1а). Если в результате обработки экспериментальных данных будет установ- лен линейный характер зависимости (прямая 2 на рисунке 2.1а), можно утвер- ждать, что лимитирующим звеном реакции растворения азота в жидком железе является химико-адсорбционное звено.
Если характер аналитической и экспериментально установленной зави- симостей не совпадает (кривая 1 на рисунке 2.1а), нет оснований предполагать, что скорость растворения азота в жидком железе ограничена химико- адсорбционным звеном этой реакции. В этом случае, продолжая поиск лимити- рующего звена реакции, обрабатываем экспериментальные данные в координа-
[N] p − [N]o |
− τ (рисунок 2.1б). |
тах ln [N] p − [N] |
При этом, если в результате обработки экспериментальных данных будет установлен линейный характер зависимости (прямая 1 на рисунке 2.1б), можно утверждать, что лимитирующим звеном реакции растворения азота в жидком железе является массоотдача азота в объем расплава.
Если и в этом случае характер аналитической и экспериментальной зави- симостей не совпадает (кривая 2 на рисунке 2.1б), можно предполагать, что
9
скорость реакции ограничена каким-то из звеньев, которое в ходе проведенного анализа нами не учитывалось.
3. По характеру влияния перемешивания, а также скорости потока газа или жидкости на кинетику изучаемого процесса.
Зависимость скорости реакции от интенсивности перемешивания, а также скорости потока жидкости или газа в большинстве случаев является доказа- тельством того, что скорость реакции ограничена внешней диффузией.
4. По наличию градиентов концентрации взаимодействующих ве-
ществ у поверхности раздела фаз.
Отсутствие градиентов концентрации участвующих в реакции веществ у межфазной поверхности указывает на то, что реакция протекает в кинетической области. Наличие градиента концентраций в одной из взаимодействующих фаз указывает на диффузионный характер процесса.
5. По характеру зависимости скорости химической реакции от тем-
пературы.
Повышение температуры сопровождается ростом скорости химических реакций, которые протекают как в кинетической, так и в диффузионной облас- ти. Но при этом скорость реакций, протекающих в кинетической области, при повышении температуры быстро увеличивается. При протекании реакции в диффузионной области влияние температуры на скорость реакции менее значи- тельно.
6. По характеру зависимости между количеством прореагировавшего вещества и продолжительностью взаимодействия.
Экспериментально установленная пропорциональность количества про- реагировавшего вещества корню квадратному из продолжительности взаимо-
действия ( q = kτ0,5 ) свидетельствует о протекании реакции в диффузионной области.
10
а – адсорбционно-кинетический режим; б – диффузионный режим Рисунок 2.1 – Сравнение характера аналитических и экспериментально уста-
новленных зависимостей при определении лимитирующего зве- на химической реакции по виду кинетической кривой.
