
TMS / Лекция_13
.pdf13 ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ДЕСУЛЬФУРАЦИИ
РАСПЛАВОВ ЖЕЛЕЗА ШЛАКОМ
13.1Термодинамическая оценка возможности окислительной десульфурации металла
Обладая переменной валентностью, серы при взаимодействии с кислоро-
дом образует несколько газообразных соединений, наиболее устойчивым из ко-
торых при температурах сталеплавильных процессов является SO2 .
Удаление серы из сталеплавильной ванны может протекать в результате взаимодействия с растворенным в металле кислородом
[S] |
+ 2[O] |
= |
{SO2 } , |
(13.1) |
а также в результате окисления оксидами железа шлака |
|
|||
(S) + |
2(FeO) = |
2Fe |
+ {SO2 } . |
(13.2) |
Обе эти реакции могут протекать, например, на поверхности всплывающих в металле пузырей оксида углерода.
Температурную зависимость константы равновесия реакции (13.1) опи-
сывает уравнение
lg K = lg |
PSO |
= − |
204 |
− 2,8 . |
|
|
2 |
(13.3) |
|||||
2 |
T |
|||||
|
|
|
|
|||
|
a[S] × a[O] |
|
|
|
|
Из уравнения (13.3) видно, что реакция (13.1) является слабой эндотермической реакцией. Поэтому изменение температуры не приведет к резкому изменению константы равновесия реакции. Среднее значение константы равновесия реак-
ции (13.1) для температур сталеплавильной ванны можно принять равным
1,1×10-3.
Приравняв активности серы и кислорода в металле их концентрациям,
можно оценить величину равновесного парциального давления SO2 в газовой
фазе. Приняв среднее содержание серы в металле равным 0,04%, а кислорода
0,02%, получим
PSO2 = K[S][O]2 = 1,1×10−3 × 0,04 × 0,022 ≈ 2 ×10− 8 атм( 2 ×10− 3 Па) .
Аналогичные расчеты показывают, что для реакции (13.2) величина рав-
новесного парциального давления SO2 в газовой фазе составляет около 1 Па.
Эти парциальные давления настолько незначительны, что за время плавки в ре-
зультате протекания реакций (13.1) и (13.2) удалить из металла значительное количество серы не удается. Результаты исследований разных авторов показы-
вают, что в кислородных конвертерах и мартеновских печах, отапливаемых чистым по сере топливом, количество окисленной серы не превышает 5 – 10%
от исходного ее содержания в металлической шихте. Основное количество серы удаляется из металла в результате протекания других типов реакций, не связан-
ных с окислением.
Крайне низкие значения равновесного парциального давления SO2 в га-
зовой фазе для реакций (13.1) и (13.2) создают предпосылки для протекания ре-
акций в направлении поглощения металлом серы из газовой фазы. Это наблю-
дается, например, при использовании для отопления мартеновских печей высо-
косернистого топлива (мазут, коксовальный газ).
Поглощение серы металлом из газовой фазы может наблюдаться и в ат-
мосфере крупных промышленных городов. Опыт работы электросталеплавиль-
ных цехов свидетельствует, что при использовании в завалке большого количе-
ства легковесного заржавленного металлического лома следует ожидать повы-
шенного содержания серы в металле после расплавления.
13.2 Распределение серы между шлаком и металлом
Растворимость серы в шлаке в значительной степени зависит от окисли-
тельного потенциала системы, который может быть охарактеризован величиной равновесного парциального давления кислорода. Из рисунка 13.1 видно, что

значительная растворимость серы в шлаке может наблюдаться при равновес-
ных парциальных давлениях кислорода менее 10-6 и более 10-3 атм. Такой ха-
рактер зависимости объясняется возможностью присутствия серы в шлаке в ви-
де двух типов химических соединений. При высокой окисленности системы се-
ры имеет валентность +6 и присутствует в шлаке в форме сульфатов ( MeSO4 ).
При малых значениях равновесного парциального давления кислорода серы имеет валентность –2 и находится в шлаке в виде сульфатов ( MeS ). При темпе-
ратуре 1600оС упругость диссоциации FeO составляет менее 10-8 атм. Поэтому следует ожидать, что в условиях сталеплавильных процессов сера присутствует в шлаке в сульфидной форме.
Когда система металл – шлак – газ находится в состоянии термодинами-
ческого равновесия, химические потенциалы серы в каждой из взаимодейст-
вующих фаз выравниваются. В этих условиях растворимость серы в шлаке не зависит от того, поступает ли она в шлак из металла или из газовой фазы. Од-
нако, с точки зрения организации эксперимента значительно проще изучать распределение серы между металлом и газовой фазой.
Реакция распределения серы между шлаком и газовой фазой в общем случае может быть записана в виде
|
0,5{S2 } |
|
+ (MeO) |
= |
0,5{O2 } |
+ (MeS) . |
|
|
(13.4) |
|||||||||
Константа равновесия реакции (13.4) определяется из выражения |
|
|||||||||||||||||
|
|
|
× |
|
|
|
|
|
|
|
|
× M |
|
× (%S)× |
|
|
|
|
|
|
a |
|
P |
|
f |
|
|
P |
|
||||||||
K = |
|
(MeS) |
|
|
|
O2 |
|
= |
|
(MeS) |
|
MeS |
|
|
O2 |
. |
(13.5) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
a(MeO) × |
|
|
|
|
|
M S × a(MeO) × PS2 |
|||||||||||
|
|
|
|
PS2 |
|
|
|
|
|
|||||||||
С учетом того, что при невысоких концентрациях серы в шлаке величина ко-
эффициента активности сульфида и активность оксида металла практически не зависят от содержания серы, уравнение (13.5) можно привести к виду
|
|
|
(%S)× P0,5 |
|
|
|
K |
' |
= |
|
O2 |
= CS . |
(13.6) |
|
|
P0,5 |
||||
|
|
|
|
S2 |
|
|
Величину CS принято называть сульфидной емкостью шлака.
В настоящее время результаты экспериментальных исследований раство-
римости серы в шлаке принято приводить в форме зависимости сульфидной емкости шлака от температуры и мольной концентрации основного оксида. Од-
на из таких диаграмм показана на рисунке 13.2. Анализ диаграммы показывает,
что при повышении температуры сульфидная ёмкость шлаков увеличивается.
Следовательно, реакция десульфурации металла шлаком является эндотерми-
ческой.
Следует также обратить внимание на высокие значения сульфидной ем-
кости шлаков системы MnO − SiO2 , а также основных мартеновских шлаков и чистого FeO . Высокая сульфидная емкость этих шлаков не является свидетель-
ством более высокой их десульфурирующей способности в сравнении со шла-
ками системы CaO − SiO2 . Величина CS включает равновесное парциальное
давление кислорода, а его значение в области, в которой могут существовать шлаки с высоким содержанием MnO и FeO , довольно велико.
Таким образом, распределение серы между шлаком и металлом является результатом протекания реакций
[S] |
+ |
(CaO) |
= |
(CaS) |
+ |
[O] , |
(13.7) |
[S] |
+ |
(MgO) |
= |
(MgS) |
+ |
[O] , |
(13.8) |
[S] |
+ |
(MnO) |
= |
(MnS) |
+ |
[O] . |
(13.9) |
При низких температурах начального периода плавки и малой основности шла-
ка FeO также может рассматриваться как основной оксид. Поэтому может также иметь место реакция
[S] + (FeO) = (FeS) + [O] . |
(13.10) |
Результаты исследований показывают, что при десульфурации металла высоко-
основным шлаком основное количество серы присутствует в шлаке в форме сульфида кальция. Поэтому при анализе условий десульфурации металла шла-
ком обычно ограничиваются анализом условий протекания реакции (13.7) для которой
lg K = |
− 5693 |
+ 1,528 . |
(13.11) |
|
T |
||||
|
|
|
Из уравнения (13.11) следует, что реакция (13.7) является сильной эндо-
термической реакцией, протеканию которой в направлении образования суль-
фида кальция должны способствовать высокие температуры заключительного периода плавки. Кроме того, образованию сульфида кальция по реакции (13.7)
будет способствовать высокая основность шлака, малая активность (CaS) и
растворенного в металле кислорода.
Чтобы проанализировать влияние окисленности шлака на величину ко-
эффициента распределения серы между шлаком и металлом реакцию (13.7) не-
обходимо записать в виде
[S] + Fe + (CaO) = (CaS) + (FeO) . |
(13.12) |
|||||||||||||||
Константа равновесия реакции (13.12) определяется из выражения |
|
|||||||||||||||
|
|
K |
= |
|
a(CaS) × a(FeO) |
. |
|
(13.13) |
||||||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
a[S] × a(CaO) |
|
|
|||||||||
С учетом соотношения |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
a |
|
= |
M CaS |
f |
|
|
|
(S) |
|
(13.14) |
|||||
|
|
|
|
|
|
|
||||||||||
|
(CaS) |
|
|
M S |
|
|
(CaS) |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
из уравнения (13.13) получим |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
(S) |
|
= |
M S |
|
K |
|
f S |
|
× |
a(CaO) |
. |
(13.15) |
|||
|
[S] |
M |
|
|
f |
CaS |
a |
|||||||||
|
|
|
|
|
CaS |
|
|
|
(FeO) |
|
|
|||||
Из уравнения (13.15) следует. Что для достижения высоких значений коэффи-
циента распределения серы между шлаком и металлом необходима высокая ос-
новность шлака и низкая его окисленность. В качестве примера на рисунке 13.3
приведены данные о влиянии содержания (FeO) на величину коэффициента распределения серы между шлаком и металлом.
При высокой основности шлака наибольшие значения коэффициентов распределения серы достигаются в условиях доменной плавки. При содержании
(FeO) 0,1 – 0,2% коэффициент распределения серы может достигать 100 и бо-
лее.
Достаточно высокие для эффективной десульфурации металла значения коэффициентов распределения серы могут быть получены при содержании
(FeO)до 1,0 –1,5% в восстановительном периоде электроплавки.
В мартеновском и кислородно-конвертерном процессах, а также в окис-
лительном периоде плавки в дуговых электросталеплавильных печах, значения коэффициентов распределения серы минимальны и обычно не превышают 10.
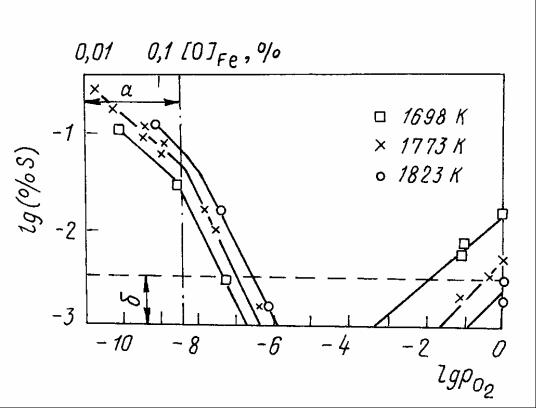
а – область P при которых кислород находится в растворе (не образует
O2
оксидов); б – область малой точности анализа
Рисунок 13.1 – Растворимость серы в шлаке, содержащем 37% CaO , 27%
Al2O3 и 36% SiO2 , в условиях равновесия с газовой смесью 10%SO2 + H 2 +
+ CO + 50%N |
|
при различных величинах P |
и P |
2 |
2 |
O2 |
S2 |
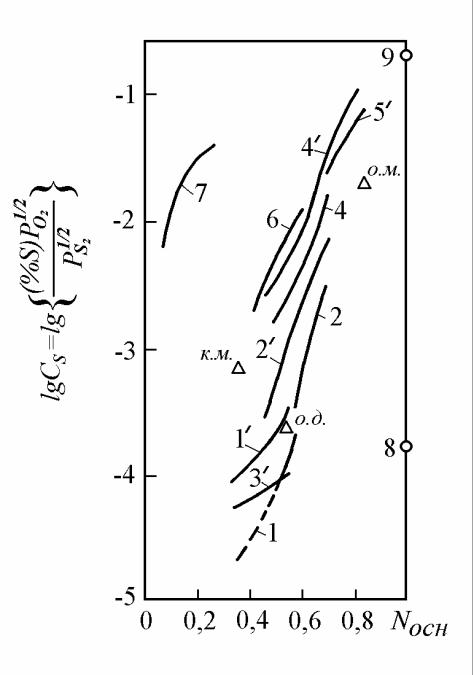
1 – (CaO + SiO2 ) , t =1500оС; 1’ – (CaO + SiO2 ) , t =1650оС;
2 – (CaO + Al2O3 ) , t =1500оС; 2’ – (CaO + Al2O3 ) , t =1650оС; 3’ – (MgO + SiO2 ) , t =1650оС; 4 – (MnO + SiO2 ) , t =1500оС; 4’ – (MnO + SiO2 ) , t =1650оС; 5’ – (MnO + Al2O3 ) , t =1650оС;
6 – (CaO + Al2O3 + CaF2 ) , t =1500оС; 7 – (CaO + CaF2 ) , t =1500оС;
8 – CaOт, t =1650оС; 9 – FeO , t =1550оС;
Рисунок 13.2 – Зависимость сульфидной емкости различных шлаков
от мольной доли основного оксида и температуры
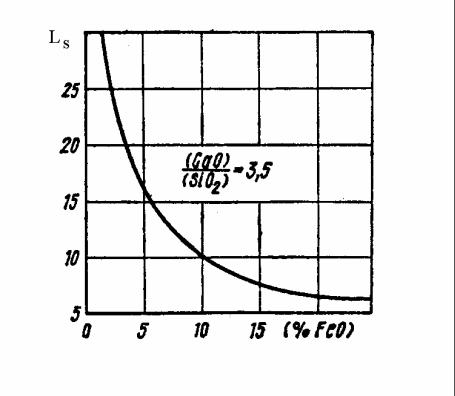
Рисунок 13.3 – Зависимость коэффициента распределения серы между шлаком
и металлом от содержания FeO в шлаке
