
TMS / Лекция_10
.pdf10 ТЕРМОДИНАМИЧЕСКИЕ ОСОБЕННОСТИ РЕАКЦИЙ ВОССТАНОВЛЕНИЯ ОКСИДОВ ЖЕЛЕЗА
Рассматривая данный вопрос необходимо помнить, что в зависимости от температуры восстановление оксидов железа представляет собой следующую последовательность превращений:
-при температурах выше 570оС Fe2O3 последовательно восстанавливается до
Fe3O4, FeO и металлического железа;
-при температурах менее 570оС Fe2O3 восстанавливается до Fe3O4, который затем восстанавливается до металлического железа.
10.1Косвенное восстановление оксидов железа
Реакции косвенного восстановления оксидов железа можно описать сле-
дующими уравнениями:
3Fe2O3 |
+ CO = 2Fe3O4 |
+ CO2 , |
||||||||
ΔG o |
|
= – 52310 – 41Т Дж/моль, |
||||||||
10.1 |
|
|
|
|
|
|
|
|
|
|
lg K10.1 |
= |
|
2731 |
+ 2,14 , |
||||||
|
|
T |
|
|||||||
Fe3O4 |
+ |
CO |
|
= 3FeO + |
CO2 , |
|||||
Go |
= 35380 – 40,16Т Дж/моль, |
|||||||||
10.4 |
|
|
|
|
|
|
|
|
|
|
lg K10.4 |
= |
−1847 |
+ 2,1 , |
|||||||
|
|
T |
||||||||
FeO |
+ CO |
= Fe |
+ CO2 , |
|||||||
Go |
= – 13160 + 17,21Т Дж/моль, |
|||||||||
10.7 |
|
|
|
|
|
|
|
|
|
|
lg K10.7 |
= |
687 |
|
|
− 0,898 , |
|||||
|
|
|
|
|||||||
|
|
T |
||||||||
(10.1)
(10.2)
(10.3)
(10.4)
(10.5)
(10.6)
(10.7)
(10.8)
(10.9)

|
|
|
|
|
|
|
|
|
|
|
|
2 |
1 |
Fe O |
+ CO |
= |
|
3 |
Fe |
+ CO |
, |
(10.10) |
|||
|
|
|||||||||||
4 |
3 |
4 |
|
|
|
|
|
4 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
G o |
= – 1030 + 2,96Т Дж/моль, |
|
(10.11) |
||||||||
|
10.10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
lg K10.10 |
= |
|
54 |
|
|
− |
0,154 . |
|
(10.12) |
|
|
|
|
T |
|
|
|||||||
Анализ приведенных выше уравнений позволяет сделать следующие вы-
воды:
-реакции (10.1), (10.7) и (10.10) являются экзотермическими. Поэтому при повышении температуры отношение (%СО2)/(%СО) в равновесной для этих реакций газовой фазе будет уменьшаться;
-реакция (10.4) является эндотермической. Поэтому при повышении темпера- туры отношение (%СО2)/(%СО) в равновесной газовой фазе этой реакции будет увеличиваться;
-тепловые эффекты всех рассматриваемых реакций не велики. Поэтому изме-
нение температуры не вызовет быстрого изменения состава равновесной га- зовой фазы.
Численные значения констант равновесия каждой из рассматриваемых реакций при различных температурах приведены в таблице 10.1.
Таблица 10.1 – Константы равновесия реакций косвенного восстановления оксидов железа при различных температурах
Температура, оС |
lg K |
lg K |
lg K |
lg K |
|
10.1 |
10.4 |
10.7 |
10.10 |
|
|
|
|
|
400 |
6,19 |
– |
– |
– 0,074 |
500 |
5,67 |
– |
– |
– 0,084 |
700 |
4,95 |
0,200 |
– 0,192 |
– |
900 |
4,46 |
0,525 |
– 0,312 |
– |
1100 |
4,13 |
0,754 |
– 0,398 |
– |
1300 |
3,88 |
0,926 |
– 0,461 |
– |
|
|
|
|
|
3
Из данных таблицы 10.1 видно, что в рассматриваемом интервале темпе- ратур константа равновесия реакции (10.1) имеет очень высокие значения. Это позволяет рассматривать реакцию (10.1) как практически необратимую.
Численные значения констант равновесия реакций (10.4), (10.7) и (10.10) изменяются от 0,3 до 10. Эти реакции являются полностью обратимыми в ши- роком интервале температур.
Влияние температуры на изменение состава равновесной газовой фазы для каждой из реакций косвенного восстановления оксидов железа показано сплошными линиями на рисунке 10.1.
На этом рисунке область ниже кривых 2 и 4 является полем устойчивости Fe3O4. Область между кривыми 2 и 3 является полем устойчивости FeO. Выше кривых 3 и 4 располагается поле устойчивости металлического железа. Поле устойчивости Fe2O3 очень ограничено и располагается ниже кривой 1.
10.2 Восстановление оксидов железа водородом
Реакции восстановления оксидов железа водородом можно описать сле- дующими уравнениями:
3Fe2O3 |
+ |
|
H 2 |
= 2Fe3O4 |
+ H 2O , |
(10.13) |
|||||
G o |
|
|
= – 15547 – 74,46Т Дж/моль, |
(10.14) |
|||||||
10.13 |
|
|
|
|
|
|
|
|
|
|
|
lg K10.13 |
= |
812 |
+ |
3,89 , |
(10.15) |
||||||
|
|
|
|||||||||
|
|
T |
|||||||||
Fe3O4 |
+ |
|
H 2 |
= |
|
|
3FeO |
+ H 2O , |
(10.16) |
||
Go |
|
= 71940 – 73,62Т Дж/моль, |
(10.17) |
||||||||
10.16 |
|
|
|
|
|
|
|
|
|
|
|
lg K10.16 |
= |
− 3756 |
+ |
3,84 , |
(10.18) |
||||||
|
T |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
FeO |
+ |
|
H 2 |
= |
Fe |
+ |
H 2O , |
(10.19) |
|||||||
|
Go |
= 23430 – 16,16Т Дж/моль, |
(10.20) |
|||||||||||||
|
10.19 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
lg K10.19 |
|
|
= |
|
−1223 |
+ |
0,844 , |
|
(10.21) |
||||||
|
|
|
|
T |
|
|
|
|
||||||||
1 |
Fe O |
+ |
|
H |
|
= |
|
3 |
Fe |
+ H |
|
O , |
(10.22) |
|||
|
|
2 |
|
2 |
||||||||||||
4 |
3 |
4 |
|
|
|
|
|
4 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
Go |
|
= 35550 – 30,4Т Дж/моль, |
(10.23) |
||||||||||||
|
|
10.22 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
lg K10.22 |
|
= |
−1856 |
+ |
1,59 . |
(10.24) |
|||||||||
|
|
|
T |
|||||||||||||
Анализ приведенных выше данных дает основания для следующих выво-
дов:
-среди реакций восстановления оксидов железа водородом только реакция (10.13) является экзотермической. С ростом температуры отношение (%Н2О)/(%Н2) в равновесной газовой фазе этой реакции будет уменьшаться;
-реакции (10.16), (10.19) и (10.22) являются эндотермическими. Поэтому с ростом температуры отношение (%Н2О)/(%Н2) в равновесной газовой фазе
этих реакций будет увеличивается.
Влияние температуры на изменение состава равновесной газовой фазы для каждой из реакций восстановления оксидов железа водородом показано на рисунке 10.1 пунктирными линиями.
Следует обратить внимание на то, что кривые, характеризующие составы равновесных газовых смесей для реакций восстановления оксидов железа окси- дом углерода и водородом, пересекаются при температуре 810оС. Из анализа реакции водяного газа известно, что при соблюдении условия
(%CO2 ) |
= |
(%H 2O) |
|
(%CO) |
(%H 2 ) |
||
|
оксид углерода и водород при этой температуре обладают одинаковым химиче- ским сродством к кислороду.
5
При температурах выше 810оС водород обладает большим химическим сродством к кислороду. Поэтому при восстановлении оксидов железа водоро- дом объемное содержание восстановителя в газовой фазе может быть меньше, чем при восстановлении оксидом углерода.
При температурах ниже 810оС более высоким химическим сродством к кислороду обладает оксид углерода.
10.3 Прямое восстановление оксидов железа
Реакции прямого восстановления оксидов железа
Fe3O4 |
+ |
C |
= |
3FeO + CO , |
(10.25) |
FeO |
+ |
C |
= |
Fe + CO |
(10.26) |
можно рассматривать как результат последовательного протекания реакций косвенного восстановления и последующего взаимодействия образовавшегося при этом превращении углекислого газа с углеродом.
Если реакции восстановления оксидов железа протекают с участием чис- тых веществ, температуры начала этих реакций можно определить из графика на рисунке 10.2.
Из рисунка видно, что при давлении 100 кПа температура начала восста- новления оксидов железа по реакциям (10.25) и (10.26) составляют соответст- венно 650 и 700оС.
При температурах менее 650оС обе реакции необратимо протекают в на- правлении окисления железа и FeO до Fe3O4. При температурах 650 – 700оС
железо окисляется, а Fe3O4 восстанавливается до FeO. При температурах выше
700оС Fe3O4 и FeO восстанавливаются до металлического железа.
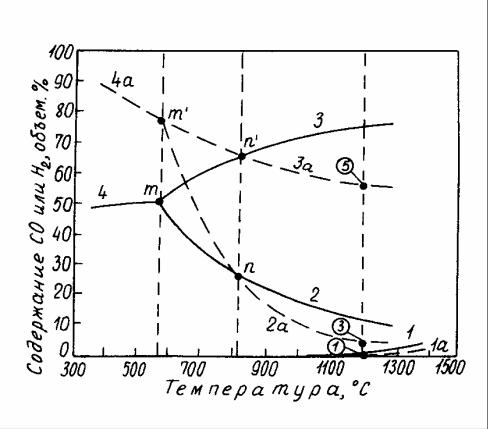
6
1 – для реакции (10.1); 2 – (10.4); 3 – (10.7); 4 – (10.10);
1а – (10.13); 2а – (10.16); 3а – (10.19); 4а – (10.22)
Рисунок 10.1 – Зависимость состава равновесной газовой фазы от температуры в реакциях восстановления оксидов железа оксидом углерода (сплошные линии) и водородом (пунктирные линии)

7
Рисунок 10.2 – Температуры начала реакций прямого восстановления оксидов железа при давлении 100 кПа
