
- •Збірник задач
- •Передмова
- •Робоча програма дисципліни «Фізика»
- •Як правильно оформляти задачі і контрольну роботу в цілому?
- •Київський національний Університет Будівництва і архітектури Кафедра фізики
- •Модуль 1 «Механіка»
- •1.1. Короткий теоретичний довідник до модуля 1.
- •1.2. Задачі до модуля 1
- •Модуль 2 «Молекулярна фізика»
- •2.1. Короткий теоретичний довідник до модуля 2
- •2.2. Задачі до модуля 2
- •Модуль 3 «Електрика та магнетизм»
- •3.1. Короткий теоретичний довідник до модуля 3
- •3.2. Задачі до модуля 3
- •Модуль 4 «Коливальні та хвильові процеси, оптика»
- •4.1. Короткий теоретичний довідник до модуля 4
- •4.1.А. Короткий теоретичний довідник до теми «Геометрична оптика»
- •4.2. Задачі до модуля 4
- •4.2.А. Задачі до теми «Геометрична оптика»
- •Модуль 5 «Основи квантової фізики та фізики ядра»
- •5.1. Короткий теоретичний довідник до модуля 5
- •5.2. Задачі до модуля 5
- •Список літератури
- •Основні одиниці Міжнародної системи (сі)
- •Основні фізичні сталі
- •Деякі позасистемні величини
- •Деякі співвідношення між фізичними величинами
- •Деякі астрономічні величини
- •Властивості деяких твердих тіл
- •Властивості деяких рідин
- •Густина газів (за нормальних умов), кг/м3
- •Густина (середня насипна) деяких будівельних матеріалів, кг/м3
- •Густина деяких речовин і матеріалів, кг/м3
- •Пружні властивості деяких твердих тіл
- •Модуль Юнга деяких матеріалів, Гпа
- •Границя міцності деяких матеріалів, Гпа
- •Залежність відносних долей молекул за розподілом Максвела від відносної швидкості
- •Залежність долі молекул, швидкості яких перевищують задане значення відносної швидкості
- •Питома теплота згоряння деяких видів палива, мДж/кг
- •Питома теплота плавлення і температура плавлення деяких речовин, металів та сплавів (за нормального атмосферного тиску)
- •Температурний коефіцієнт лінійного розширення деяких речовин
- •Питома теплота пароутворення води при різних температурах
- •Критичні значення температури та тиску для деяких речовин
- •Діелектрична проникність деяких речовин
- •Робота виходу електронів з металів
- •Маса і енергія спокою деяких частинок
- •Маса деяких нуклідів, а.О.М.
- •Енергія іонізації
- •Десяткові префікси до назв одиниць
- •Графік залежності коефіцієнта поглинання -випромінювання від енергії падаючого кванта для різних речовин
Модуль 2 «Молекулярна фізика»
2.1. Короткий теоретичний довідник до модуля 2
Рівняння стану
ідеального газу в молекулярно кінетичній
теорії речовини має вигляд:
![]() де
де![]() – середня кінетична енергія поступального
руху однієї молекули;
– середня кінетична енергія поступального
руху однієї молекули;![]() – концентрація молекул,
– концентрація молекул,![]() – число молекул, які знаходяться в
об’ємі
– число молекул, які знаходяться в
об’ємі![]() газу,
газу,![]() – густина газу,
– густина газу,![]() – молярна маса газу,
– молярна маса газу,![]() моль–1
– число Авогадро.
моль–1
– число Авогадро.
У термодинаміці
рівняння стану ідеального газу встановлено
Мендєлєєвим – Клапейроном на основі
експериментальних законів Бойля-Маріотта,
Гей-Люссака, Шарля та Авогадро:
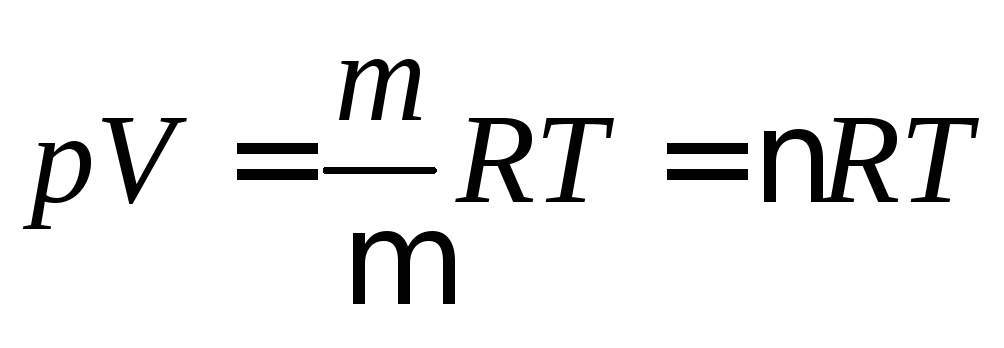 ,
де
,
де![]() – маса газу,
– маса газу,![]() – молярна маса газу,
– молярна маса газу,![]() дж/моль·К – універсальна газова стала,
дж/моль·К – універсальна газова стала,![]() –
кількість речовини,
–
кількість речовини,![]() – термодинамічна температура. У
найкоротшій формі рівняння Мендєлєєва
– Клапейрона можна подати як:
– термодинамічна температура. У
найкоротшій формі рівняння Мендєлєєва
– Клапейрона можна подати як:![]() ,
деk=R/NA
– стала
Больцмана.
,
деk=R/NA
– стала
Больцмана.
Порівняння двох
рівнянь стану дає для ідеального газу
середню кінетична енергія молекули:
![]() .
У реальних газів з багатоатомними
молекулами повна середня енергія кожної
молекули
.
У реальних газів з багатоатомними
молекулами повна середня енергія кожної
молекули![]() ,
де
,
де
![]() – кількість ступенів вільності молекули.
У одноатомних молекул i=3,
двохатомних –
i=5+2iкол
, трьох- і більше атомних i=6+2iкол.
– кількість ступенів вільності молекули.
У одноатомних молекул i=3,
двохатомних –
i=5+2iкол
, трьох- і більше атомних i=6+2iкол.
У молекулярній
фізиці використовується як поняття
маси речовини, так і кількості речовини,
яка вимірюється кількістю молів. Один
моль дорівнює такій кількості речовини,
яка містить стільки ж структурних
елементів (NA),
скільки міститься атомів в ізотопі
вуглецю
![]() масою
0,012 кг. Кількість молей речовини
масою
0,012 кг. Кількість молей речовини![]() .
Кількість молей речовини суміші:
.
Кількість молей речовини суміші:![]() ,
де
,
де![]() – кількість речовиниі-го
компонента суміші. Для суміші газів це
автоматично переходить в закон Дальтона,
який визначає тиск суміші газів:
– кількість речовиниі-го
компонента суміші. Для суміші газів це
автоматично переходить в закон Дальтона,
який визначає тиск суміші газів:
![]() де
де![]() –
парціальний тиск компонентів суміші.
–
парціальний тиск компонентів суміші.
Молекулярно-кінетичний
підхід до молекулярних явищ дає можливість
визначити: середню
довжину вільного пробігу молекул:
![]() ,
де
,
де
![]() –
ефективний діаметр молекули;
–
ефективний діаметр молекули;
![]() –
концентрація молекул; розподіл
молекул за швидкостями (розподіл
Максвелла):
–
концентрація молекул; розподіл
молекул за швидкостями (розподіл
Максвелла):
![]() ,
де
,
де![]() –
функція розподілу, яка дозволяє визначити
долю молекул
–
функція розподілу, яка дозволяє визначити
долю молекул![]() від усіх молекул
від усіх молекул![]() ,
швидкість яких лежить в інтервалі від
,
швидкість яких лежить в інтервалі від![]() до
до![]() ;
;![]() – відносна швидкість,
– відносна швидкість,![]() – швидкість молекул,
– швидкість молекул,![]() – найбільш
імовірна швидкість молекул;
– найбільш
імовірна швидкість молекул;![]() – інтервал відносних швидкостей, малий
порівняно з самою швидкістю
– інтервал відносних швидкостей, малий
порівняно з самою швидкістю![]() .
З розподілу Максвелла можуть бути
визначені середньоквадратичнаυкв
.
З розподілу Максвелла можуть бути
визначені середньоквадратичнаυкв![]() та середньоарифметична
та середньоарифметична![]() швидкості молекул; розподіл молекул у
силовому полі (розподіл Больцмана)
швидкості молекул; розподіл молекул у
силовому полі (розподіл Больцмана)
![]() ,
деWп
– потенціальна енергія молекули. У
гравітаційному полі Землі це дає
барометричну формулу:
,
деWп
– потенціальна енергія молекули. У
гравітаційному полі Землі це дає
барометричну формулу:
![]() ,
де
,
де![]() – тиск на поверхні Землі,
– тиск на поверхні Землі,![]() – тиск на висоті
– тиск на висоті![]() .
.
Перше начало
термодинаміки є законом збереження
енергії в теплових процесах:
![]() ,
де Δ
,
де Δ![]() – кількість теплоти, надана системі,
– кількість теплоти, надана системі,![]() – зміна внутрішньої енергії системи;
– зміна внутрішньої енергії системи;![]() – робота, виконана системою проти
зовнішніх сил. Зміна внутрішньої енергії
ідеального газу:
– робота, виконана системою проти
зовнішніх сил. Зміна внутрішньої енергії
ідеального газу:![]() Робота розширення газу:
Робота розширення газу: .
Кількість теплоти Δ
.
Кількість теплоти Δ![]() визначають за молярними теплоємностями,
які при ізобаричному та ізохоричному
процесах у газах дорівнюють відповідно:
визначають за молярними теплоємностями,
які при ізобаричному та ізохоричному
процесах у газах дорівнюють відповідно:![]() та
та![]() і зв’язані рівнянням Майєра:
і зв’язані рівнянням Майєра:![]()
Ізопроцеси в газах.
Ізотермічний процес
![]() =const,
=const,
![]() =const
(закон Бойля–Маріотта):
=const
(закон Бойля–Маріотта):
![]() ,
,![]() ;
ізобарний процес
;
ізобарний процес![]() =const,
=const,
![]() =const
(закон Гей-Люссака):
=const
(закон Гей-Люссака):
![]()
![]() ;
ізохорний процес
;
ізохорний процес![]() =const,
=const,
![]() =const
(закон Шарля):
=const
(закон Шарля):
![]() ,
,![]() .
При адіабатичному процесі (
.
При адіабатичному процесі (![]() )
перше начало термодинаміки має вигляд:
)
перше начало термодинаміки має вигляд:![]() ,
а зв’язок параметрів ідеального газу
описуються рівняннями Пуассона:
,
а зв’язок параметрів ідеального газу
описуються рівняннями Пуассона:![]() ,
,![]() ,
,![]() ,
де
,
де![]() –
показник адіабати.
–
показник адіабати.
Зміст другого
начала термодинаміки виражає нерівність
Клаузіуса:
 ;
де
;
де![]() – зміна ентропії;
– зміна ентропії;![]() – кількість теплоти. Для ідеального
теплового двигуна термічний ККД
розраховують як:
– кількість теплоти. Для ідеального
теплового двигуна термічний ККД
розраховують як:![]() ,
де
,
де![]() – теплота, отримана робочим тілом від
нагрівача;
– теплота, отримана робочим тілом від
нагрівача;![]() – теплота, передана робочим тілом
холодильнику. Термічний ККД циклу Карно:
– теплота, передана робочим тілом
холодильнику. Термічний ККД циклу Карно:![]() де
де![]() і
і![]() – термодинамічні температури нагрівача
і холодильника.
– термодинамічні температури нагрівача
і холодильника.
Явища переносу в
молекулярній фізиці включають: дифузію
(закон Фіка):
![]() ,
де
,
де![]() –
маса речовини, яка переноситься за час
–
маса речовини, яка переноситься за час
![]() через площину
через площину![]() перпендикулярно їй;
перпендикулярно їй;
![]() –
градієнт густини;
–
градієнт густини;
![]() –
коефіцієнт дифузії;
теплопровідність (закон Фур’є)
–
коефіцієнт дифузії;
теплопровідність (закон Фур’є)
![]() ,
де
,
де![]() –
кількість теплоти, що переноситься час
–
кількість теплоти, що переноситься час
![]() через перпендикулярну площину
через перпендикулярну площину![]() ;
;
![]() –
градієнт температури;
–
градієнт температури;
![]() –
коефіцієнт дифузії; в’язкість або
внутрішнє
тертя
(закон Ньютона):
–
коефіцієнт дифузії; в’язкість або
внутрішнє
тертя
(закон Ньютона):
![]() ,
де
,
де![]() –
сила внутрішнього тертя;
–
сила внутрішнього тертя;
![]() –
градієнт швидкості течії газу в напрямку,
перпендикулярному до площини
–
градієнт швидкості течії газу в напрямку,
перпендикулярному до площини
![]() ;
;![]() –
коефіцієнт в’язкості.
–
коефіцієнт в’язкості.
Рівняння Ван дер
Ваальса описує стан реального газу і
має вигляд для одного моля (![]() ):
):![]() ,
де
,
де![]() та
та![]() – газові сталі, які пов’язані з критичними
параметрами газу:
– газові сталі, які пов’язані з критичними
параметрами газу:![]() ,
,![]() ,
де
,
де![]() - критична температура,
- критична температура,![]() – критичний тиск та
– критичний тиск та![]() – критичний об’єм.
– критичний об’єм.
Коефіцієнт
поверхневого натягу рідини:
![]() або
або![]() де
де![]() – сила поверхневого натягу, діюча на
контур довжиною
– сила поверхневого натягу, діюча на
контур довжиною![]() ,
обмежуючий поверхню рідини;
,
обмежуючий поверхню рідини;![]() – зміна вільної енергії рідини, пов’язана
зі зміною площі
– зміна вільної енергії рідини, пов’язана
зі зміною площі![]() поверхні. Формула Лапласа, яка виражає
додатковий тиск
поверхні. Формула Лапласа, яка виражає
додатковий тиск![]() ,
створений сферичною поверхнею рідини:
,
створений сферичною поверхнею рідини:![]()
![]() де
де![]() – радіус
сферичної поверхні. Висота підйому
рідини в капілярній трубці:
– радіус
сферичної поверхні. Висота підйому
рідини в капілярній трубці:
![]() де
де![]() – крайовий кут змочування (
– крайовий кут змочування (![]() =
0 при повному змочуванні стінок трубки
рідиною;
=
0 при повному змочуванні стінок трубки
рідиною;![]() =
π при повному незмочуванні);
=
π при повному незмочуванні);![]() – радіус каналу трубки;
– радіус каналу трубки;![]() – густина рідини;
– густина рідини;![]() – прискорення вільного падіння. Висота
підйому рідини між двома близькими
паралельними одна одній площинами:
– прискорення вільного падіння. Висота
підйому рідини між двома близькими
паралельними одна одній площинами:![]() де
де![]() – відстань між площинами.
– відстань між площинами.![]()
При фазових
переходах в речовинах справедливе
рівняння Клапейрона-Клаузіуса:
![]() ,
де
,
де![]() – питома теплота фазового переходу,
– питома теплота фазового переходу,![]() – зміна питомого об’єму при фазовому
переході.
– зміна питомого об’єму при фазовому
переході.
