
- •34. Голоіні ознаки фізико-механічних та хімічних технологічних процесів хімічна технологія. Високотемпературні процеси в технології будівельних матеріалів.
- •36. Порошкова металургія. Які завдання виконує порошкова металургія? Основні етапи одержання виробів. Наведіть приклади.
- •37. Дайте характеристику властивостей порошкоподібних матеріалів: хімічні, фізичні, технологічні властивості. Назвіть завершальну стадію технології порошкової металургії.
- •Остаточна обробка виробів
- •Високий тиск
- •Роль каталізаторів виконують тверді, рідинні та газові речовини.
- •Залежно від агрегатного стану каталізатора та реагуючих речовин (сировини) каталізні процеси поділяють на:
- •Електрохімічні процеси Основні закономірності електрохімічних процесів Біохімічні процеси
- •Плазмові процеси
- •Фотохімічні процеси
- •Лазерні процеси
- •Ультразвукові процеси
- •39. Метали і сплави. Властивості металів. Чавун. Сталь. Кольорові метали і сплави на їх основі. Колір і твердість ювелірних виробів.
- •1.1 Сплави міді
- •2. Алюміній і його сплави
- •2.1 Деформуємі алюмінієві сплави
- •2.2 Ливарні алюмінієві сплави
- •3. Цинк і його сплави
- •4. Магній та його сплави
- •4.1 Сплави на основі магнію
- •40. Дисперсні системи. Суспензії. Структуроутворення в дисперсних системах. Реодогічні властивості. Наведіть приклади суспензій.
- •Властивості суспензії
- •41. Кам’яне вугілля. Хімічний склад, продукти переробки, їх застосування.
- •42. Нафта. Склад, технологія і продукти переробки. Загальна характеристика і сфери застосування.
- •43. Каталітичні хіміко-технологічні процеси. Дати визначення. Застосування каталітичних процесів у промисловості: виробництво сірчаної кислоти, аміаку у процесі нафтопереробки.
- •44. Термічні процеси у виробництві непродовольчих товарів. Високотемпературні процеси у виробництві будівельних матеріалів: стадії виробництва порт ланд цементу, стадії виробництва керамічних виробів.
40. Дисперсні системи. Суспензії. Структуроутворення в дисперсних системах. Реодогічні властивості. Наведіть приклади суспензій.
Систему, в якій дрібні частинки однієї або кількох речовин (дисперсної фази) рівномірно розподілені між частинками іншої (дисперсійного середовища), називають дисперсною. Процес подрібнення речовини називають диспергуванням. Залежно від розмірів частинок дисперсної фази системи поділяють на гомогенні та гетерогенні. ^ Якщо диспергована речовина не має поверхні поділу із дисперсійним середовищем, то таку систему називають гомогенною. До таких систем належать істинні розчини (молекулярно–іонні системи). Розміри молекул і йонів менші за 1∙10–9 м, тобто співмірні з молекулами розчинника, тому такі системи є гомогенними, термодинамічно стійкими, і до них поняття дисперсності не поширюється. Система, в якій частинки диспергованої речовини мають розмір більший за 1∙10–9 м і складають окрему фазу щодо диспесійного середовища, єгетерогенною. Саме гетерогенність є однією з характерних ознак дисперсних систем. Наявність міжфазової поверхні поділу спричинює особливу роль поверхневих явищ у характеристиці дисперсних систем. Другою загальною ознакою будь-якої дисперсної системи є ступінь подрібнення частинок дисперсної фази або ступінь дисперсності. Дисперсність (D) – це величина, обернена розміру частинки диспергованої речовини (d або l):
![]() де d –
діаметр частинки кулястої форми; l –
довжина ребра частинки кубічної форми.
Отже, чим менший розмір частинок, тим
більша дисперсність системи.
Із
зменшенням розміру частинок збільшується
їх питома поверхня. Питома
поверхня (Sum) –
це міжфазова поверхня (Sсум )
одиниці об'єму (V) або
маси (т)
дисперсної
фази:
де d –
діаметр частинки кулястої форми; l –
довжина ребра частинки кубічної форми.
Отже, чим менший розмір частинок, тим
більша дисперсність системи.
Із
зменшенням розміру частинок збільшується
їх питома поверхня. Питома
поверхня (Sum) –
це міжфазова поверхня (Sсум )
одиниці об'єму (V) або
маси (т)
дисперсної
фази:
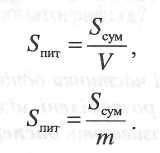 За
великої поверхні дисперсних систем
існує значний запас вільної поверхневої
енергії G .
Із термодинаміки відомо, що самочинно
відбуваються процеси, які ведуть до
зменшення запасу вільної енергії
(ізобарного потенціалу) (∆G < 0). Тому
системи з великим запасом енергії
Гіббса термодинамічно
нестійкі і
прагнуть до зменшення міжфазової
поверхні шляхом агрегації (укрупнення)
частинок дисперсної фази. Таким чином,
дисперсні системи характеризуються
лише відносною
агрегативною стійкістю.
За
великої поверхні дисперсних систем
існує значний запас вільної поверхневої
енергії G .
Із термодинаміки відомо, що самочинно
відбуваються процеси, які ведуть до
зменшення запасу вільної енергії
(ізобарного потенціалу) (∆G < 0). Тому
системи з великим запасом енергії
Гіббса термодинамічно
нестійкі і
прагнуть до зменшення міжфазової
поверхні шляхом агрегації (укрупнення)
частинок дисперсної фази. Таким чином,
дисперсні системи характеризуються
лише відносною
агрегативною стійкістю.
2. КЛАСИФІКАЦІЯ ТА ЗАГАЛЬНІ ВЛАСТИВОСТІ ДИСПЕРСНИХ СИСТЕМ Дисперсні системи класифікують за такими ознаками:
за характером дисперсності;
за ступенем дисперсності (або за розмірами частинок дисперсної фази);
за агрегатним станом дисперсної фази і дисперсійного середовища;
за характером взаємодії між частинками дисперсної фази і дисперсійним середовищем:
за характером взаємодії між частинками дисперсної фази;
за формою частинок дисперсної фази (за топографічною ознакою).
1. За характером дисперсності. Дисперсні системи поділяють на монодисперсні, в яких всі частинки дисперсної фази мають однаковий ступінь дисперсності і полідисперсні. в яких частинки дисперсної фази мають різний ступінь дисперсності. Якщо останні системи є реальними, то монодисперсні - науковою абстракцією. 2. За ступенем дисперсності. Залежно від розмірів частинок дисперсної фази дисперсні системи поділяють на такі типи: 1) колоїдно-дисперсні або ультрамікрогетерогенні (високодисперсні) а= 10–9– 10–7м; 2) мікрогетерогенні (середньої дисперсності) а = 10–7–10–4м; 3) грубодисперсні а > 10–4м. Колоїдний стан характеризується певним ступенем подрібнення матерії і його може набути за відповідних умов будь-яка речовина. Навіть таку класичну кристалічну речовину, як натрій хлорид, можна перевести в колоїдний стан у середовищі бензену. Розміри частинок високодисперсних систем мають бактерії (d= (0,1–30)∙10–6 м), віруси (d= (10–350)∙10–9 м), частинки диму (d= (30–40)∙10–9 м), пори вугілля(d= (1–10)∙10–9 м), пори біологічних мембран (d= (0,35–0,8)∙10–9 м) тощо. В 1 см3 крові міститься близько 5 млн еритроцитів (їх розмір дорівнює приблизно 7∙10–6 м). Якщо вважати, що загальний об'єм крові в організмі людини складає 5 дм3, то у всьому об'ємі крові, що циркулює в тілі, міститься 25 трильйонів еритроцитів і їх загальна поверхня досягає 3500 м2, що перевищує площу поверхні тіла приблизно у 2000 разів. Завдяки такій великій загальній поверхні еритроцити ефективно виконують свої фізіологічні функції. У високодиспергованому стані речовина набуває особливих властивостей. Наприклад, цукор, борошно, вугілля у вигляді пилу, маючи велику поверхню контакту з киснем, можуть вибухнути. Саме тому лікарські речовини в колоїдному стані (наприклад, у вигляді аерозолю) часто виявляють кращу лікувальну дію, забезпечуючи великий контакт діючої речовини з ураженою поверхнею. 3. За агрегатним станом дисперсної фази і дисперсійного середовища. Залежно від агрегатного стану дисперсної фази і дисперсійного середовища (газоподібний – Г; рідкий – Р; твердий – Т) можна виділити 9 типів дисперсних систем (табл. 1). Звичайно систему скорочено записують у вигляді дробу, в якому чисельник вказує на агрегатний стан дисперсної фази, а знаменник –дисперсійного середовища.
Таблиця 1 Класифікація дисперсних систем за агрегатним станом дисперсної фази і дисперсійного середовища
 Необхідною
умовою утворення дисперсної системи є
обмежена розчинність речовини дисперсної
фази у дисперсійному середовищі. Гази
характеризуються повною взаємною
розчинністю, тобто відсутністю поверхні
поділу, тому дисперсні системи
типу Г/Г практично
не утворюються. Лише атмосфера Землі
може бути прикладом такої нестійкої
системи, що утворюється за рахунок
флуктуації густини повітряних мас.
Золі
з газоподібним дисперсійним середовищем
називають аерозолями; з
рідким – ліозолями або
просто золями; з
твердим – солідозолями. У
свою чергу, ліозолі поділяють на: гідрозолі,
етерозолі, алкозолі, бензозолі тощо,
у яких дисперсійним середовищем
відповідно є вода, ефір (діетиловий
етер), спирт, бензен.
Необхідною
умовою утворення дисперсної системи є
обмежена розчинність речовини дисперсної
фази у дисперсійному середовищі. Гази
характеризуються повною взаємною
розчинністю, тобто відсутністю поверхні
поділу, тому дисперсні системи
типу Г/Г практично
не утворюються. Лише атмосфера Землі
може бути прикладом такої нестійкої
системи, що утворюється за рахунок
флуктуації густини повітряних мас.
Золі
з газоподібним дисперсійним середовищем
називають аерозолями; з
рідким – ліозолями або
просто золями; з
твердим – солідозолями. У
свою чергу, ліозолі поділяють на: гідрозолі,
етерозолі, алкозолі, бензозолі тощо,
у яких дисперсійним середовищем
відповідно є вода, ефір (діетиловий
етер), спирт, бензен.
Дисперсні системи з рідким або газоподібним дисперсійним середовищем, у якому частинки дисперсної фази можуть вільно переміщуватись, називаютьвільнодисперсними (емульсії, суспензії, ліозолі, аерозолі). Системи з твердим дисперсійним середовищем, у якому частинки дисперсної фази не можуть вільно переміщуватись, називають зв'язанодисперсними(капілярно-поруваті тіла, полімерні плівки, гелі і драглі, тверді розчини). 4. 3а характером взаємодії між частинками дисперсної фази і дисперсійним середовищем (міжфазна взаємодія). Якщо частинки дисперсної фази змочуються дисперсійним середовищем, такі системи називають ліофільними (від грецького phileo – любов). Дисперсні системи, в яких частинки дисперсної фази не змочуються дисперсійним середовищем, називають ліофобними (від грецького phobos – страх).
Ліофобними є системи, в яких спорідненість дисперсної фази і дисперсійного середовища мала, а тому сили міжмолекулярної взаємодії на межі поділу фаз слабкі. Такі системи термодинамічно нестійкі і вимагають спеціальних методів стабілізації. До них належить більшість дисперсних систем – ліозолі, аерозолі, емульсії, піни. Ліофобні золі (у випадку води – гідрофобні) називають власне колоїдними розчинами. До них належать гідрозолі золота, срібла, ферум гідроксиду, аргентум хлориду тощо. Стійкість таких систем зумовлена, головним чином, однойменним зарядом частинок золю. Ліофобні системи називаютьміцелярними або суспензоїдами. Ліофільними є системи, які характеризуються інтенсивною взаємодією речовин фази і середовища з утворенням сольватних (гідратних, у випадку води) оболонок із молекул дисперсійного середовища навколо частинок дисперсної фази. Тому такі системи утворюються самочинно і є термодинамічно стійкими, гомогенними. До них належать розчини високомолекулярних сполук, основними структурними одиницями яких є сильно гідратовані макромолекули ВМС. Прикладом таких систем є розчини білків, нуклеїнових кислот, мил, деяких глин, танінів, алкалоїдів у воді, каучуку в бензені, поліамідів у спирті тощо.
Розчини ВМС є, по суті, істинними молекулярними розчинами, проте відносно великі розміри макромолекул надають їм спільних властивостей із колоїдними системами. Тому розчини ВМС ще називають молекулярними колоїдами, на відміну від іншого класу – типових високодисперсних гетерогенних систем – суспензоїдів.
5. За характером взаємодії між самими частинками дисперсної. За цією ознакою дисперсні системи поділяються на вільнодисперсні безструктурні), в яких частинки дисперсної фази практично не контактують, з одною і вільно плавають в дисперсійному середовищі. З цього ясно, що за цієї ознакою можуть класифікуватись дисперсні системи з газовим або рідинним дисперсійним середовищем. Це аерозолі (дими, пил в газі, туман), і розбавлені ліозолі (розбавлені суспензії, емульсії, піни, колоїдні розчини). При високій концентрації частинок дисперсної фази, останні можуть контактувати між собою, утворюючи просторові каркаси, подібно до бджоляної вощини, комірки, якої заповнені медом. Такі системи називають структурнодисперсними або зв'язанодисперсними. До них відносяться гелі капілярно-пористі тіла типу активованого вугілля, силікагелю, мембрани тощо.
6.За формою частинок дисперсної фази (за топографічною ознакою) За цією ознакою всі дисперсні системи можна класифікувати на три класи:
а) Дисперсні системи, в яких частинки дисперсної фази володіють малими розмірами за трьома координатними напрямками (х, у, z), тобто частинки, які можна приблизно розглядати як сфери (кульки), кубики – і називають глобулярними.
б) Дисперсні системи, в яких частинки дисперсної фази можуть бути окремими листочками, лусочками, плівками, маючи за двома напрямкам великі розміри (довжину і ширину) і лише дуже малу товщину. Їх називають плівочними або пластинчастими (ламінарними) системами.
в) Дисперсні системи, в яких частинки дисперсної фази мають форм волокон, ниток, тобто характеризуються великою довжиною, але малою товщиною. Це волокнисті (фібрилярні системи). Суспензія (від пізньолат. suspensio - підвішування) (англ. suspension, нім. Suspension f, Trübe) — дисперсна система з рідкимдисперсійним середовищем та твердою диспергованою (дисперсною) фазою, частинки якої достатньо великі, щоб протидіятиброунівському руху.
Суспензія має властивостi неньютонiвської рiдини та наближається до властивостей в'язкопластичних середовищ. Як правило, частинки дисперсної фази С. мають розмір понад 10-4см і осідають (седиментують) під дією сили тяжіння. С., в якихседиментаціядуже повільна внаслідок малої різниці густини дисперсної фази і дисперсійного середовища, іноді називають зависами. У концентрованих С. легко виникають дисперсні структури. Типові С. – пульпи, бурові промивні рідини, цементні розчини.
Тонкорозмелене вугiлля з водою утворює водовугiльну суспензiю (ВВС), яка з точки зору теплоенергетики у бiльшостi випадкiв квалiфiкується як водовугільне паливо(ВВП).
Суспензії використовують у будівельній технології, виробництві лакофарбових матеріалів, паперу тощо.
Суспензія є окремим випадком дисперсних системі належить до класу "тверде тіло в рідині", прикладом яких є мул у воді. (Для порівняння: система "рідина в рідині" -емульсія, олія в воді; система "тверде тіло в газі",аерозоль- дим; система "рідина в газі",аерозоль- туман). Для твердої фази в суспензіях характерні розміри часток від 1 мкм до кількох міліметрів. При менших розмірах система зазвичай єколоїдним розчином(в граничному випадку - гомогенною системою, істинним розчином).
Мінеральна суспензія (водовугільна суспензія)– композиційна дисперсна система, яку утворено частинками твердого матеріалу у рідині (найчастіше воді), має властивості неньютонівської рідини та наближається до властивостей в’язкопластичого середовища.
