
- •34. Голоіні ознаки фізико-механічних та хімічних технологічних процесів хімічна технологія. Високотемпературні процеси в технології будівельних матеріалів.
- •36. Порошкова металургія. Які завдання виконує порошкова металургія? Основні етапи одержання виробів. Наведіть приклади.
- •37. Дайте характеристику властивостей порошкоподібних матеріалів: хімічні, фізичні, технологічні властивості. Назвіть завершальну стадію технології порошкової металургії.
- •Остаточна обробка виробів
- •Високий тиск
- •Роль каталізаторів виконують тверді, рідинні та газові речовини.
- •Залежно від агрегатного стану каталізатора та реагуючих речовин (сировини) каталізні процеси поділяють на:
- •Електрохімічні процеси Основні закономірності електрохімічних процесів Біохімічні процеси
- •Плазмові процеси
- •Фотохімічні процеси
- •Лазерні процеси
- •Ультразвукові процеси
- •39. Метали і сплави. Властивості металів. Чавун. Сталь. Кольорові метали і сплави на їх основі. Колір і твердість ювелірних виробів.
- •1.1 Сплави міді
- •2. Алюміній і його сплави
- •2.1 Деформуємі алюмінієві сплави
- •2.2 Ливарні алюмінієві сплави
- •3. Цинк і його сплави
- •4. Магній та його сплави
- •4.1 Сплави на основі магнію
- •40. Дисперсні системи. Суспензії. Структуроутворення в дисперсних системах. Реодогічні властивості. Наведіть приклади суспензій.
- •Властивості суспензії
- •41. Кам’яне вугілля. Хімічний склад, продукти переробки, їх застосування.
- •42. Нафта. Склад, технологія і продукти переробки. Загальна характеристика і сфери застосування.
- •43. Каталітичні хіміко-технологічні процеси. Дати визначення. Застосування каталітичних процесів у промисловості: виробництво сірчаної кислоти, аміаку у процесі нафтопереробки.
- •44. Термічні процеси у виробництві непродовольчих товарів. Високотемпературні процеси у виробництві будівельних матеріалів: стадії виробництва порт ланд цементу, стадії виробництва керамічних виробів.
34. Голоіні ознаки фізико-механічних та хімічних технологічних процесів хімічна технологія. Високотемпературні процеси в технології будівельних матеріалів.
Фізико-механічними називають такі технологічні процеси, в ході яких змінюються лише форма та фізико-механічні властивості сировини.
На цих процесах ґрунтується добувна промисловість (за винятком деяких геотехнологічних способів добування корисних копалин), деревообробна промисловість, виготовлення з конструкційних матеріалів виробів литтям, тиском, різанням тощо. Ці процеси лежать в основі підготовлення сировини до перероблення, а також в основі розділення отриманої продукції на основну і побічну та відходи.
До фізико-механічних процесів належать подрібнення, тепло- та масоперенесення.
Хімічними називають такі технологічні процеси, в ході яких змінюється хімічний склад і внутрішня будова речовини (сировини).
Ці зміни відбуваються внаслідок хімічних реакцій між складовими сировини. Унаслідок хімічних реакцій утворюється основна та побічна продукція, а також відходи. Утворення побічної продукції та відходів зумовлене наявністю у сировині домішок. Наприклад, у процесі виробництва чавуну відбуваються хімічні реакції між сполуками заліза та інших хімічних елементів, які є у залізній руді, з одного боку, і оксидом вуглецю (СО), воднем (Н2), розжареним коксом (С) і флюсом (СаСО3) – з іншого. Унаслідок цих реакцій утворюються чавун, шлак і домновий газ.
Хімі́чна техноло́гія — прикладна наука, що вивчає способи та процеси виробництва продуктів (предметів споживання та засобів виробництва), що відбуваються за участюхімічних перетворень технічно, економічно та соціально доцільним шляхом.
35. Корозія та способи захисту від корозії. Основні типи корозії. Атмосферна корозія. Інгібітори корозії.
Корозія - це мимовільний процес руйнування матеріалів і виробів з них під хімічним впливом навколишнього середовища. Корозія металів - руйнування металів внаслідок фізико-хімічного впливу зовнішнього середовища, при якому метал переходить в окислене (іонне) стан і втрачає властиві йому властивості.
Класифікація корозійних процесів
За типом руйнувань
За типом руйнувань корозія буває суцільною і місцевої. При рівномірному розподілі корозійних руйнувань по всій поверхні металу корозію називають рівномірною або суцільний. Вона не являє собою небезпеки для конструкцій і апаратів, особливо в тих випадках, коли втрати металів не перевищують технічно обгрунтованих норм. Її наслідки можуть бути порівняно легко враховані. Якщо ж значна частина поверхні металу вільна від корозії й остання зосереджена на окремих ділянках, то її називають місцевою. Вона набагато небезпечніше, хоча втрати металу можуть бути і невеликими. Її небезпека полягає в тому, що, знижуючи міцність окремих ділянок, вона різко зменшує надійність конструкцій, споруд, апаратів. Місцевої корозії сприяють морська вода, розчини солей, зокрема галогенідних: хлорид натрію, кальцію, магнію. Особливо великі неприємності пов'язані з хлоридом натрію, який розкидають в зимовий час на дорогах і тротуарах для видалення снігу та льоду. У присутності солей вони плавляться, і які утворюються розчини стікають в каналізаційні труби. Солі є активаторами корозії і призводять до прискореного руйнування металів, зокрема транспортнихзасобів та підземних комунікацій. Підраховано, що в США застосування для цієї мети солей призводить до втрат на суму 2 млрд. доларів на рік у зв'язку з корозією двигунів і 0,5 млрд. на додатковий ремонт доріг, підземних магістралей і мостів. Причина ж використання хлориду натрію полягає в його дешевизні. В даний час вихід лише один - вчасно прибирати сніг і вивозити його на звалища. Економічно він біліше ніж виправданий. Виразкова (у вигляді плям різної величини), точкова, щілинна, контактна, межкристаллических корозія - найбільш часто зустрічаються в практиці типи місцевої корозії. Точкова - одна з найбільш небезпечних. Вона полягає в утворенні наскрізних поразок, тобто точкових порожнин - питтинга. Корозійне розтріскування виникає при одночасному впливі на метал агресивного середовища і механічних напруг. У металі з'являються тріщини транскрісталлітного характеру, які часто призводять до повного руйнування виробів. За механізмом По механізму корозійного процесу розрізняють два основних типи корозії: хімічну і електрохімічну. Строго відокремити один вид від іншого важко, а іноді й неможливо. Під хімічної корозією мають на увазі взаємодія металевої поверхні з навколишнім середовищем, не супроводжується виникненням електрохімічних (електродних) процесів на межі фаз. Вона заснована на реакції між металом і агресивним реагентом. Цей вид корозії протікає в основному рівномірно по всій поверхні металу. У зв'язку з цим хімічна корозія менш небезпечна, ніж електрохімічна. Прикладом хімічної корозії служать іржавіння заліза і покриття патиною бронзи. У промисловому виробництві метали нерідко нагріваються до високих температур. У таких умовах хімічна корозія прискорюється. Багато хто знає, що на прокатці розпечених шматків металу утворюється окалина. Це типовий продукт хімічної корозії. Встановлено, що корозії заліза сприяє наявність в ньому сірки. Античні предмети, виготовлені із заліза, стійкі до корозії саме завдяки низькому вмісту в цьому залозі сірки. Сірка в залозі зазвичай міститься у вигляді сульфідів FeS та інших. У процесі корозії сульфіди розкладаються з виділенням сірководню H 2 S, який є каталізатором корозії заліза. Механізм хімічної корозії зводиться до реактивної дифузії атомів або іонів металу крізь поступово товщає плівку продуктів корозії (наприклад, окалини) ізустрічної дифузії атомів або іонів кисню. За сучасними поглядами цей процес має іонно-електронний механізм, аналогічний процесам електропровідності в іонних кристалах. Особливо різноманітні процеси хімічної корозії зустрічаються в різних виробництвах. В атмосфері водню, метану та інших вуглеводнів, оксиду вуглецю (II), сірководню, хлору, в середовищі кислот, а також у розплавах солей і інших речовин протікають специфічні реакції з залученням матеріалу апаратів та агрегатів, в яких здійснюється хімічний процес. Завдання фахівців при конструюванні реактора - підібрати метал або сплав, який був би найбільш стійкий до компонентів хімічного процесу. Практично найбільш важливим видом хімічної корозії є взаємодія металу при високих температурах з киснем та іншими газоподібними активними середовищами (HS, SO, галогени, водяні пари, CO). Подібні процеси хімічної корозії металів при підвищених температурах носять також назва газової корозії.Багато відповідальні деталі інженерних конструкцій сильно руйнуються від газової корозії (лопатки газових турбін, сопла ракетних двигунів, елементи електронагрівників, колосники, арматура печей). Великі втрати від газової корозії (чад металу) несе металургійна промисловість. Стійкість проти газової корозії підвищується при введенні до складу сплаву різних добавок (хрому, алюмінію, кремнію). Добавки алюмінію, берилію і магнію до міді підвищують її опір газової корозії в окисних середовищах. Для захисту залізних і сталевих виробів від газової корозії поверхня виробу покривають алюмінієм (алітування). Під електрохімічної корозією мають на увазі процес взаємодії металів з електролітами у вигляді водних розчинів, рідше з неводними електролітами, наприклад, з деякими органічними електропровідними сполуками або безводними розплавами солей при підвищених температурах. Розглянемо схему цього процесу. Складність його полягає в тому, що на одній і тій же поверхні відбуваються одночасно два процеси, протилежні за своїм хімічним змістом: окиснення металу і відновлення окислювача. Обидва процеси повинні протікати сопряженно, щоб зберігалося рівність кількості електронів, що віддають металом і приєднуються до окислювача в одиницю часу. Тільки в цьому випадку може наступити стаціонарний стан. За таким принципом протікають, наприклад, взаємодія металу з кислотами:
![]() Zn
+ 2HCl Zn +2 Cl + H
Zn
+ 2HCl Zn +2 Cl + H
Ця сумарна реакція складається з двох актів:
![]() Zn
Zn + 2e
Zn
Zn + 2e
2H + 2e H
Електрохімічна корозія часто пов'язана з наявністю в металі випадкових домішок або спеціально запроваджених легуючих добавок.
Багато хіміки в свій час були спантеличені тим, що іноді реакція
Zn + H 2 SO 4 = ZnSO 4 + H 2
не протікає. Було з'ясовано, що в такій ситуації в розчин потрібно додати трохи сульфату міді (II) (мідного купоросу). У цьому випадку на поверхні цинку виділиться мідь
CaSO 4 + Zn = ZnSO 4 + Cu
і водень почне бурхливо виділятися. При поясненні цього явища в 1830 році швейцарським хіміком А. де-ля Рівом була створена перша електрохімічна теоріякорозії. У 1800 році, незабаром після відкриття італійцем Л. Гальвані електрохімічного явища, його співвітчизник А. Вольта сконструював джерело електричного струму - гальванічний елемент, що відкрило людству еру електрики. В одному з варіантів джерело складався з чергуються мідних і цинкових дисків, розділених пористим матеріалом і просочених розчином солі. Залежно від числа дисків виходить ток різної сили. При осадженні на поверхні цинку металевої міді виходить короткозамкнений елемент. У ньому цинк є анодом, а мідь - катодом. Оскільки мідь знаходиться у контакті з цинком і обидва ці металу оточені розчиномелектроліту, гальванічний елемент є "включеним". Цинк у вигляді іона Zn 2 + переходить у розчин сірчаної кислоти, а що залишилися від кожного атома два електрони перетікають на більш електропозитивних метал - мідь:
Zn = Zn 2 + + 2e –
До мідному аноду підходять іони водню, беруть електрони і перетворюються в атоми водню, а потім і в молекули водню:
H + + e (Cu) = H
2H = H 2
Таким чином, потоки руху іонів розділені і при надлишку кислоти процес протікає до тих пір, поки не розчиниться весь цинк.
Отже, процеси електрохімічної корозії протікають за законами електрохімічної кінетики, коли загальна реакція взаємодії може бути розділена на наступні, в значній мірі самостійні, електродні процеси: · Анодний процес - перехід металу в розчин у вигляді іонів (у водних розчинах, зазвичай гідратованих) з залишенням еквівалентної кількості електронів у металі; · До атодний процес - асиміляція що з'явилися в металі надлишкових електронів деполяризатором. Розрізняють корозію з водневою, кисневою або окисної деполяризацією. При наявності в розчині газоподібного кисню і неможливістю протікання процесу корозії з водневою деполяризацією основну роль деполяризатора виконує кисень. Корозійні процеси, у яких катодна деполяризація здійснюється розчиненим велектроліті киснем, називають процесами корозії металів з кисневою деполяризацією. Це найбільш поширений тип корозії металу у воді, в нейтральних і навіть в слабокислих сольових розчинах, в морській воді, в землі, в атмосфері повітря. Загальна схема кисневої деполяризації зводиться до відновлення молекулярного кисню до іона гідроокислах:
![]() O
+ 4e +2 HO 4OH
O
+ 4e +2 HO 4OH
Корозія металу з кисневою деполяризацією в більшості практичних випадків відбувається в електролітах, що стикаються з атмосферою, парціальний тиск кисню в якій одно 0,21 атм. Кожен процес з кисневою деполяризацією включає наступні послідовні стадії. 1) Розчинення кисню в електроліті.
2) Транспортування розчиненого кисню в розчині електроліту (за рахунок дифузії або перемішування). 3) Перенесення кисню в результаті руху електроліту.
4) Перенесення кисню в дифузійному шарі електроліту або в плівці продуктів корозії металу до катодних ділянок поверхні.
5) Іонізація кисню: У реальних умовах корозії металу найбільш утрудненими стадіями процесу є: 1. Реакція іонізації кисню на катоді. Виникла при цьому поляризацію називають перенапруженням кисню. Кажуть, що процес йде з кінетичним контролем.
2. Дифузія кисню до катода, або перенапруження дифузії. У цьому випадку, говорять, що процес йде з дифузійним контролем.
Можливі випадки, коли обидві стадії - іонізація кисню і дифузія кисню впливають на процес. Тоді кажуть, про кінетично-дифузійному контролі.
Сутність першої електрохімічної теорії полягала в тому, що домішки в металах створюють мікрогальванічних елементи, в яких відбувається перетікання електронів від анодних ділянок до катодних. Оскільки катодний і анодний процеси розділені на поверхні, то розділені і протилежні потоки іонів, атомів і молекул. Розділені потоки не заважають один одному, і з цієї причини процес корозії протікає швидше, ніж у випадку мікрогальванічних елементів. Звичайно, в даний час теорії електрохімічної корозії виглядають набагато більш досконалими. Вони засновані на численних експериментальних фактах і виражені в математичній формі. Розрізняють такі типи електрохімічної корозії, що мають найбільш важливе практичне значення. 1. Корозія в електролітах. До цього типу належать корозія в природних водах (морської і прісної), а також різні види корозії в рідких середовищах. Залежно від характеру середовища розрізняють: а) кислотну; б) лужну; в) сольову; г) морську корозію.
За умовами впливу рідкого середовища на метал цей тип корозії також характеризується як: · Корозія при повному зануренні;
· При неповному зануренні;
· При змінному зануренні.
Кожен з цих підтипів має свої характерні особливості. 2. Грунтова (грунтова, підземна) корозія - вплив на метал грунту, який в корозійному відношенні повинен розглядатися як своєрідний електроліт. Характерноюособливістю підземної електрохімічної корозії є велика різниця у швидкості доставки кисню (основний деполяризатор) до поверхні підземних конструкцій у різних грунтах (у десятки тисяч разів). Значну роль при корозії в грунті грає утворення і функціонування макрокоррозіонних пар внаслідок нерівномірної аерації окремих ділянок конструкції, а також наявність у землі блукаючих струмів. У ряді випадків на швидкість електрохімічної корозії в підземних умовах істотно впливає також розвиток біологічних процесів у грунті. 3. Атмосферна корозія - корозія металів в умовах атмосфери, а також будь-якого вологого газу; спостерігається під конденсаційними видимими шарами вологи на поверхні металу (мокра атмосферна корозія) або під найтоншими невидимими адсорбційними шарами вологи (волога атмосферна корозія). Особливістю атмосферної корозії є сильна залежність її швидкості і механізму від товщини шару вологи на поверхні металу або ступеня зволоження утворилися продуктів корозії. 4. Корозія в умовах механічного впливу. Цьому типу руйнування піддаються численні інженерні споруди, що працюють як у рідких електролітах, так і в атмосферних і підземних умовах. Найбільш типовими видами подібного руйнування є: · Корозійне розтріскування; при цьому характерно утворення тріщин, які можуть поширюватися не тільки межкрістально, але також і транскрістально. Прикладом подібного руйнування є лужна крихкість котлів, сезонне розтріскування латуней, а також розтріскування деяких конструкційних високоміцних сплавів. · Корозійна втома, викликана впливом корозійного середовища і знакозмінних або пульсуючих механічних напруг. Цей вид руйнування також характеризується утворенням між-і транскрісталлітних тріщин. Руйнування металів від корозійної втоми зустрічаються при експлуатації різних інженерних конструкцій (валів гребних гвинтів, ресор автомобілів, канатів, штанг глибинних насосів, охолоджуваних валків прокатних станів та ін.) · Корозійна кавітація, що є звичайно наслідком енергійного механічного впливу корозійного середовища на поверхню металу. Подібне корозійно-механічне вплив може призводити до дуже сильним місцевим руйнувань металевих конструкцій (наприклад, для гребних гвинтів морських судів). Механізм руйнування від корозійної кавітації близький до руйнування від поверхневої корозійної втоми. · Корозійна ерозія, що викликається механічним истирающим впливом іншого твердого тіла при наявності корозійного середовища або безпосереднім истирающим дією самої корозійного середовища. Це явище іноді називають також корозійним стиранням або фреттинг-корозією.
Інгібітори корозії
Застосування інгібіторів - один з найефективніших способів боротьби з корозією металів у різних агресивних середовищах. Інгібітори - це речовини, здатні в малих кількостях уповільнювати протікання хімічних процесів або зупиняти їх. Назваінгібітор походить від латинського inhibere, що означає стримувати, зупиняти. Ще за даними 1980 року, число відомих науці інгібіторів склало більше п'яти тисяч. Інгібітори дають народномугосподарствучималу економію. Інгібуючу дію на метали, перш за все на сталь, надає цілий ряд неорганічних і органічних речовин, які часто додаються в середу, що викликає корозію. Інгібітори мають властивість створювати на поверхні металу дуже тонку плівку, що захищає метал від корозії. Інгібітори відповідно до Х. Фішером можна згрупувати наступним чином.1) Екранувальні, тобто покривають поверхню металу тонкою плівкою. Плівка утворюється в результаті поверхневої адсорбції. При впливі фізичних інгібіторів хімічних реакцій не відбувається 2) Окислювачі (пасиватори) типу хроматів, викликають утворення на поверхні металу щільно прилягає захисного шару окислів, які уповільнюють перебіг анодного процесу. Ці шари не дуже стійкі і за певних умов можуть піддаватися відновленню. Ефективність пасиватором залежить від товщини утворюється захисного шару і його провідності; 3) Катодні - що підвищують перенапруження катодного процесу. Вони сповільнюють корозію в розчинах не окислюється кислот. До таких інгібіторів відносяться соліабо оксиди миш'яку та вісмуту. Ефективність дії інгібіторів залежить в основному від умов середовища, тому універсальних інгібіторів немає. Для їх вибору потрібне проведення досліджень і випробувань. Найбільш часто застосовуються такі інгібітори: нітрит натрію, що додається, наприклад, до холодильних соляним розчинів, фосфати ісилікатинатрію, біхромат натрію, різні органічніаміни, сульфоокісь бензил, крохмаль, танін і т. п. Оскільки інгібітори з часом витрачаються, вони повинні додаватися в агресивне середовище періодично. Кількість інгібітора, який додається в агресивні середовища, невелика. Наприклад, нітриту натрію додають у воду в кількості 0,01-0,05%. Інгібітори підбираються в залежності від кислого або лужного характеру середовища. Наприклад, часто застосовується в якості інгібітора нітрит натрію може використовуватися в основному в лужному середовищі і перестає бути ефективним навіть в слабокислих середовищах.
Атмосферна корозія металів – найбільш поширений вид корозії. 80% металевих конструкцій експлуатуються в атмосферних умовах.
Зволоженість поверхні кородуючих металів є основним фактором, що визначає механізм і швидкість атмосферної корозії. По степені зволоженості кородуючої поверхні розрізняють такі типи атмосферної корозії:
1. Мокра атмосферна корозія – корозія при наявності на поверхні металу видимої плівки вологи. Цей тип корозії спостерігається при відносній вологості повітря 100%, коли є крапельна конденсація вологи на поверхні металу, а також при безпосередньому попаданні вологи на метал (дощ і т.і.).
2. Волога атмосферна корозія – на поверхні металу є тоненька, невидима плівка вологи, яка утворюється в результаті капілярної, адсорбційної або хімічної конденсації при відносній вологості повітря нижче 100%.
3. Суха атмосферна корозія – повна відсутність плівки вологи на поверхні металу.
Цей поділ умовний, так як в практичних умовах можливі взаємні переходи одного типу в інший.
За механізмом протікання атмосферна корозія поділяється на електрохімічну (мокру і вологу) і хімічну (суху).
Механізм сухої атмосферної корозії аналогічний хімічному процесу утворення і росту на металах плівок продуктів корозії. Процес сухої атмосферної корозії спочатку протікає швидко, але через деякий час встановлюється практично постійна і дуже незначна швидкість (Рис.3), що обумовлено невисокими температурами атмосферного повітря. Так утворюються на металах в кисні або сухому повітрі тонкі оксидні плівки, і поверхня металу тьмяніє. Суха атмосферна корозія не призводить до значних корозійних руйнувань.
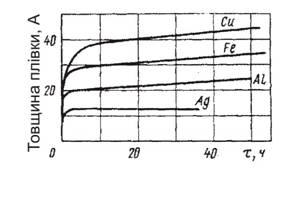
Рисунок 3.
Мокра атмосферна корозія за своїм механізмом наближається до електрохімічної корозії при повному зануренні металу в електроліт, і відрізняється від неї меншим утрудненням дифузії кисню тонкими шарами електроліту і наявністю енергійного самоперемішування електроліту в цих тонких шарах конвекцією. Цей вид атмосферної корозії протікає з переважаючим катодним процесом при основній ролі дифузії кисню.
Особливості атмосферної корозії металів (АКМ) пов'язані з малою товщиною шару електроліту на поверхні металу. Електролітом при цьому є як сама волога, так і зволожений шар продуктів корозії металу.
Для АКМ характерна легкість доступу кисню до поверхні кородуючого металу, яка обумовлена малою утрудненістю дифузії кисню тонкими шарами електроліту і наявністю самоперемішування електроліту в тонких шарах конвекцій. Це призводить до того, що АКМ навіть під кислою плівкою протікає переважно з кисневою деполяризацією. Разом з тим, легкість доступу кисню до поверхні металу полегшує настання пасивного стану металу. Отже, із зменшенням товщини шару електроліту катодний процес атмосферної корозії металу полегшується, а анодний – утруднюється.
При дуже малій товщині плівки вологи можливе гальмування катодної деполяризаційної реакції і анодної реакції гідратації іонів через недостачу води для їх здійснення.
На швидкість атмосферної корозії металів впливають такі фактори:
Вологість повітря є одним із головних факторів. Збільшення відносної вологості повітря призводить до зростання швидкості АКМ. При цьому в більшості випадків швидкість корозії різко збільшується тільки по досягненні деякої певної відносної вологості повітря, при якій з'являється суцільна плівка вологи на кородуючій поверхні металу в результаті конденсації води за рахунок гідратації солевих та інших плівок продуктів корозії або капілярної конденсації.
Домішки повітря дуже впливають на швидкість атмосферної корозії металів:
а) сторонні, які не входять в елементарний склад повітря, гази (SO2, SO3, H2S, NH3, Cl2, HCl), потрапляючи в плівку вологи на поверхні кородуючого металу, збільшують її електропровідність і гігроскопічність продуктів корозії (SO3, HCl), діють як депасиватори (HCl, SO2), як катодні деполяризатори (SO2, Cl2):
2HSO3– + 2H+ +2e = S2O42– + 2H2O
Cl2 + 2e = 2Cl–
б) тверді частинки, що потрапляють з повітря на поверхню металу, самі можуть бути корозійними.
Характер атмосфери: найбільш агресивними є дуже забруднені індустріальні атмосфери, найменш активними – чисті і сухі континентальні атмосфери.
Температура: підвищення температури при постійній абсолютній вологості повітря призводить до зменшення його відносної вологості, що утруднює конденсацію вологи на поверхні металу, або полегшує випаровування плівки вологи, і призводить до зменшення швидкості атмосферної корозії металів. Зворотній ефект дає пониження температури.
Для захисту металів від атмосферної корозії широко використовують нанесення різних захисних неметалічних (змазки, лакофарбові покриття) і металічних (цинкових, нікелевих, багатошарових) покриттів, або перетворення поверхневого шару металу в хімічну сполуку (оксид, фосфат), що володіють захисними властивостями.
