
- •Токсикологическая классификация ов
- •4. Физические и химические свойства фос. Их токсичность при различных путях воздействия на организм. Превращения в организме.
- •5. Механизм действия фос, патогенез, клиническая картина при различной тяжести поражения. Осложнения и последствия поражения. Патологоанатомические изменения.
- •6. Принципы антидотной терапии при поражении фов и фос. Патогенетическая и симптоматическая терапия. Объем первой помощи в очаге поражения и на этапах медицинской эвакуации.
- •7. Профилактика поражений фос. Медицинская сортировка и эвакуационная характеристика пораженных фос.
- •8. Физико-химические и токсические свойства ипритов, люизита, фенола и его производных и др.
- •10. Клиника поражения и особенности ее проявления при различных путях поступления в организм ов и сдяв кожно-нарывного действия. Дифференциальная диагностика поражений.
- •11. Антидотная и симптоматическая терапия при поражении ов и сдяв кожно-нарывного действия. Содержание и организация оказания медицинской помощи пораженным в очаге и на этапах медицинской эвакуации
- •12. Физико-химические и токсические свойства синильной кислоты, цианидов, оксида углерода, нитробензола, сероводорода, акрилонитрила, динитроортокрезола и др.
- •13. Механизм действия и патогенез интоксикации ов и сдяв общеядовитого действия.
- •14. Клиника поражений ов и сдяв общеядовитого действия.
- •15. Антидотная и симптоматическая терапия при поражении ов и сдяв общеядовитого действия. Содержание и организация оказания медицинской помощи пораженным в очаге и на этапах медицинской эвакуации.
- •16. Физико-химические свойства фосгена и дифосгена, хлора, хлорпикрина, азотной кислоты и ее окислов, треххлористого фосфора, пятифтористой серы, изоцианатов, аммиака, гидразина и др.
- •17. Механизм действия и патогенез интоксикации ов и сдяв удушающего действия
- •18. Клиника поражения ов и сдяв удушающего действия
- •19. Патогенетическая и симптоматическая терапия при поражении ов и сдяв удушающего действия. Содержание и организация оказания медицинской помощи пораженным в очаге и на этапах медицинской эвакуации.
- •20. Физико-химические и токсические свойства хлорацетофенона, адамсита, Си-Эс, Си - а и др
- •21. Клиника поражения ов и сдяв раздражающего действия.
- •25. Клиника поражений отравляющими и сильнодействующими ядовитыми веществами психотомиметического действия.
- •27. Физико-химические и токсические свойства метилового спирта, этиленгликоля, дихлорэтана, тетраэтилсвинца и др.
- •37. Средства индивидуальной и коллективной защиты. Общая характеристика средств защиты
- •38. Индивидуальные средства защиты, их классификация по назначению и принципу защитного действия.
- •42. Средства защиты кожи: их назначение, классификация. Режим работы в защитной одежде. Роль тренировки в пользовании индивидуальными средствами защиты. Медицинский контроль за тренировками.
- •43. Коллективные средства защиты. Их классификация по назначению, способу обеспечения воздухом.
16. Физико-химические свойства фосгена и дифосгена, хлора, хлорпикрина, азотной кислоты и ее окислов, треххлористого фосфора, пятифтористой серы, изоцианатов, аммиака, гидразина и др.
Удушающим эффектом обладают большинство опасных химических веществ (ОХВ) местного действия — галогены, оксиды азота и серы; аммиак, хлорпикрин и другие химические соединения, вероятность контакта с которыми велика в боевой обстановке и при промышленных авариях в мирное время.
-

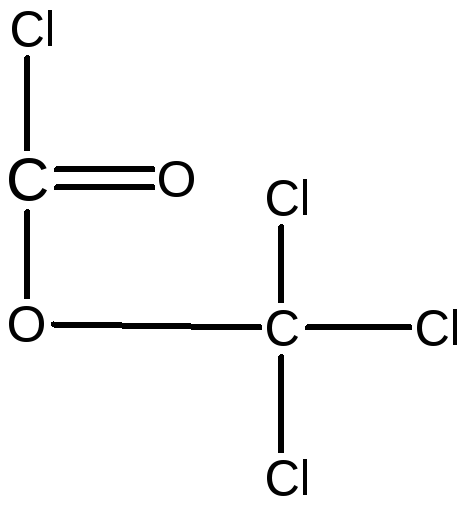
фосген
дифосген
Фосген-дихлорангидрид угольной кислоты.При нормальных условиях – бесцветный газ с запахом гнилых фруктов; температура кипения 8,2 °С, замерзания минус 118 °С. Летучесть при температуре 20 °С 6,37 г/л, в полевых условиях концентрация фосгена в воздухе не превышает 1 г/л. Растворимость в воде низкая (0,9%), хорошо растворим в органических растворителях, хлорпикрине, иприте, кислотных дымообразователях — четыреххлористых кремнии, олове, титане. Газообразный фосген в 3,5 раза тяжелее воздуха. Стойкость очага фосгена — до 30 мин летом, до 3 ч зимой.
Дифосген— трихлорметиловый эфир хлоругольной кислоты (шифр в армии США — DP):При нормальных условиях – бесцветная жидкость с запахом гнилых фруктов; температура кипения 128 °С, замерзания минус 57 °С, в воде растворяется хуже фосгена. Растворимость в органических растворителях, иприте и кислотных дымообразователях аналогична таковой у фосгена. Летучесть при температуре 20 °С равна 0,12 г/л. Газообразный дифосген в 6,9 раза тяжелее воздуха. Стойкость очага летом до 30 мин, зимой — до 10—12 ч.
Пары фосгена и дифосгена хорошо адсорбируются обмундированием, поэтому в замкнутых помещениях возможно создание поражающих концентраций. Для дегазации зараженного фосгеном (дифосгеном) воздуха в закрытых объемах применяется разбрызгивание аммиачной воды (25% раствор аммиака).
Хлорпикрин(трихлорнитрометан):CCl3 — NO2, бесцветная жидкость с острым запахом; удельный вес при температуре 0 °С — 1,69, температура кипения 113 °C, температура замерзания минус 37 °С, летучесть при температуре 20 °С — 290 мг/л.
Азотная кислота(HNO3) в чистом виде — бесцветная жидкость с едким жгучим запахом. Температура кипения 86 °С. Пары азотной кислоты в 2,2 раза тяжелее воздуха. На свету разлагается с образованием оксидов азота (NO2,N2O4). При контакте азотной кислоты с металлами и органическими соединениями (дерево, уголь) образуется большое количество оксидов азота.Оксиды азота — смесь, различных оксидов, главным образомNO2и N2O4 и небольшого количестваN2O5, который представляет собой бесцветную жидкость, затвердевающую при температуре минус 9,3 °С. При температуре 10 °С жидкость желтеет при температуре 20 °С начинает выделять пары красно-бурого цвета; при температуре 22 °С жидкость испаряется. Изменение цвета связано с превращением бесцветного оксида N2O4в оксидNO2 окрашенного в темно-бурый цвет. При температуре выше 150 °С двуокись азота начинает разлагаться на оксид азотаNО и кислород.Агрегатное состояние в очаге: капельно-жидкое, парообразное, аэрозоль дляHNО3,N2O4, газ дляNО иNO2.
