
- •1 Билет
- •Кислотные оксиды
- •Основные оксиды
- •Амфотерные оксиды
- •Кислоты
- •2 Билет
- •Основные свойства химических оксидов
- •Химические свойства кислотных оксидов
- •Химические свойства амфотерных оксидов
- •Химические свойства
- •3 Билет
- •Химические свойства оснований
- •Классификация:
- •Получение оснований:
- •Применение оснований:
- •4 Билет
- •5 Билет
- •Получение
- •Применение:
- •6 Билет
- •Классификация:
- •Химич.Свойства:
- •Получение солей:
- •Применение солей:
- •7 Билет фактор эквивалентности и молярная масса простых и сложных веществ
- •8 Билет фактор эквивалентности и молярная масса
- •9 Билет
- •10 Билет Принцип Паули
- •Правило Гунда
- •Принцип минимума энергии
- •11 Билет
- •12 Билет
- •Виды окислительно-восстановительных реакций
- •13 Билет
- •14 Билет
- •15 Билет
- •Следствия закона Гесса
- •16 Билет
- •17 Билет
- •18 Билет
- •Зависимость скорости реакции от концентрации веществ
- •19 Билет Энергия активации
- •Уравнение Аррениуса
- •20 Билет
- •Гомогенный катализ
- •Гетерогенный катализ
12 Билет
Метод электронного баланса основан на определении общего числа электронов, перемещавшихся от восстановителя к окислителю. Для составления уравнения окислительно-восстановительной реакции необходимо, прежде всего, знать химические формулы исходных веществ и полу-чающихся продуктов. Исходные вещества нам известны, а продукты реакции устанавливаются либо экспериментально, либо на основании известных свойств элементов. Участие воды в реакции выясняется при составлении уравнения.
Химические реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие вещества, называют окислительно-восстановительными реакциями.
Под восстановлением понимают процесс присоединения электронов атомами, ионами илимолекулами. Степень окисления ири этом понижается. Например, атомы неметаллов могут присоединять электроны, превращаясь при этом в отрицательные ионы, то есть восстанавливаясь:

Электроны могут присоединяться и к положительным ионам, превращая их при этом в атомы:

Принимать электроны могут и положительные ионы, у которых при этом степень окисления понижается.
Атомы, ионы или молекулы, принимающие электроны, называются окислителями.
Под окислением понимают процесс отдачи электронов атомами, ионами или молекулами. Например, атомы металлов, теряя электроны, превращаются в положительные ионы, то есть окисляются:

Отдавать свои электроны могут отрицательные ионы.
Терять электроны могут и некоторые положительные ионыс низшими степенями окисления.

Атомы, ионы или молекулы, отдающие электроны, называются восстановителями.
Окисление всегда сопровождается восстановлением и наоборот, то есть окислительно-восстановительные реакции представляют собой единство двух противоположных процессов — окисления н восстановления. Схема взаимосвязи изменения степеней окисления с процессами окисления и восстановления может быть представлена так, как это изображено на схеме ниже.
В
окислительно-восстановитольных реакциях
число электронов, отдаваемых
восстановителем, равно числу электронов,
принимаемых окислителем, то есть
соблюдается электронный баланс. Метод
электронного баланса применяют для
записей электронных уравнений
процессов окисления и
восстановления.

Виды окислительно-восстановительных реакций
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S+Cl2→S+ 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H2O→ 2H2+O2
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Cl2+H2O→HClO+HCl
Репропорционирование (конпропорционирование, контрдиспропорционирование) — реакция, обратная диспропорционированию:
![]()
Реакции межатомного или межмолекулярного окисления — восстановления.
Сюда относятся такие реакции, в которых обмен электронами происходит между различными атомами, молекулами или ионами. Таковы, например, простейшие реакции соединения и замещения:
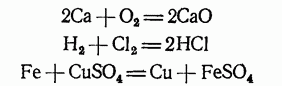
Реакции диспропорционирования.
В реакциях диспропорционирования молекулы или ионы одного и того же вещества реагируют друг с другом как восстановитель и окислитель вследствие того, что содержащиеся в них атомы с переменной (промежуточной) степенью окисления отдают и принимают электроны, переходя в состояния — один в низшее, другой — в высшее. Например:

Реакции внутримолекулярного окисления
— восстановления. Сюда относятся реакции, в которых окислитель и восстановитель находятся в одном и том же веществе (молекуле):

