
- •Передмова
- •МЕХАНІКА
- •1. КІНЕМАТИКА МАТЕРІАЛЬНОЇ ТОЧКИ
- •1.1. Основні поняття
- •1.4. Прямолінійний рух
- •1.5. Криволінійний рух. Рівномірний рух по колу
- •2. ДИНАМІКА МАТЕРІАЛЬНОЇ ТОЧКИ
- •2.1. Основні закони динаміки. Сила. Рівнодійна сила
- •2.2. Сили в механіці
- •2.4. Алгоритм розв’язання кількісних задач із фізики
- •2.5. Методичні рекомендації щодо розв’язання задач з динаміки
- •2.6. Приклади розв’язання задач
- •3. ЗАКОНИ ЗБЕРЕЖЕННЯ В МЕХАНІЦІ
- •3.1. Імпульс тіла. Імпульс сили
- •3.2. Закон збереження імпульсу
- •3.3. Реактивний рух
- •3.4. Енергія. Закон збереження енергії. Види енергії
- •3.5. Види механічної енергії та їх зв’язок з роботою
- •3.6. Механічна робота і потужність
- •3.7. Механічний удар
- •3.8. Прості механізми
- •4. МЕХАНІКА ТВЕРДОГО ТІЛА
- •4.1. Основні поняття
- •4.2. Умови і види рівноваги твердого тіла
- •4.3. Момент імпульсу. Закон збереження моменту імпульсу
- •4.4. Зіставлення рівнянь механіки поступального й обертального рухів (табл. 2)
- •4.5. Приклади розв’язання задач
- •5. ГІДРОСТАТИКА І АЕРОСТАТИКА
- •5.1. Тиск
- •5.2. Закон Паскаля
- •5.3. Гідростатичний тиск
- •5.4. Сполучені посудини
- •5.5. Гідростатичний парадокс
- •5.6. Гідравлічна машина
- •5.7. Закон Архімеда
- •5.8. Умови плавання тіл (табл. 3)
- •5.9. Атмосферний тиск, його вимірювання
- •5.10. Приклади розв’язання задач
- •6. ГІДРОДИНАМІКА І АЕРОДИНАМІКА
- •6.1. Струминна течія рідин і газів
- •6.2. Рівняння Бернуллі
- •6.3. Підйомна сила крила літака
- •6.4. Коефіцієнт лобового опору для тіл різної форми (табл. 4)
- •1. ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ БУДОВИ РЕЧОВИНИ
- •1.1. Основні положення молекулярно-кінетичної теорії та їх дослідне обґрунтування
- •2. ВЛАСТИВОСТІ ГАЗІВ (ГАЗОВІ ЗАКОНИ)
- •2.2. Газові закони
- •2.3. Закон Дальтона
- •2.5. Середня довжина вільного пробігу молекул
- •2.6. Приклади розв’язання задач
- •3. ВЛАСТИВОСТІ ПАРИ
- •3.1. Пара. Випаровування і конденсація
- •3.2. Насичена і ненасичена пара
- •3.3. Вологість повітря (відносна й абсолютна). Точка роси
- •3.4. Кипіння. Перегріта рідина
- •3.5. Приклади розв’язання задач
- •4.2. Поверхнева енергія. Поверхневий натяг
- •4.3. Явище змочування. Капілярні явища
- •4.4. Формула Лапласа
- •4.5. Приклади розв’язання задач
- •5. ВЛАСТИВОСТІ ТВЕРДИХ ТІЛ
- •5.1. Кристалічні та аморфні тіла. Їхні властивості
- •5.2. Типи твердих кристалів
- •5.3. Рідкі кристали
- •5.4. Дефекти кристалічних ґраток
- •5.5. Механічні властивості твердих тіл
- •5.6. Приклади розв’язання задач
- •6. ТЕПЛОВЕ РОЗШИРЕННЯ ТВЕРДИХ І РІДКИХ ТІЛ
- •6.1. Графік залежності потенціальної енергії взаємодії найпростіших молекул від відстані між ними (потенціальна яма)
- •6.2. Лінійне й об’ємне розширення твердих і рідких тіл
- •6.3. Особливості теплового розширення води
- •6.4. Приклади розв’язання задач
- •1.1. Внутрішня енергія ідеального газу
- •1.2. Робота ідеального газу. Її геометричне тлумачення
- •1.5. Питома теплоємність речовини
- •1.6. Питома теплота згоряння палива. ККД нагрівача
- •1.7. Змінювання агрегатного стану речовини
- •2. ПЕРШИЙ ЗАКОН ТЕРМОДИНАМІКИ. АДІАБАТИЧНИЙ ПРОЦЕС
- •3. ДРУГИЙ ЗАКОН ТЕРМОДИНАМІКИ. ЕНТРОПІЯ
- •4. ТЕПЛОВІ ДВИГУНИ
- •ЕЛЕКТРОДИНАМІКА
- •1. ЕЛЕКТРОСТАТИКА
- •1.1. Електричний заряд. Закон збереження заряду
- •1.7. Електризація тіл
- •2. ПОСТІЙНИЙ СТРУМ
- •2.1. Електричний струм. Сила струму. Густина струму
- •2.3. Послідовне і паралельне з’єднання провідників
- •2.4. ЕРС. Закон Ома для повного кола. З’єднання елементів
- •2.6. Приклади розв’язання задач
- •3. СТРУМИ ПРОВІДНОСТІ
- •3.2. Струм в електролітах
- •3.4. Струм у напівпровідниках
- •3.5. Струм у вакуумі (струм переносу)
- •3.6. Приклади розв’язання задач
- •4. МАГНЕТИЗМ
- •4.1. Магнітне поле. Магнітна індукція поля
- •4.2. Магнітне поле струму
- •4.3. Дія магнітного поля на рухомий заряд (сила Лоренца) і провідник зі струмом (сила Ампера). Правило лівої руки
- •4.4. Дія магнітного поля на рамку зі струмом. Магнітний потік
- •4.5. Закон взаємодії паралельних струмів
- •4.6. Магнітне поле у речовині
- •4.7. Приклади розв’язання задач
- •5. ЕЛЕКТРОМАГНІТНА ІНДУКЦІЯ
- •5.1. Явище електромагнітної індукції. Вихрове електричне поле
- •5.3. Індукційні струми в суцільних провідниках
- •5.4. Самоіндукція. Індуктивність. Енергія магнітного поля
- •5.5. Електромагнітне поле. Теорія Максвелла в якісному вигляді
- •5.6. Приклади розв’язання задач
- •ФІЗИКА КОЛИВАНЬ
- •1. КОЛИВАЛЬНИЙ РУХ
- •1.1. Основні поняття
- •1.2. Гармонічні коливання
- •2. ЗМІННИЙ СТРУМ
- •2.1. Одержання змінного синусоїдного струму. Закономірності змінного струму
- •2.2. Діюче значення змінного струму
- •2.3. Опір змінному струму. Закон Ома для змінного струму
- •2.4. Електричний резонанс. Резонанс напруг. Резонанс струмів
- •2.5. Випрямлення змінного струму
- •2.6. Трансформація змінного струму
- •2.7. Змінний струм високої частоти
- •2.8. Приклади розв’язання задач
- •3. ЕЛЕКТРОМАГНІТНІ КОЛИВАННЯ
- •3.2. Закономірності вільних електромагнітних коливань. Згасаючі коливання
- •3.3. Отримання незгасаючих електромагнітних коливань
- •3.4. Приклади розв’язання задач
- •4. МЕХАНІЧНІ ХВИЛІ. ЗВУК
- •4.1. Поздовжні і поперечні хвилі. Промінь. Довжина хвилі. Фронт хвилі
- •4.2. Принцип Гюйгенса
- •4.3. Інтерференція хвиль
- •4.4. Дифракція хвиль
- •4.5. Звук. Звукові хвилі. Інтенсивність, висота і тембр звуку
- •4.6. Луна. Звуковий резонанс
- •4.7. Приклади розв’язання задач
- •5. ЕЛЕКТРОМАГНІТНІ ХВИЛІ
- •5.1. Випромінювання електромагнітних хвиль відкритим коливальним контуром
- •5.3. Принцип радіозв’язку. Модуляція і детектування (демодуляція)
- •5.4. Класифікація радіохвиль і особливості їх поширення
- •5.5. Приклади розв’язання задач
- •ОПТИКА
- •1. ХВИЛЬОВА ОПТИКА
- •1.1. Монохроматичне світло. Заломлення світла
- •1.2. Дисперсія світла
- •1.4. Інтерференція білого світла за Френелем
- •1.5. Інтерференція білого світла за Ньютоном. Кільця Ньютона
- •1.6. Дифракція білого світла
- •1.7. Поляризація світла
- •2. ГЕОМЕТРИЧНА ОПТИКА
- •2.2. Закони відбивання світла
- •2.3. Закони заломлення світла. Повне відбивання світла
- •2.4. Хід променів через плоскопаралельну пластинку, призму
- •2.5. Сферичні лінзи
- •2.6. Око як оптична система
- •2.8. Сферичні дзеркала
- •2.9. Приклади розв’язання задач
- •3. ВИПРОМІНЮВАННЯ ТА СПЕКТРИ
- •3.1. Люмінесценція
- •3.2. Інфрачервоні та ультрафіолетові промені
- •3.3. Рентгенівські промені
- •3.4. Спектри випромінювання. Спектри поглинання
- •3.5. Спектральний аналіз
- •1.1. Поняття про простір і час
- •1.2. Постулати СТВ. Перетворення Лоренца
- •1.4. Приклади розв’язання задач
- •2. КВАНТОВА ОПТИКА
- •2.1. Теорія Планка. Імпульс фотона
- •2.2. Фотоефект
- •2.3. Фотоелементи та їх застосування
- •2.4. Світловий тиск
- •2.5. Корпускулярно-хвильовий дуалізм
- •2.6. Хімічний вплив світла. Чорно-біла фотографія. Фотосинтез. Ланцюгові реакції
- •2.7. Приклади розв’язання задач
- •3. ФІЗИКА АТОМА
- •3.1. Планетарна модель атома Резерфорда
- •3.2. Постулати Бора. Борівські орбіти
- •3.3. Атом Гідрогену за Н. Бором
- •3.4. Приклади розв’язання задач
- •4. ФІЗИКА АТОМНОГО ЯДРА
- •4.1. Відкриття протона і нейтрона
- •4.2. Теорія будови ядра
- •4.3. Енергія зв’язку ядра. Дефект маси
- •4.4. Природна радіоактивність
- •4.6. Часткове звільнення внутрішньоядерної енергії при екзотермічних ядерних реакціях
- •4.7. Закон радіоактивного розпаду
- •4.8. Приклади розв’язання задач
- •5. ЕЛЕМЕНТАРНІ ЧАСТИНКИ
- •5.1. Фізика елементарних частинок
- •5.2. Приклади розв’язання задач
- •Предметний покажчик

Основи термодинаміки
атомів ) відносно центра мас тіла і потенціальних енергій
взаємодії всіх молекул одна з одною.
Внутрішня енергія змінюється при:
—теплопередачі (рис. 150, а);
—виконанні роботи над тілом або самим тілом, (наприклад, при терті пробірки виділяється тепло, і розігрітий газ виштовхує пробку (рис. 150, б).
а |
б |
Рис. 150
1.1. Внутрішня енергія ідеального газу
Внутрішня енергія ідеального газу обумовлюється лише кінетичною енергією руху молекул; потенціальною енер гією їх взаємодії можна знехтувати. Для ідеального газу масою m внутрішня енергія розраховується за формулою
U = 2i Mm RT ,
де i — число ступенів свободи молекули.
Числом ступенів свободи називають число незалежних величин, за допомогою яких може бути задане положення тіла або частинки. Для одноатомного газу i = 3, двоатомного — i = 5, триатомного і більше — i = 6.
1.2. Робота ідеального газу. Її геометричне тлумачення
Термодинамічна робота виконується тілами при зміні їхнього об’єму.
186
1. Внутрішня енергія і її змінапри теплопередачі
Оскільки тверді й рідкі тіла при нагріванні розширюються незначною мірою, то незначною є і виконувана ними термодинамічнаробота.Роботу втермодинаміціможевикону-
вати лише газ, який значно змінює свій об’єм при нагріванні.
Робота ідеального газу при ізобарному процесі:
A′= p(V2 −V1 ) = Mm R(T2 −T1 ) .
Робота ідеального газу при ізотермічному процесі:
A′ = |
m |
RTln |
V2 |
. |
M |
|
|||
|
|
V |
||
|
|
|
1 |
|
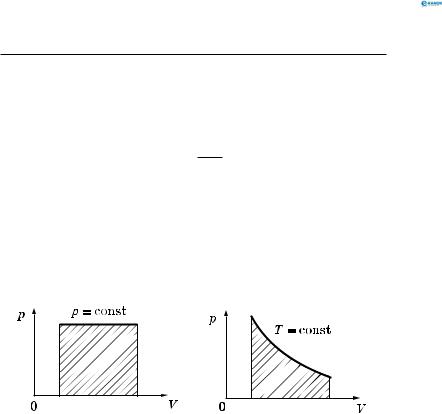
Геометричне тлумачення роботи газу.
Робота газу чисельно дорівнює площі фігури, обмеженої графіком залежності p від V, віссю V та ординатами початкового і кінцевого стану (рис. 151, а, б).
а |
|
б |
|
||
|
Рис. 151 |
|
1.3.Теплопередача та її види
Теплопередачею або теплообміном називається процес передавання енергії від одного тіла до іншого без виконання
роботи.
Існує три способи теплопередачі:
1)теплопровідність;
2)конвекція;
3)випромінювання.
Теплопровідність — вид теплопередачі, при якій передавання внутрішньої енергії від одних тіл до інших відбувається при їх безпосередньому контакті й зумовлене взаємодією атомів і молекул. Висока теплопровідність, наприклад, у металів. Шерсть, поролон та інші пористі тіла мають низьку теплопровідність. Вакуум теплопровідністю не наділений.
187

Основи термодинаміки
Конвекція — вид теплопередачі, при якій внутрішня енергія від одних тіл до інших передається рухомими струменями рідини чи газу. Конвекція приводить до виникнен-
ня вітру (бриз) на березі моря .
При випромінюванні теплообмін зумовлений передачею енергії світловим потоком (здебільшого інфрачервона ділянка шкали електромагнітних хвиль). Цей вид теплопередачі відрізняється від інших тим, що може здійснюватися в пов ному вакуумі. Випромінюванням передається на Землю і сонячна енергія.
1.4.Кількість теплоти. Рівняння теплового балансу
Та частина внутрішньої енергії, яку тіло втрачає чи отримує при теплопередачі, називається кількістю теп лоти (Q):
[Q] = Дж.
При теплообміні не відбувається перетворення енергії з однієї форми на іншу: частина внутрішньої енергії гарячого тіла передається холодному; теплообмін припиняється
при вирівнюванні їхніх температур.
Теплообмін у замкненій системі описується рівнянням теплового балансу:
Q1 + Q2 + …+ Qn = 0 ,
Qодерж = Qвід ,
де Qодерж — сумарна кількість теплоти, одержана тілом при теплообміні;
Qвід — сумарна кількість теплоти, віддана тілом при теп лообміні.
1.5.Питома теплоємність речовини
Питома теплоємність речовини (с) — це величина, яка чисельно дорівнює кількості теплоти, що отримує або віддає 1 кг речовини при зміні її температури на 1 К:
c = mQ∆T .
188

1. Внутрішня енергія і її змінапри теплопередачі
Одиниця питомої теплоємності — «джоуль на кілограм-
кельвін»:
|
= |
Дж |
|
|
кг К . |
||||
c |
||||
Кількість теплоти, яка необхідна для нагрівання тіла і яка виділяється при охолодженні тіла, розраховується за формулами:
при нагріванні: Q = cm(tк −tп ) ; при охолодженні: Q = cm(tп −tк ) ,
де tп — початкова температура, tк — кінцева температура. Питома теплоємність речовини залежить від виду речовини, її агрегатного стану та інтервалу температур, у якому
проходить теплопередача.
Рідкі й тверді речовини розширюються при нагріванні незначною мірою, їхні питомі теплоємності при сталому об’ємі й сталому тиску залишаються сталими і наведені в таблицях.
Якщо нагрівати газ при сталому об’ємі, його молярну теплоємність (Cv ) і питому теплоємність (cv ) можна обчислити за формулами:
Cv = iR2 ,
cv = CMv = 2iRM ,
де M — молярна маса речовини.
Якщо нагрівати газ при сталому тиску, його молярну
теплоємність (Cp ) і питому теплоємність (cp ) можна обчислити за формулами:
Cp = Cv + R = |
(i +2) |
R , cp = |
(i +2)R |
. |
2 |
|
|||
|
|
2M |
||
Молярна теплоємність речовини — величина, яка ви-
значається кількістю теплоти, необхідної для нагрівання
1 моля речовини на 1 К.
Одиниця молярної теплоємності — «джоуль на моль-
кельвін»:
|
= |
Дж |
|
|
моль К . |
||||
c |
||||
189
