
- •Передмова
- •МЕХАНІКА
- •1. КІНЕМАТИКА МАТЕРІАЛЬНОЇ ТОЧКИ
- •1.1. Основні поняття
- •1.4. Прямолінійний рух
- •1.5. Криволінійний рух. Рівномірний рух по колу
- •2. ДИНАМІКА МАТЕРІАЛЬНОЇ ТОЧКИ
- •2.1. Основні закони динаміки. Сила. Рівнодійна сила
- •2.2. Сили в механіці
- •2.4. Алгоритм розв’язання кількісних задач із фізики
- •2.5. Методичні рекомендації щодо розв’язання задач з динаміки
- •2.6. Приклади розв’язання задач
- •3. ЗАКОНИ ЗБЕРЕЖЕННЯ В МЕХАНІЦІ
- •3.1. Імпульс тіла. Імпульс сили
- •3.2. Закон збереження імпульсу
- •3.3. Реактивний рух
- •3.4. Енергія. Закон збереження енергії. Види енергії
- •3.5. Види механічної енергії та їх зв’язок з роботою
- •3.6. Механічна робота і потужність
- •3.7. Механічний удар
- •3.8. Прості механізми
- •4. МЕХАНІКА ТВЕРДОГО ТІЛА
- •4.1. Основні поняття
- •4.2. Умови і види рівноваги твердого тіла
- •4.3. Момент імпульсу. Закон збереження моменту імпульсу
- •4.4. Зіставлення рівнянь механіки поступального й обертального рухів (табл. 2)
- •4.5. Приклади розв’язання задач
- •5. ГІДРОСТАТИКА І АЕРОСТАТИКА
- •5.1. Тиск
- •5.2. Закон Паскаля
- •5.3. Гідростатичний тиск
- •5.4. Сполучені посудини
- •5.5. Гідростатичний парадокс
- •5.6. Гідравлічна машина
- •5.7. Закон Архімеда
- •5.8. Умови плавання тіл (табл. 3)
- •5.9. Атмосферний тиск, його вимірювання
- •5.10. Приклади розв’язання задач
- •6. ГІДРОДИНАМІКА І АЕРОДИНАМІКА
- •6.1. Струминна течія рідин і газів
- •6.2. Рівняння Бернуллі
- •6.3. Підйомна сила крила літака
- •6.4. Коефіцієнт лобового опору для тіл різної форми (табл. 4)
- •1. ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ БУДОВИ РЕЧОВИНИ
- •1.1. Основні положення молекулярно-кінетичної теорії та їх дослідне обґрунтування
- •2. ВЛАСТИВОСТІ ГАЗІВ (ГАЗОВІ ЗАКОНИ)
- •2.2. Газові закони
- •2.3. Закон Дальтона
- •2.5. Середня довжина вільного пробігу молекул
- •2.6. Приклади розв’язання задач
- •3. ВЛАСТИВОСТІ ПАРИ
- •3.1. Пара. Випаровування і конденсація
- •3.2. Насичена і ненасичена пара
- •3.3. Вологість повітря (відносна й абсолютна). Точка роси
- •3.4. Кипіння. Перегріта рідина
- •3.5. Приклади розв’язання задач
- •4.2. Поверхнева енергія. Поверхневий натяг
- •4.3. Явище змочування. Капілярні явища
- •4.4. Формула Лапласа
- •4.5. Приклади розв’язання задач
- •5. ВЛАСТИВОСТІ ТВЕРДИХ ТІЛ
- •5.1. Кристалічні та аморфні тіла. Їхні властивості
- •5.2. Типи твердих кристалів
- •5.3. Рідкі кристали
- •5.4. Дефекти кристалічних ґраток
- •5.5. Механічні властивості твердих тіл
- •5.6. Приклади розв’язання задач
- •6. ТЕПЛОВЕ РОЗШИРЕННЯ ТВЕРДИХ І РІДКИХ ТІЛ
- •6.1. Графік залежності потенціальної енергії взаємодії найпростіших молекул від відстані між ними (потенціальна яма)
- •6.2. Лінійне й об’ємне розширення твердих і рідких тіл
- •6.3. Особливості теплового розширення води
- •6.4. Приклади розв’язання задач
- •1.1. Внутрішня енергія ідеального газу
- •1.2. Робота ідеального газу. Її геометричне тлумачення
- •1.5. Питома теплоємність речовини
- •1.6. Питома теплота згоряння палива. ККД нагрівача
- •1.7. Змінювання агрегатного стану речовини
- •2. ПЕРШИЙ ЗАКОН ТЕРМОДИНАМІКИ. АДІАБАТИЧНИЙ ПРОЦЕС
- •3. ДРУГИЙ ЗАКОН ТЕРМОДИНАМІКИ. ЕНТРОПІЯ
- •4. ТЕПЛОВІ ДВИГУНИ
- •ЕЛЕКТРОДИНАМІКА
- •1. ЕЛЕКТРОСТАТИКА
- •1.1. Електричний заряд. Закон збереження заряду
- •1.7. Електризація тіл
- •2. ПОСТІЙНИЙ СТРУМ
- •2.1. Електричний струм. Сила струму. Густина струму
- •2.3. Послідовне і паралельне з’єднання провідників
- •2.4. ЕРС. Закон Ома для повного кола. З’єднання елементів
- •2.6. Приклади розв’язання задач
- •3. СТРУМИ ПРОВІДНОСТІ
- •3.2. Струм в електролітах
- •3.4. Струм у напівпровідниках
- •3.5. Струм у вакуумі (струм переносу)
- •3.6. Приклади розв’язання задач
- •4. МАГНЕТИЗМ
- •4.1. Магнітне поле. Магнітна індукція поля
- •4.2. Магнітне поле струму
- •4.3. Дія магнітного поля на рухомий заряд (сила Лоренца) і провідник зі струмом (сила Ампера). Правило лівої руки
- •4.4. Дія магнітного поля на рамку зі струмом. Магнітний потік
- •4.5. Закон взаємодії паралельних струмів
- •4.6. Магнітне поле у речовині
- •4.7. Приклади розв’язання задач
- •5. ЕЛЕКТРОМАГНІТНА ІНДУКЦІЯ
- •5.1. Явище електромагнітної індукції. Вихрове електричне поле
- •5.3. Індукційні струми в суцільних провідниках
- •5.4. Самоіндукція. Індуктивність. Енергія магнітного поля
- •5.5. Електромагнітне поле. Теорія Максвелла в якісному вигляді
- •5.6. Приклади розв’язання задач
- •ФІЗИКА КОЛИВАНЬ
- •1. КОЛИВАЛЬНИЙ РУХ
- •1.1. Основні поняття
- •1.2. Гармонічні коливання
- •2. ЗМІННИЙ СТРУМ
- •2.1. Одержання змінного синусоїдного струму. Закономірності змінного струму
- •2.2. Діюче значення змінного струму
- •2.3. Опір змінному струму. Закон Ома для змінного струму
- •2.4. Електричний резонанс. Резонанс напруг. Резонанс струмів
- •2.5. Випрямлення змінного струму
- •2.6. Трансформація змінного струму
- •2.7. Змінний струм високої частоти
- •2.8. Приклади розв’язання задач
- •3. ЕЛЕКТРОМАГНІТНІ КОЛИВАННЯ
- •3.2. Закономірності вільних електромагнітних коливань. Згасаючі коливання
- •3.3. Отримання незгасаючих електромагнітних коливань
- •3.4. Приклади розв’язання задач
- •4. МЕХАНІЧНІ ХВИЛІ. ЗВУК
- •4.1. Поздовжні і поперечні хвилі. Промінь. Довжина хвилі. Фронт хвилі
- •4.2. Принцип Гюйгенса
- •4.3. Інтерференція хвиль
- •4.4. Дифракція хвиль
- •4.5. Звук. Звукові хвилі. Інтенсивність, висота і тембр звуку
- •4.6. Луна. Звуковий резонанс
- •4.7. Приклади розв’язання задач
- •5. ЕЛЕКТРОМАГНІТНІ ХВИЛІ
- •5.1. Випромінювання електромагнітних хвиль відкритим коливальним контуром
- •5.3. Принцип радіозв’язку. Модуляція і детектування (демодуляція)
- •5.4. Класифікація радіохвиль і особливості їх поширення
- •5.5. Приклади розв’язання задач
- •ОПТИКА
- •1. ХВИЛЬОВА ОПТИКА
- •1.1. Монохроматичне світло. Заломлення світла
- •1.2. Дисперсія світла
- •1.4. Інтерференція білого світла за Френелем
- •1.5. Інтерференція білого світла за Ньютоном. Кільця Ньютона
- •1.6. Дифракція білого світла
- •1.7. Поляризація світла
- •2. ГЕОМЕТРИЧНА ОПТИКА
- •2.2. Закони відбивання світла
- •2.3. Закони заломлення світла. Повне відбивання світла
- •2.4. Хід променів через плоскопаралельну пластинку, призму
- •2.5. Сферичні лінзи
- •2.6. Око як оптична система
- •2.8. Сферичні дзеркала
- •2.9. Приклади розв’язання задач
- •3. ВИПРОМІНЮВАННЯ ТА СПЕКТРИ
- •3.1. Люмінесценція
- •3.2. Інфрачервоні та ультрафіолетові промені
- •3.3. Рентгенівські промені
- •3.4. Спектри випромінювання. Спектри поглинання
- •3.5. Спектральний аналіз
- •1.1. Поняття про простір і час
- •1.2. Постулати СТВ. Перетворення Лоренца
- •1.4. Приклади розв’язання задач
- •2. КВАНТОВА ОПТИКА
- •2.1. Теорія Планка. Імпульс фотона
- •2.2. Фотоефект
- •2.3. Фотоелементи та їх застосування
- •2.4. Світловий тиск
- •2.5. Корпускулярно-хвильовий дуалізм
- •2.6. Хімічний вплив світла. Чорно-біла фотографія. Фотосинтез. Ланцюгові реакції
- •2.7. Приклади розв’язання задач
- •3. ФІЗИКА АТОМА
- •3.1. Планетарна модель атома Резерфорда
- •3.2. Постулати Бора. Борівські орбіти
- •3.3. Атом Гідрогену за Н. Бором
- •3.4. Приклади розв’язання задач
- •4. ФІЗИКА АТОМНОГО ЯДРА
- •4.1. Відкриття протона і нейтрона
- •4.2. Теорія будови ядра
- •4.3. Енергія зв’язку ядра. Дефект маси
- •4.4. Природна радіоактивність
- •4.6. Часткове звільнення внутрішньоядерної енергії при екзотермічних ядерних реакціях
- •4.7. Закон радіоактивного розпаду
- •4.8. Приклади розв’язання задач
- •5. ЕЛЕМЕНТАРНІ ЧАСТИНКИ
- •5.1. Фізика елементарних частинок
- •5.2. Приклади розв’язання задач
- •Предметний покажчик

Молекулярна
фізика
1. Основи молекулярно-кінетичної теорії будови речовини
1.1. Основні положення молекулярно-кінетичної теорії та їх дослідне обґрунтування
Розділ фізики, у якому розглядаються закономірності
атомно-молекулярної будови макроскопічних тіл (систем),
називається молекулярною фізикою.
Основоположниками молекулярно-кінетичної теорії є Демокріт (V—IV ст. до н. е.), М. В. Ломоносов (XVIII ст.).
Основні положення молекулярно-кінетичної теорії:
I положення. Усі речовини складаються з молекул або інших структурних одиниць (атомів, іонів і електронів), розділених проміжками.
Доказом дискретної побудови речовини є фотографії, одержані за допомогою іонного, електронного і тунельного мікроскопів. Про наявність проміжків між молекулами свідчить зміна об’єму твердих тіл і рідини при змінюванні
їхньої температури.
II положення. Молекулиабоіншіструктурнічастинкиперебувають у неперервному хаотичному русі. Підтвердженням
137
Молекулярна фізика
цього положення є явища дифузії, броунівського руху,
осмосу (рис. 117, а).
Дифузія — це процес перерозподілу концентрації атомів у просторі шляхом хаотичної, тобто теплової, міграції.
Осмос — одностороння дифузія.
Броунівський рух — хаотичний рух частинок твердого
тіла, що зависли у рідині або в газі (рис. 117, б). Відкритий у 1827 р. англійським ботаніком Р. Броуном. Спостерігається
в оптичний мікроскоп із збільшенням Г ≈ 500 . Пояснюється поштовхами молекул, які оточують частинку, внаслідок їх неупорядкованого теплового руху.
а |
б |
Рис. 117
IIIположення. Молекули або атоми одночасно притягуються і відштовхуються, а рівнодійна цих сил називається силою молекулярної взаємодії. Доказом є виникнення
пружних сил при деформації тіл, виникнення сил поверхневого натягу.
1.2.Сили молекулярної взаємодії
Сили молекулярної взаємодії є силами притягання й відштовхування, залежать від відстані між молекулами і виникають унаслідок взаємодії електричних зарядів, які входять до їх складу. Ці сили є короткодіючими.
138
1. Основи молекулярно-кінетичної теорії будови речовини
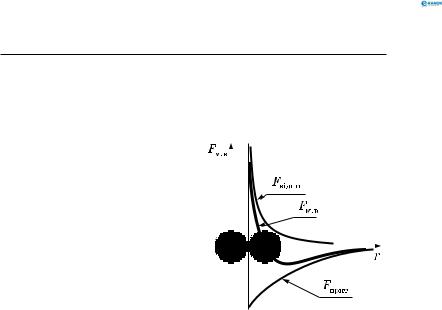
Графік залежності сили молекулярної взаємодії Fм.в від відстані між молекулами для найпростіших молекул має такий вигляд (рис. 118).
Якщо r = r0 ≈ dм (dм — діаметр молекули), молекули перебувають у рівновазі.
Якщо |
r < r0 , |
переважа- |
|
|
|
||||
ють сили відштовхування. |
|
|||
Якщо 10r0 > r > r0 , пере- |
|
|||
важають сили притягання. |
|
|||
Якщо r ≈ 10r0 , сили при- |
|
|||
тягання мізерно малі, так |
|
|||
що ними можна знехтувати. |
|
|
||
|
|
|||
Отже,відстаньдіїмолекуляр |
|
|||
них сил близько 10−9 м. |
|
|||
Найпростіші молекули — |
|
|||
це одно-, триатомні моле |
|
|||
|
||||
кули , які можна уявити як |
|
|||
кульку |
певного |
діаметра |
Рис. 118 |
|
d0 ≈ 10−10 м.
Молекула — найменша стійка частинка речовини, яка зберігає її основні хімічні
властивості. Вона складається з атомів однакових або різних хімічних елементів, наприклад H2, NaCl, C6H12O6.
Сукупність молекул зберігає фізичні властивості речо-
вини.
Речовина є те, із чого складається фізичне тіло.
Атом — найменша частинка речовини, яка не ділиться при хімічних реакціях, наприклад H, Na, Cl, C, O.
1.3.Маса атомів і молекул
Маси атомів і молекул прийнято порівнювати з 1/12 маси атома ізотопу Карбону 126C. Відносною молекулярною масою
Mr називають відношення маси молекули m0 до 1/12 маси атома Карбону m0c (атомної одиниці маси, а. о. м. ) :
Mr |
= |
|
m0 |
, |
|
|
1 |
m |
|||
|
|
|
|
||
|
|
|
12 |
|
|
|
|
|
0c |
|
|
Mr — безрозмірна величина.
139

Молекулярна фізика
Маса молекули визначається за допомогою періодичної системи Менделєєва, де вказані відносні атомні маси речовин Mr .
1.4.Молярна маса. Кількість речовини
Один моль — кількість речовини, у якій міститься стільки ж молекул або атомів, скільки в Карбоні 126C масою
0,012 кг.
Стала Авогадро (NA ) — число атомів або молекул в 1 молі будь-якої речовини:
NA =6,02 1023 моль−1 .
Згідно із законом Авогадро 1 моль ідеального газу займає за нормальних умов
( p0 =1,01 105 Па, T =273 К)
об’єм
Vм =22,4 10−3 м3 моль−1 .
Кількість речовини (ν) дорівнює відношенню числа молекул (N) у даному тілі до сталої Авогадро (NА), тобто до числа молекул в 1 молі речовини:
V = N .
NA
Одиниця кількості речовини — 1 моль.
Маса одного моля речовини називається молярною
масою:
M = m0NA ,
або
M = Mr 10−3 молькг .
Одиниця молярної маси — 1 кг/моль.
Маса молекули (в кг) виражена через молярну масу:
m0 = M . NA
140
1. Основи молекулярно-кінетичної теорії будови речовини
Маса тіла (в кг) виражена через масу однієї молекули
і число молекул:
m = m0N.
Кількість речовини (в молях) дорівнює відношенню маси речовини до її молярної маси:
V = Mm .
1.5.Ідеальний газ. Основне рівняння молекулярнокінетичної теорії ідеального газу (рівняння Клаузіуса)
Ідеальний газ — це газ, у якому середня відстань між молекулами набагато більша від розмірів молекул, і тому в ньому потенціальною енергією молекул нехтують
(рис. 119).
Середня квадратична швидкість молекул (vкв ) — це корінь
квадратний із середнього квадрата швидкості:
vкв = v2 .
Рис. 119 |
Основне рівняння молекулярно-кінетичної теорії газу (рівняння Клаузіуса) зв’язує мікропараметри (m0,n,v) і макропараметри (p, V, T):
p = 13 m0nv2 ,
де m0 — маса молекули, n — концентрація молекул, v — середня квадратична швидкість руху молекул.
|
m v2 |
|
|
Якщо Eк = |
0 |
— середня кінетична енергія посту- |
|
2 |
|||
|
|
пального руху молекули, то основне рівняння молекулярнокінетичної теорії (МКТ) можна записати у вигляді
p = 23 nEк .
141

Молекулярна фізика
1.6.Температура. Термодинамічна шкала температур і її зв’язок з температурою за міжнародною шкалою
Температура — це величина, яка характеризує теплову рівновагу системи. У всіх частинах системи, що перебуває в тепловій рівновазі, температура однакова.
У молекулярно-кінетичній теорії температура — це величина, зумовлена середньою кінетичною енергією частинок, із яких складається система:
Eк = 32 kT — для одноатомних молекул,
Eк = 52 kT — для двоатомних молекул.
k =1,38 10−23 Дж/К — стала Больцмана, яка зв’язує температуру в енергетичних одиницях з температурою
в кельвінах (T):
θ =kT .
Основне рівняння МКТ, яке виражає залежність тиску газу (p) від концентрації молекул (n) і температури (T):
p = nkT .
Закон Авогадро: у рівних об’ємах газів при однакових температурах і тиску міститься однакова кількість молекул:
Концентрація (n) дорівнює числу частинок в одиниці об’єму:
n = |
N |
|
= м |
−3 |
. |
V |
|
||||
, n |
|
Температура вимірюється рідинними або газовими термометрами, відповідним чином градуйованими. Висока температура вимірюється оптичними термометрами (за спектром випромінювання) або електричними (напівпровід-
никові термістори, термопари).
У міжнародній шкалі температур за нуль прийнято тем-
пературу танення льоду при нормальному атмосферному тиску, за 100 °С — температуру пари киплячої води при нор-
142

1. Основи молекулярно-кінетичної теорії будови речовини
мальному атмосферному тиску. 1/100 цього інтервалу — це
1 °С (Цельсія). Позначається t °С.
У термодинамічній шкалі температур за нуль прийня та температура, при якій припинився б тепловий рух частинок, із яких складається тіло.
Ця температура називається абсолютним нулем температур. Оди
ниця |
термодинамічної |
шкали |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
температур |
у системі СІ — кель- |
|
|
|
|
|
|
||
|
|
|
|
|
|
||||
він (К). Позначається T (1 К = 1 °С) |
|
|
|
|
|
|
|||
(рис. 120). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Формула зв’язку термодина- |
|
|
|
|
|
|
|||
мічної температури (T) і темпе- |
|
|
|
|
|
|
|||
ратури |
за |
міжнародною |
шкалою |
|
|
|
|
|
|
температур: |
|
|
|
|
|
|
|
||
|
T =(273,15+t)K . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
За міжнародною шкалою абсо- |
|
|
|
|
|
|
|||
лютний нуль відповідає температу- |
|
|
Рис. 120 |
||||||
рі –273,15 °С. |
|
|
|
|
|
|
|
||
1.7. Середня швидкість теплового руху одноатомних молекул. Дослід ќтерна
Середня швидкість теплового руху одноатомних молекул:
|
|
v = |
|
3kT |
= |
3RT |
, |
|
|
|
m |
M |
|||
|
|
|
0 |
|
|
|
|
R =8,31 |
Дж |
— |
універсальна газова стала, що дорів- |
||||
|
|||||||
К моль |
|||||||
нює добутку сталої Больцмана і сталої Авогадро:
R = k NA .
Дослід Штерна (1920) дає змогу визначити середню швидкість руху молекул експериментально за формулою
|
= |
2πn(RB |
−RА )RВ |
, |
|
v |
|
|
|||
S |
|||||
|
|
|
|||
де n — частота обертання циліндрів;
143

Молекулярна фізика
RB — радіус більшого циліндра;
RA — радіус меншого циліндра;
S — ширина розмитості смуги срібла.
1.8.Приклади розв’язання задач
Задача 1.
У посудині міститься суміш азоту і водню. При температурі T, коли азот повністю дисоційований на атоми, тиск дорівнює p (дисоціацією водню знехтувати). При температурі 3T, коли обидва гази дисоційовані, тиск у посудині дорівнює 4p. Яке відношення мас водню й азоту в суміші?
Дано:
M(N2 ) = 28 10−3 кг/моль
M(H2 ) = 2 10−3 кг/моль
M(N) = 14 10−3 кг/моль
M(H) = 1 10−3 кг/моль
p1 = p2
T1 = T
T2 = 3T p2 = 4p
mазоту — ? mводню
Виразимо p1а і p1в :
Розв’язання:
Тиск суміші дорівнює сумі парціальних тисків азоту та водню згідно із законом Дальтона:
p1 = p1а + p1в .
Запишемо рівняння Кла пейрона — Менделєєва для кожного газу:m
p1аV = M(Nа ) p1вV = Mm(Hв 2 )
p |
= |
|
mаRT1 |
|
, p |
= |
mвRT1 |
. |
|
|||||
|
M(N)V |
|
|
|
||||||||||
1а |
|
|
1в |
|
M(H |
2 |
)V |
|
||||||
Підставимо значення p1а і p1в |
у закон Дальтона: |
|
||||||||||||
p = |
RT |
|
|
m |
+ |
m |
|
|
|
|
||||
1 |
|
|
|
а |
в |
|
|
. |
(1) |
|||||
V |
|
M(N) |
|
|
|
|||||||||
|
1 |
|
|
|
M(H2 ) |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
Якщо T2, коли обидва гази дисоційовані, їх тиск можна подати у вигляді:
p = |
RT |
|
m |
+ |
m |
|
|
2 |
|
а |
в |
. |
(2) |
||
V |
M(N) |
|
|||||
2 |
|
|
M(H) |
|
|||
|
|
|
|
|
|
|
|
144
