
Лекции / organic_2011_3
.pdf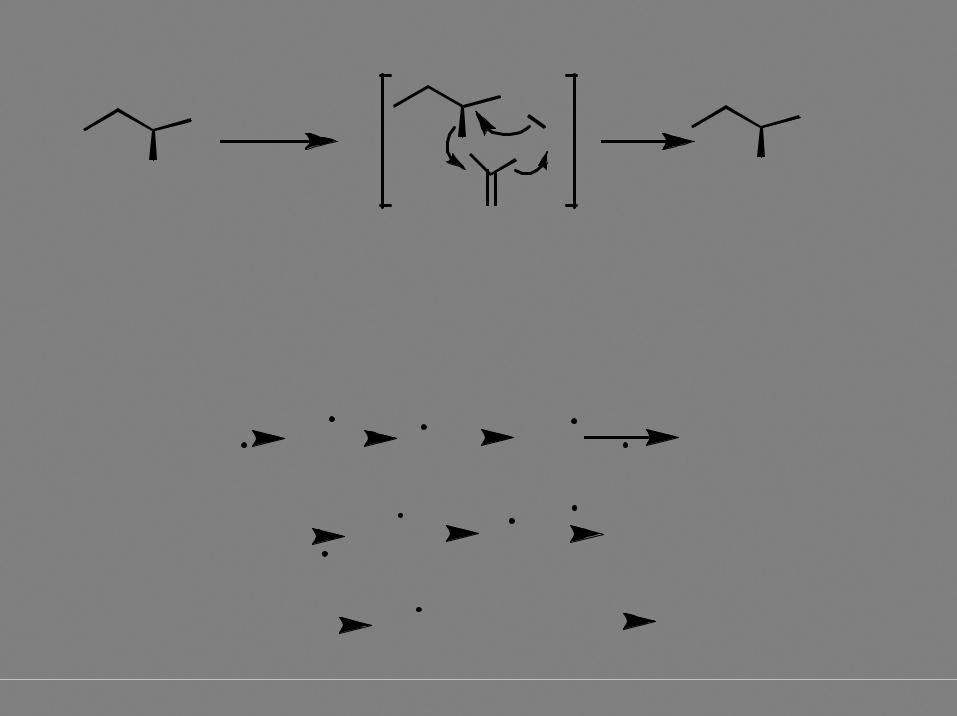
Механизм SNi |
|
|
|
|
|
21 |
|
|
|
|
|
|
|
||
* |
SOCl2 |
|
Cl |
-SO |
|
* |
|
O |
H |
2 |
|||||
|
бензол |
|
|
||||
OH |
Cl |
-HCl |
Cl |
||||
|
|
|
|
|
|||
R-изомер |
|
|
O |
|
|
R-изомер |
|
|
|
|
|
|
|
||
реакция происходит в "клетке" растворителя (бензола) с сохранением конфигурации асимметрического центра. В случае использования в качестве избытка SOCl2, происходит частичная рацемизация
Ион-радикальный механизм замещения
|
Nu- |
|
- |
|
|
|
|
|
|
Nu- |
- |
|
RX |
|
|
||||||||||
RX |
|
|
|
RX |
|
|
|
R |
|
|
|
|
RNu |
- |
|
|
|
RNu |
|||||||
|
|
|
|
-X- |
|
|
|
|
|
|
|
||||||||||||||
-Nu |
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-RX |
|
|
|||
|
1 |
|
|
|
|
|
|
|
- |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|||
RX |
R MgY |
|
|
|
|
|
RX |
|
|
|
|
R |
|
R |
|
|
R |
|
|
R1 |
|||||
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
1 |
|
|
|
|
|
|
|
-X- |
|
|
|
|
|
|
|
|
|
|||||||
|
|
-R MgY |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
R1 |
|
|
|
|
MgY+ |
|
X- |
|
|
MgXY |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
-MgY+ |
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
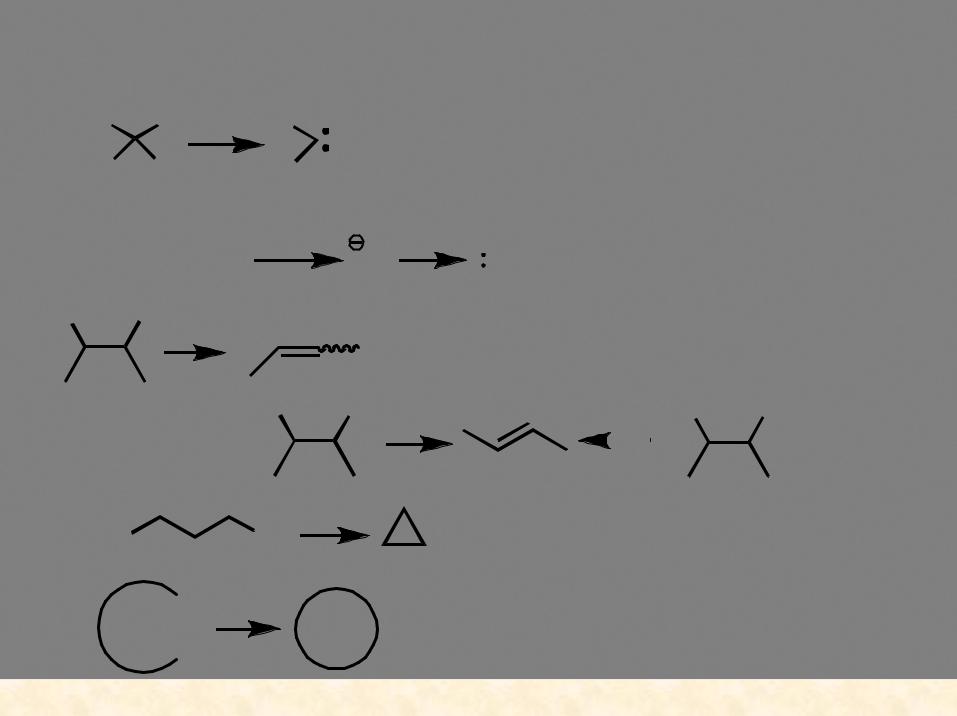
Реакции элиминирования |
22 |
|
Топология
|
R |
A |
R |
|
|
|
|
|
|
R |
B -AB |
R |
1,1-элиминирование (α-элиминирование) |
||||
|
|
|
|
|
|
|||
|
|
|
карбен |
|
|
|
|
|
пример: |
CHCl3 |
HO- |
CCl |
CCl |
|
|
|
|
-H2O |
|
|
|
|||||
|
|
|
3-Cl- |
|
2 |
|
|
|
X |
Y |
|
|
|
|
|
|
|
|
|
-XY |
|
|
1,2-элиминирование (β-элиминирование) |
|||
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
Cl |
|
EtO- |
H |
Cl |
|
примеры: |
|
Zn |
|
|
|
||
|
|
|
|
|
|
|
||
Br |
Na |
γ |
Br |
1,3-элиминирование ( -элиминирование) |
|
X |
|
|
Y |
-XY |
ω-элиминирование |
23
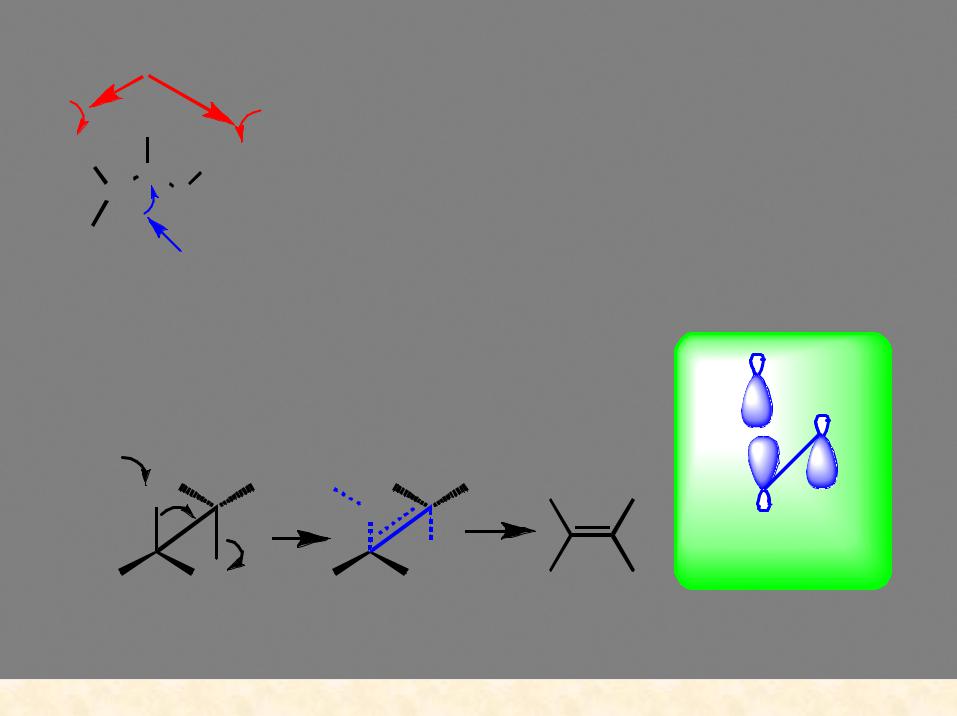
Бимолекулярный механизм β-элиминирования E2
E2
Nu- |
X |
|
Nu- |
δ+ |
|
||
|
Hδ+ |
возможные направления |
|
H δ+CH |
атаки |
||
|
CH |
C |
|
|
Nu- |
H2 |
Направление атаки управляется основностью нуклеофила – |
|
|
SN2 |
высокая основность благоприятствует элиминированию |
скорость реакции V = k[субстрат][основание]
синхроный процесс, уходящие группы лежат в одной плоскости, связи направлены в противоположные стороны
Nu-
H |
Nu |
|
|
H |
|
|
|
|
|
орбитальный |
|
|
X |
|
|
|
-NuH |
контроль реакции |
|
|
X |
|
переходное -X- состояние

E |
Nu |
|
|
24 |
|
|
|
|
|
|
H |
OH |
|
|
|
X |
- |
|
|
|
HO |
|
||
|
|
|
HO- |
|
|
переходное |
S 1 |
||
|
N |
|
Cl |
|
|
состояние |
HO- |
||
|
|
SN2 |
||
|
|
E2 |
|
|
Br
EtO-
>
>
по правилу Зайцева
25
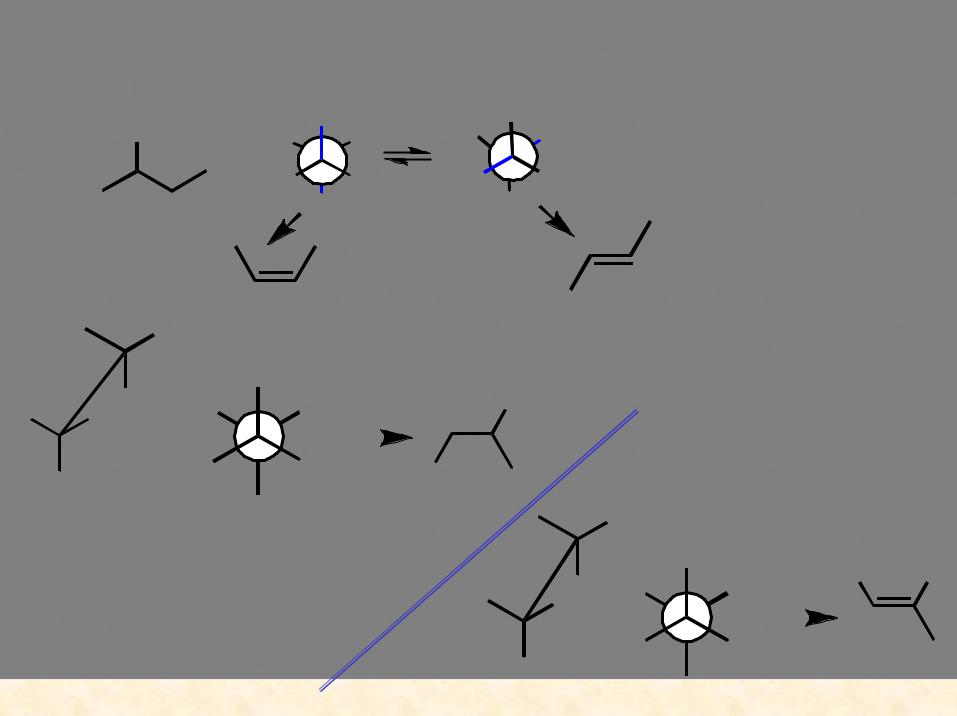
Конформационный анализ позволяет определить основное направление реакции:
конформации, в которых может происходить реакция
Br
H
H BrPh H
Ph
Ph
трео-форма
|
Br |
|
H3C |
H |
|
H3C |
H |
|
H |
более |
|
|
H |
< |
Br |
H |
устойчивая |
H C |
H |
|
CH3 |
конформация |
|
3 |
|
|
|
|
|
<
H
Ph |
EtO- |
|
|
|
Ph |
|
|
|
|
||
|
|
|
|
|
|
Br Ph
E-изомер
|
H |
|
|
|
|
|
HPh H |
Ph |
Ph |
Ph |
|
Br |
Ph |
||||
EtO- |
|
||||
|
H |
Br |
Z-изомер |
||
|
Ph |
|
|||
эритро-форма
26
|
|
Br |
|
|
|
H |
H |
|
|
(H3C)3C |
> |
эта реакция |
||
|
||||
|
идет быстрее! |
|||
|
|
H |
|
H |
цис-изомер |
правило Зайцева |
|
(основной конформер) |
|
Br благоприятная для реакции конформация |
||
|
H |
Br |
|
H |
H |
Br |
|
H |
|
H |
|
(H3C)3C |
H |
|
|
H |
|
H |
|
C(CH3)3 |
|
транс-изомер |
транс-изомер |
(основной конформер) |
(минорный конформер) |
|
нереакционная конформация |
реакционная конформация |
|
единственный
продукт
27
Реакция Гофмана (элиминирование)
Связь С-Н рвется несколько быстрее, чем связь С-N, поэтому атом углерода, от которого отщепляется протон, приобретает карбанионный характер. Поскольку алкильные заместители являются донорами электронов, первичный карбанион стабильнее вторичного, что и определяет направление реакции.
|
N |
|
N |
|
|
H2C |
H |
t |
δ- |
H |
|
C |
H2C |
C |
|
||
H |
H |
E2 |
H |
H -N(CH3)3 |
|
|
|
|
|
- H O |
|
|
|
|
HO - |
2 |
продукт по правилу |
|
HO- |
|
|
||
|
|
|
|
Гофмана |
переходное
состояние
28
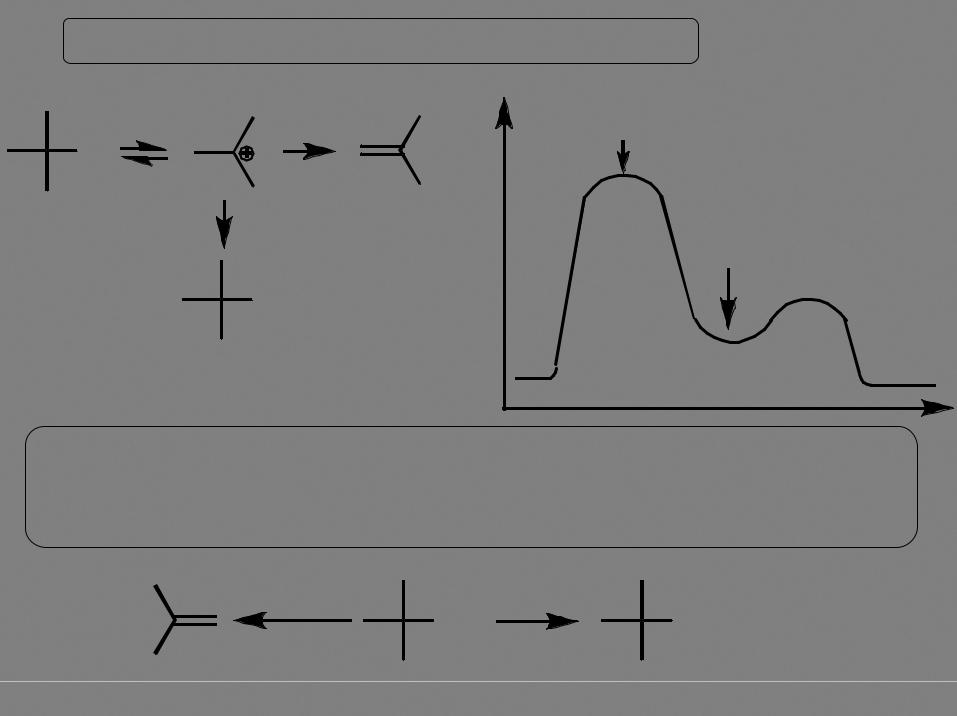
Мономолекулярный механизм элиминирования E1
|
|
|
лимитирующая |
|
|
|
стадия |
Cl |
- H+ |
E1 |
|
- |
|
||
-Cl |
|
|
|
|
Nu- |
|
|
|
|
|
карбокатион |
|
Nu |
SN1 |
|
скорость реакции V = k[субстрат] |
|
||
Для реализации этого механизма необходима устойчивость образующегося карбокатиона, требуется хорошая уходящая группа, реакции способствует повышенная температура, и нужна малонуклеофильная среда (конкуренция с мономолекулярным SN1 замещением)
E1 |
H2SO4 |
OH |
HCl |
Cl SN1 |
|
или HClO4 |
|||||
|
|
|
|
||
|
t |
|
|
|
|
|
Cl- - сильный нуклеофил, HSO |
- - слабый |
|||
|
|
|
4 |
||

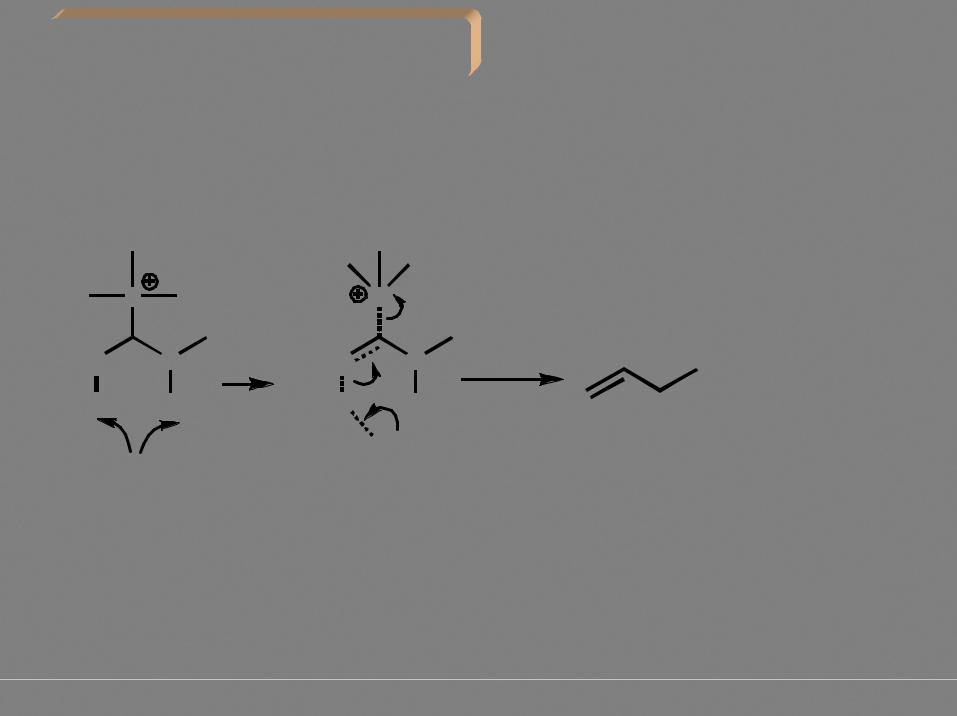
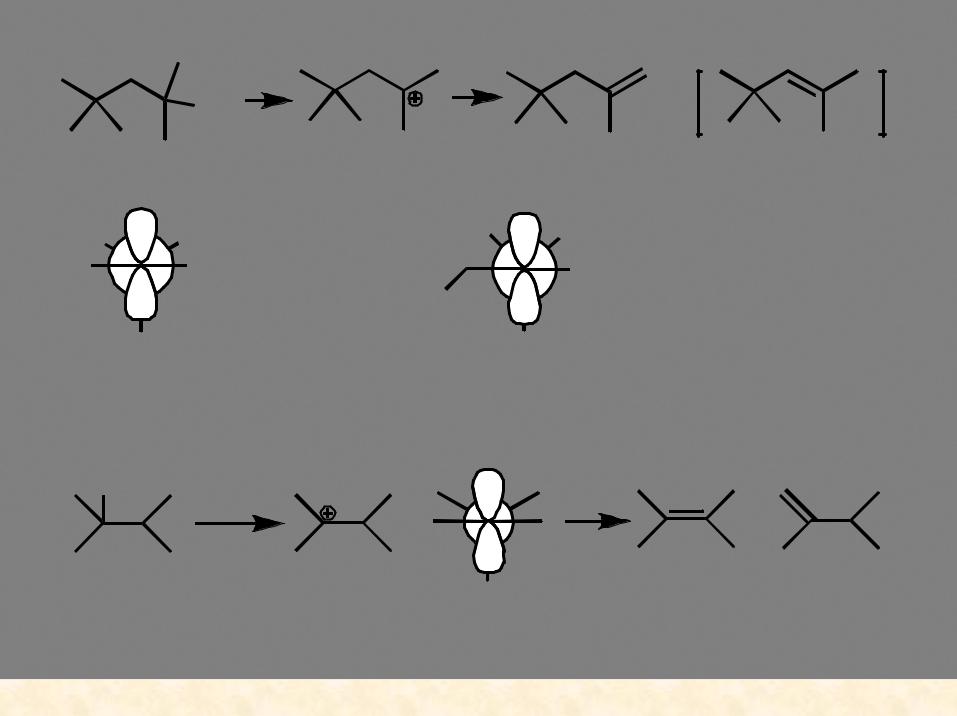
Образование карбокатиона означает возможность перегруппировок!
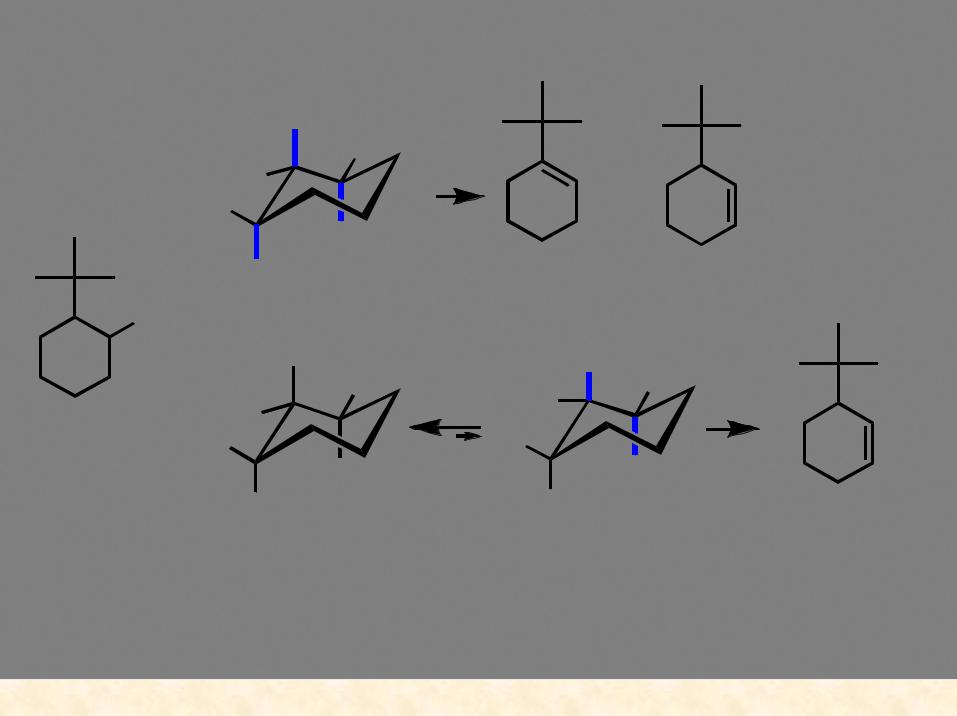
Стереохимия процесса (конформационный анализ):
Cl
(CH3)3COK |
> |
t |
|
E1 |
|
конформации, в которых может происходить отщепление протона (связь С-Н должна быть параллельна вакантной орбитали
|
вакантная р-орбиталь |
|
|
|
|||
|
|
|
H |
|
H |
H3C |
|
H |
CH3 |
|
|
|
|
||
H |
CH3 |
H |
CH |
H |
|||
H |
CH |
||||||
|
|
|
3 |
|
|||
|
3 |
|
|
H3C |
H |
|
|
|
|
H |
CH3 |
H |
|||
|
H |
|
|
|
|
||
|
|
|
|
|
|
||
29
H
CH3
из этих конформаций образуется |
более устойчивые конформации |
|
(их содержание выше), |
||
цис-изомер |
||
|
из них образуется транс-изомер |
30
3 |
1 |
|
2 |
Cl |
-Cl- |
-H+ |
|
||
|
|
не образуется |
Связь С2-С3 |
|
Связь С2-С1 |
H |
C(CH3)3 |
H |
H |
|
|
||
H3C |
CH3 |
(H3C)3C |
CH3 |
|
|
|
|
|
H |
|
H |
очень неустойчивая |
устойчивая конформация |
||
конформация |
(образуется менее замещенный |
||
|
|
|
алкен) |
OH |
|
|
H+ |
+ |
|
-H2O |
||
|
||
H |
1 : 1 |
|
неустойчивая конформация, |
|
|
необходимая для образования |
|
|
более замещенного алкена |
|
