
Лекции / organic_2011_3
.pdf
11
г. Природа уходящей группы 
Уходящая группа является тем более «хорошей», чем она лучше поляризуема и лучше сольватируется, то есть, чем более слабым основанием она является.
I- > Br- > Cl- > F- H2O >> HO-
Превращение «плохой» уходящей группы в «хорошую»
X- |
HX |
R |
|
X- |
RCH2X |
R |
OH |
|
OH2 - H O |
||
|
|
|
|
2 |
p-TsCl |
|
плохая |
|
хорошая |
ClO2S |
|
|
уходящая |
|
уходящая |
пара-толуолсульфохлорид |
|
|
группа |
|
|
группа |
|
p-TsCl |
|
|
|
|
(хлористый тозил) |
|
|
|
|
p-TsO- - аналог сульфат-аниона - |
|
|
|
X- |
|
|
|
R |
OTs |
|
RCH2X |
очень слабое основание |
|
- p-TsO- |
|
||||
|
|
|
|
||
хорошая
уходящая
группа
R-O-SO2R1 |
Nu- |
|
|
12 |
RNu R |
1 |
= CF , OR |
||
|
|
|
3 |
очень хорошая |
-OSO2R1 |
уходящая группа |
|
|
диметилсульфат - очень эффективный метилирующий реагент |
Nu- + (CH3O)2SO2  CH3Nu
CH3Nu
Некоторые синтезы с использованием SN2-замещения:
RCN H3O+ RCO2H
CN- 
RX R' -X- C- R  NO2-
NO2-
RONO + RNO2
нитрит нитросоединение (в ДМФА, ДМСО - основной продукт)
R' |
SN2: R - первичный лучше вторичного |
|
X - I > Br > Cl |
растворитель апротонный диполярный - жидкий аммиак
N
O O- нитрит-ион
O- нитрит-ион

RCl
RCl
O
O
KBr |
реакция практически не происходит - нуклеофил не растворим! |
13 |
|
|
KBr
ацетон, 18-краун-6 эфир
RBr
O |
O |
|
|
O |
O |
O |
растворимый комлекс, в котором |
KBr |
K+ |
|
катион эффективно сольватирован |
|
|
|
а анион (нуклеофил) - нет. |
O |
O |
O |
Br- |
O |
O |
|
|
|
|
18-краун-6 эфир
14
Катализаторы межфазного переноса
OH |
|
K2CO3 |
|
+ CH2Cl2 |
|
OH |
|
|
|
||
|
|
N  K2CO3
K2CO3
H2O
Cl-
триэтилбензиламмоний хлорид (ТЭБАХ)
реакция не происходит -
ROH слишком слабый нуклеофил! поташ не растворим в CH2Cl2
N
HO-
четвертичное аммонийное основание (ЧАО)
OH |
ЧАО |
O |
|
||
|
|
|
OH |
CH2Cl2/H2O |
O |
|

|
|
|
15 |
Мономолекулярное нуклеофильное замещение SN1 |
|||
RX + Nu- |
RNu + X- |
лимитирующая |
|
стадия |
|||
скоростьреакции V = k[RX] |
|
||
рацемизация |
|
|
|
* |
HBr |
|
карбокатион |
t |
|
||
OH |
Br |
|
|
|
|
||
R-изомер |
|
рацемат |
|
Механизм реакции: |
|
|
|
RX |
R+ Nu- |
RNu |
|
-X- |
|
|
|
Факторы, влияющие на скорость реакции |
|||
1.Строение скелета
Скорость реакции определяется устойчивостью карбокатиона и изменяется в следующем ряду: третичные > вторичные. Первичные алкилгалогениды в реакцию по этому механизму не вступают (первичные карбокатионы неустойчивы).
16
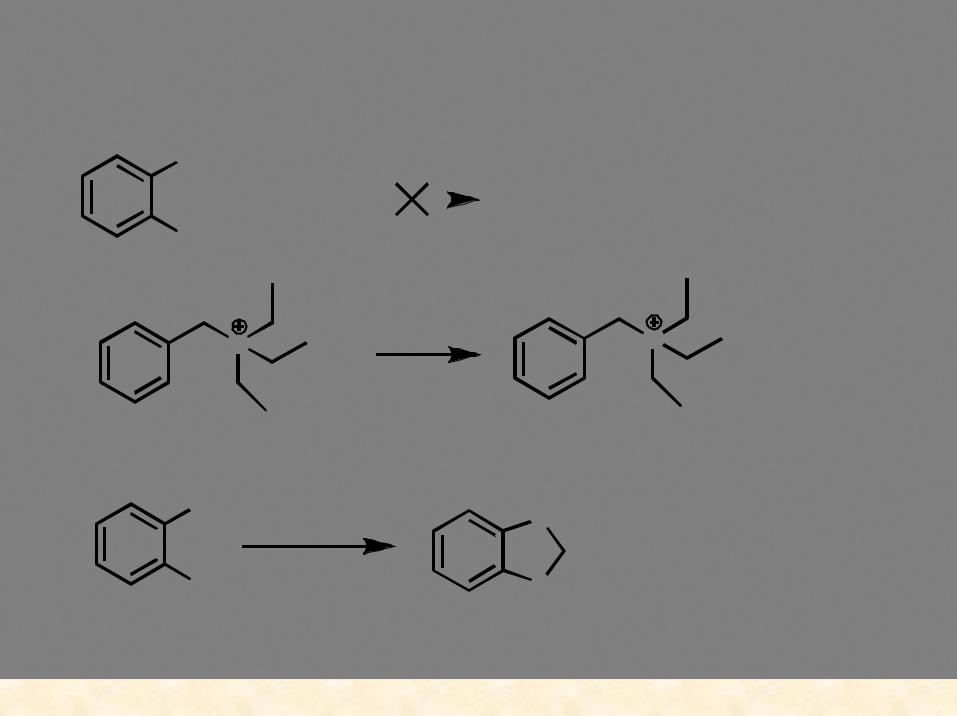
Аллильные и бензильные катионы очень устойчивы –  аллил- и бензилгалогениды активны в реакциях мономолекулярного замещения.
аллил- и бензилгалогениды активны в реакциях мономолекулярного замещения.
Субстраты, содержащие гетероатомный заместитель у атома углерода,  связанного с уходящей группой, обладают высокой активностью (резонансно-стабилизированный катион)
связанного с уходящей группой, обладают высокой активностью (резонансно-стабилизированный катион) 
X |
Br |
X |
X |
Nu- |
Nu |
X |
|||||
|
|
-Br- |
|
|
|
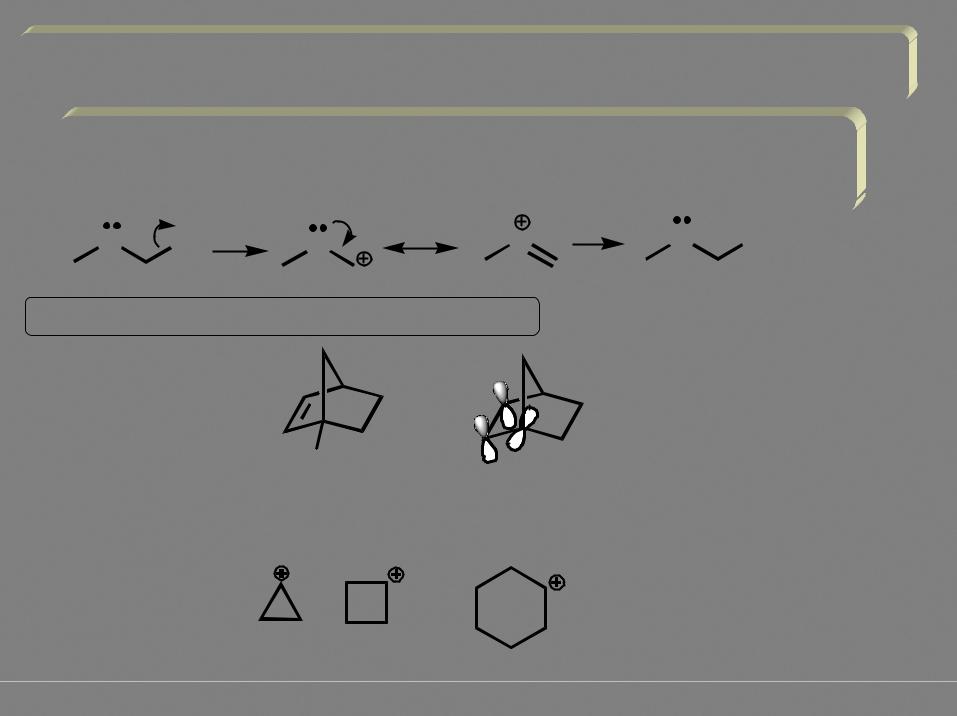
Учет пространственного строения молекулы |
|
|
|||
X
низкая реакционная способность и по SN1 и по SN2 - карбокатионный центр не может принять планарную геометрию, отсутствует стабилизация вакантной орбитали π-системой - p-орбитали ортогональны - нет взаимодействия
< |
< < |
Устойчивость циклических катионов (валентный угол в sp2-гибридном атоме углерода - 120о:

NaBr
OH
реакция не происходит по SN2 - третичный атом углерода
по SN1 - плохая уходящая группа
17
HBr |
OH2 |
|
Br- |
|
-H2O |
Br |
|
|
|
|
|
|
|
(SN1) |
|
реакция не происходит по SN2 - третичный атом углерода
Образование карбокатиона – возможность перегруппировок!
X |
Nu- |
Nu |
|
SN2 |
|||
|
|||
|
|
SN1
Nu
единственный продукт реакции
основной продукт реакции
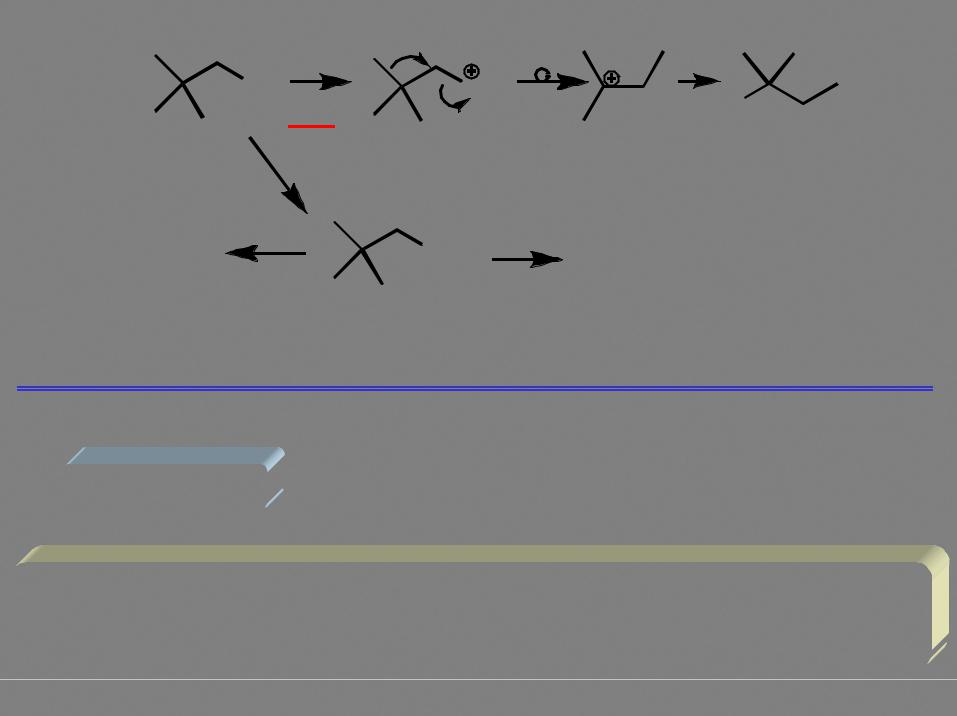
HX
OH
SN1
NEt3 TsCl
SN2 с трудом - стерические затруднения
2. Растворитель 
18
OH2 |
X- |
|
X |
||
|
OTs
SN1 с трудом - образование первичного катиона
На лимитирующей стадии происходит распад связи углерод-уходящая группа (полярное переходное состояние, необходимость сольватации уходящей группы). Сольватация нуклеофила некритична, он участвует на нелимитирующей стадии. 
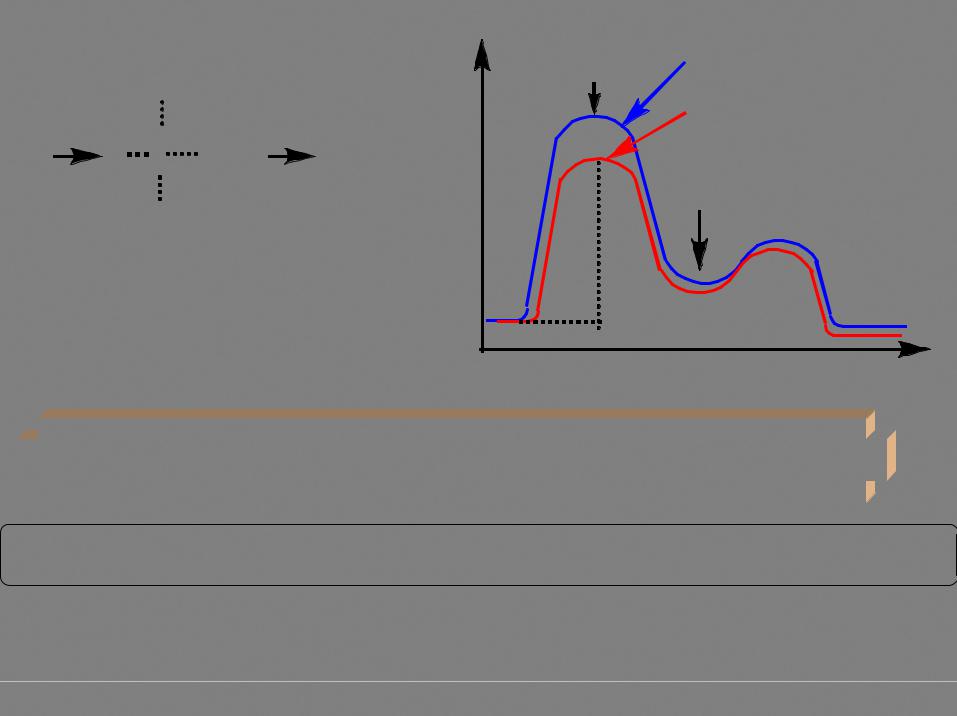
19
|
|
|
|
переходное |
апротонный |
|
|
H-Solv |
состояние |
растворитель |
|
|
|
|
протонный |
||
|
δ+ |
|
- |
|
|
RX |
Xδ |
R+solv.+ X-solv. |
растворитель |
||
R |
H-Solv |
|
|||
|
|
H-Solv |
|
карбокатион |
|
|
|
|
|
||
|
переходное |
|
|
||
|
состояние |
|
|
||
3. Природа уходящей группы имеет значение, так как связь с ней рвется на  лимитирующей стадии. Чем ниже основность, тем лучше уходящая группа.
лимитирующей стадии. Чем ниже основность, тем лучше уходящая группа. 
Протонирование гидроксильной группы – электрофильный катализ замещения по SN1 (переход от основного гидроксид-аниона к малоосновной воде)
PhCH2Cl - активен и по SN1 и SN2
PhCHCl2 - менее активен по SN2 (стерические препятствия) и по SN1

HO- |
PhCCl3 |
H2SO4 (60%) |
|
Cl2 |
|
t |
Ph |
C |
|
|
|
ClH -HCl |
|
|
|
|
Cl |
|
|
Cl |
|
Cl |
Ph |
|
|
H+ |
OH |
|||
Ph |
OH |
|
|
||
Ph |
OH -HCl |
-H+ |
|||
|
Cl |
||||
|
|
ClH |
Cl |
||
|
|
|
|
Ph |
|
|
|
|
|
OH |
H2O |
R X Ag+ |
H2O |
RX |
|
|
Ag+ |
электрофильный катализ |
-AgX |
X = галоген |
ионами серебра |
-H+ |
Cl 20
Ph

Cl +H2O
Cl |
-H+ |
|
|
||
Ph |
|
|
Cl |
|
|
Cl |
|
|
Ph |
дальнейший |
|
O |
||
гидролиз |
||
хлористый |
|
|
бензоил |
|
ROH
4.Природа нуклеофила значения не имеет – взаимодействие его с карбокатионом происходит на нелимитирующей стадии.
