
Лекции / organic_2011_1
.pdf
Свойства алканов |
|
|
|
Неполярные связи – инертность, |
60 |
||||||||||||||||||||||
возможность протекания только радикальных |
|
|
|
|
|||||||||||||||||||||||
реакций |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
1. Горение |
|
|
|
|
|
|
O2 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
CnH2n+2 |
nCO2 |
+ (n+1)H2O + Q |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
2. Галогенирование |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
CH4 |
|
Cl2 |
|
CH |
Cl + CH |
Cl |
+ |
CHCl3 |
+ CCl |
|
+ HCl |
+ |
C H |
|
и др. |
|
|||||||||||
|
|
|
|
|
|
4 |
6 |
|
|||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
hν |
3 |
|
|
|
2 |
2 |
|
|
|
2 |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Cl2 |
|
hν |
2Cl |
|
|
|
|
|
|
инициирование |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
CH4 |
+ Cl |
|
|
|
|
|
CH |
+ HCl |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
рост цепи |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
CH |
+ Cl |
2 |
|
|
|
|
CH3Cl + Cl |
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2Cl |
|
|
|
|
|
|
Cl2 |
CH3Cl |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
+ Cl |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
CH3 |
|
|
|
|
|
|
обрыв цепи |
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
2CH3 |
|
|
|
|
|
C2H6 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||

|
H |
|
|
|
H |
|
|
|
H |
61 |
|
|
|
|
|
|
|
|
|||
H |
C |
H |
Cl |
H |
C |
Cl |
Cl |
H |
C |
Cl |
|
H |
|
-HCl |
H |
|
-Cl |
|
H |
|
|
|
|
|
|
|
|
|
|
|||
CH4 |
+ Cl |
CH3 |
+ HCl |
|
Лимитирующая стадия реакции |
|||||
CH3 |
+ Cl2 |
CH3Cl + Cl |
|
|
|
|
|
|
||
E |
|
переходное состояние (активированный комплекс) |
||||||||
|
|
|
|
промежуточный продукт (метильный радикал) |
||||||
энергия |
|
|
|
|
|
|
|
|
|
|
активации |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
продукты реакции |
|
|
|
||
|
|
|
координата реакции |
|
|
|
|
|||
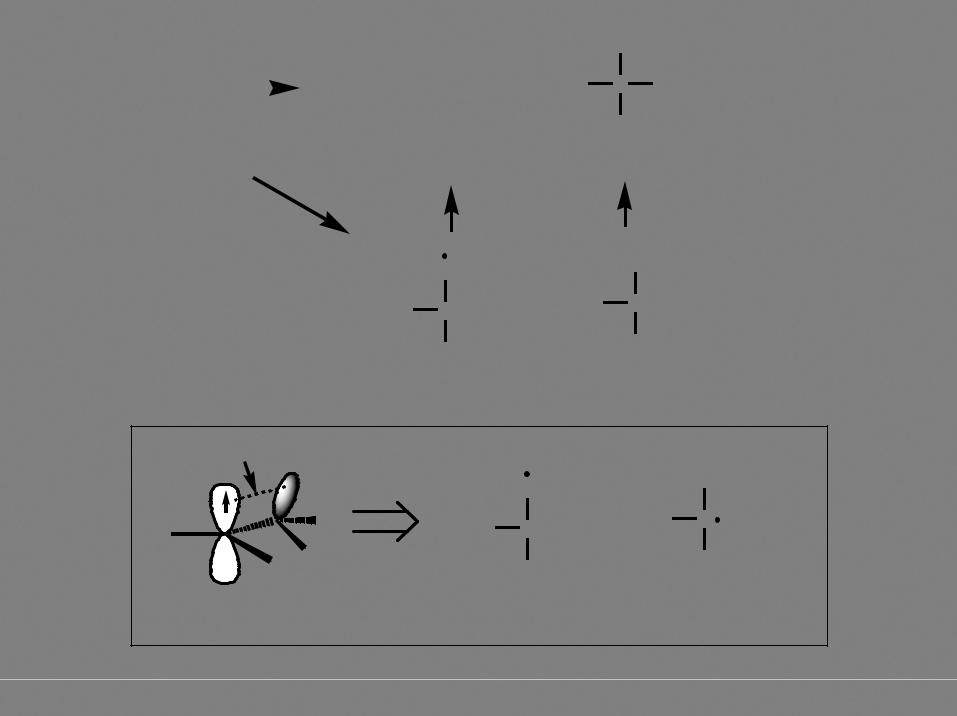
|
|
CH3 |
Cl2 |
|
|
CH2Cl |
|
|||
|
|
|
|
|
|
|
|
|
||
H C |
|
|
CH |
|
|
H3C |
|
|
CH + |
H3C |
|
|
|
|
|
||||||
|
|
|
|
|
||||||
3 |
|
|
|
hν |
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
9 |
: |
|||
CH2
H3C CH + H3C
CH3
62
CH3
C Cl
CH3
5 а не 9:1!
CH3
C 
CH3
сопряжение H |
CH3 |
CH2 |
|
H3C CH |
H3C C |
CH3 |
CH3 |
|
более устойчивый |
|
радикал |



 63
63
Увеличение устойчивости радикала приводит к снижению величины энергии активации и, как следствие, к увеличению скорости реакции!
E 
первичный радикал
продукты реакции
 третичный радикал
третичный радикал
В случае хлорирования соотношение скоростей составляет: третичный : вторичный : первичный = 5 : 4 : 1
В случае бромирования соотношение скоростей составляет: третичный : вторичный : первичный = 200 : 10 : 1
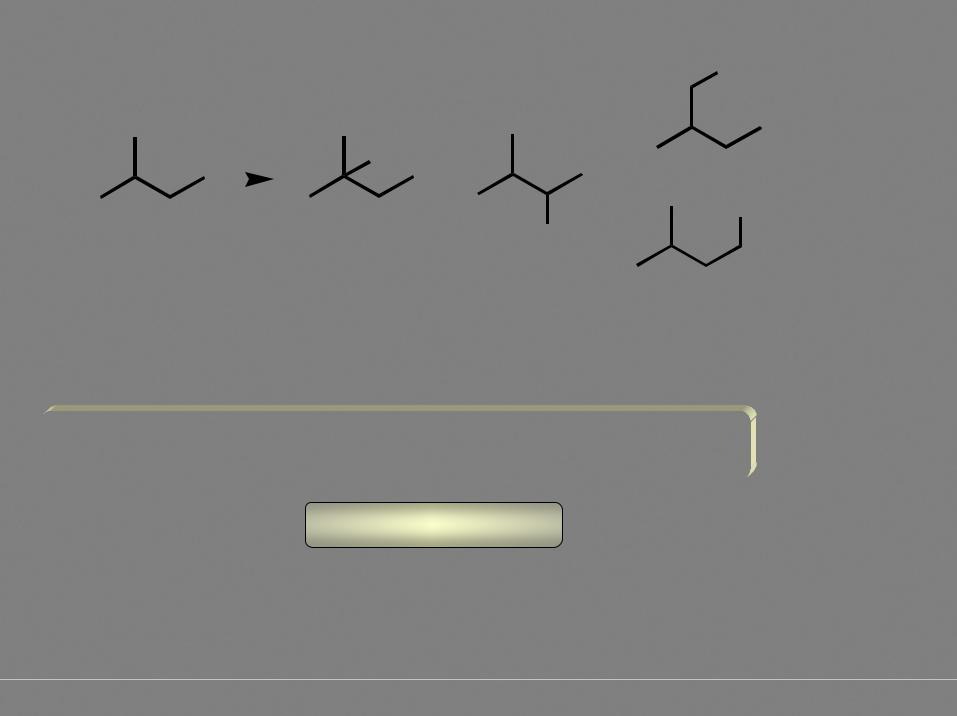
64
Пример расчета соотношения продуктов моногалогенирования
Cl
|
|
Cl2 |
Cl |
+ |
|
|
+ |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||
|
|
hν |
А |
|
|
Cl |
||||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
Б |
|
В+Г |
||
|
|
|
|
|
|
|
|
|
||
соотношение продуктов |
А : Б : (В+Г) = 1х5 : 2х4 : 9х1 = 5 : 8 : 9 |
|||||||||
монохлорирования |
|
|
|
|
|
|
|
|||
Иодирование алканов не происходит,  при фторировании алканов происходит разрыв всех связей С-С
при фторировании алканов происходит разрыв всех связей С-С
CH4 + F2  взрыв!
взрыв!
F2
CoF2  CoF3
CoF3
CoF3
CnH2n+2  nCF4 + (2n+2)HF
nCF4 + (2n+2)HF

65
Снижение температуры повышает селективность реакции

66
3. Сульфохлорирование
CH4 + SO2 + Cl2 |
hν CH3SO2Cl |
|
|
|
|||||||||||||||
Cl2 |
hν |
2Cl |
|
|
|
|
|
|
|
|
|
инициирование |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
лимитирующая CH4 |
+ Cl |
|
|
|
|
|
CH |
3 |
|
+ HCl |
|
|
|
||||||
|
|
|
|
|
|
||||||||||||||
стадия |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
рост цепи |
||||
CH |
3 |
SO |
2 |
|
|
|
|
|
CH SO |
2 |
|||||||||
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|||||
CH3SO2 |
+ Cl2 |
|
|
|
|
CH3SO2Cl + Cl |
|
NaOH |
|||||||||||
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
hν |
|
|
|||
C H |
|
|
+ SO |
2 |
+ Cl2 |
|
|
CnH2n+2SO2Cl |
|
CnH2n+1SO3Na |
|||||||||
|
|
|
|
|
|||||||||||||||
n 2n+2 |
|
|
|
|
|
|
|
|
|
|
|
|
H2O |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
алкилсульфонаты - ПАВ (синтетические моющие средства, детергенты)
Соотношение продуктов хлорирования и сульфохлорирования совпадает при одинаковых условиях.

4. Нитрование |
|
|
|
|
|
|
|
|
67 |
|||||
о |
|
140o |
|
|
||||||||||
|
CH4 |
|
|
500 |
|
|
|
|||||||
|
+ HNO3 (конц.) |
|
CH NO |
2 |
|
|
CH4 + HNO |
3 |
(разб.) |
|||||
|
|
|
|
|||||||||||
|
|
|
|
|
|
3 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
парофазное нитрование |
||
|
HNO3 |
t |
|
NO2 + OH |
|
|
|
|
|
|
по Коновалову |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||
NO2 + CH4  HNO2 + CH3
HNO2 + CH3
HNO2 + HNO3  2NO2 + H2O
2NO2 + H2O
CH3 + NO2  CH3NO2
CH3NO2
5. Окисление в гидроперекиси
H |
O2 |
|
O |
|||||
|
|
|
|
|||||
Co2+ |
||||||||
|
|
O |
|
H гидроперекись трет-бутила |
||||
|
|
|
||||||
O2 |
|
-НO2 |
|
H _ |
|
|
|
||||
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
O2
O
O
кислород - бирадикал
реакция происходит с образованием только устойчивого - третичного алкильного радикала
В реакцию вступают и другие субстраты, способные образовывать сравнительно устойчивые радикалы – аллильные и бензильные

6. Дегидрирование |
|
Cr2O3 |
|
|
|
68 |
||||
|
|
|
|
CnH2n+2 |
CnH2n |
+ H2 |
|
|
||
|
|
|
|
300-400o |
|
|
||||
|
|
|
|
|
|
|
|
|
||
7. Крекинг |
|
H3C CH3 |
t |
2CH3 |
|
|
|
|||
|
|
|
CH3 + H3C CH3 |
|
H2C CH2 + CH4 |
|
||||
|
|
|
H2C CH3 |
|
H2C |
CH2 |
+ 1/2H |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
β |
|
α |
|
β-распад |
|
CH2CH2 |
+ CH =CHCH R |
||
RCH CH CH |
2 |
CH |
CHCH R |
|
RH2C |
|||||
2 |
2 |
2 |
2 |
|
|
|
|
2 |
2 |
|
β-распад
CH2=CH2 + RCH2CH2CH2
8. Окислительная деструкция
RCH2CH2R' |
O2 |
|
RCO |
H |
+ |
R'CO |
H |
|
|
||||||
|
Mn(OAc) , 100-150o |
2 |
|
|
2 |
|
|
|
|
|
|
|
|
||
|
2 |
|
|
|
|
|
|
O2/CoAc2
C4H10  AcOH
AcOH
170-180o, 50 атм 50%

69
9. Взаимодействие с метиленом (карбеном)
H C N N |
hν CHs |
CH2t |
|
|
|
|
|
2 |
2 |
|
|
|
|
|
|
диазометан |
- N2 |
|
|
|
|
|
|
|
|
|
синглетный |
|
триплетный |
||
|
|
|
карбен (s) |
|
карбен (t) |
||
H |
s |
H |
|
H |
|
H2C |
H |
|
|
|
|||||
C2 |
CH2 |
C2 |
C |
C2 |
+ |
CH |
и др. |
H3C |
CH3 |
H3C |
H |
CH3 |
|||
|
|
|
H2 |
|
H3C |
||
неселективное внедрение синглетного карбена по связям С-Н
|
H2 |
|
s |
|
|
H2 |
|
|
H |
|
|
H |
|
C |
CH |
|
|
|
|
|
|
|
|
2 |
|
|
2 |
|
|
C |
|
|
C |
|
|
C |
||
H3C |
CH3 |
|
CH3 |
+ H |
C |
CH |
H C |
CH |
H C |
|||
|
||||||||||||
|
|
|
|
2 |
|
|
3 |
3 |
|
3 |
CH |
|
|
|
|
|
|
|
|
|
|
|
|
3 |
2 |
