
- •Методическая разработка
- •Тема: «Гидролиз солей»
- •I. Организационный момент
- •II. Актуализация опорных знаний
- •III. Изучение нового материала
- •2. Лабораторная работа «Определение характера среды в водных растворах некоторых солей».
- •3.Изучение процесса гидролиза солей
- •4. Составление уравнений гидролиза
- •IV. Первичная проверка понимания
- •V. Закрепление знаний
- •VI.Контроль знаний
- •Тест «Гидролиз солей»
- •1 Вариант
- •Рабочий лист Тема занятия: Гидролиз солей
3.Изучение процесса гидролиза солей
При растворении веществ в воде происходит взаимодействие растворенного вещества с молекулами воды. Это взаимодействие приводит к реакциям гидролиза.
Реакции обменного разложения веществ водой называются реакциями гидролиза.
Гидролизу подвергаются различные вещества: неорганические - соли, карбиды и гидриды металлов, галогениды неметаллов; органические - сложные эфиры, жиры, белки, углеводы. Гидролиз органических веществ
имеет большое биологическое значение для живых организмов. Из курса общей биологии вспомните, что происходит в живых организмах со сложными органическими веществами? (В живых организмах происходит ферментативный гидролиз жиров, белков и углеводов).
Обратить внимание: В лабораторной работе исследовались разные по составу соли. Разберем состав исследуемых солей.
Nа2 CO3
NaOH H2CO3
сильное слабая осн-ние кислота
А1Cl3
А1(ОН)3 HCl
слабое сильная
осн-ние кислота
NaСI
NaOH HCI
сильное сильная осн-ние кислота
Соль можно рассматривать как продукт взаимодействия кислоты и основания. В зависимости от вида кислоты и вида основания выделяют четыре типа солей:
1.Соль, образованная сильным основанием и слабой кислотой
2.Соль, образованная слабым основанием и сильной кислотой
3.Соль, образованная слабым основанием и слабой кислотой
4.Соль, образованная сильным основанием и сильной кислотой
4. Составление уравнений гидролиза
Рассмотрим процессы, происходящие в растворах исследуемых солей.
1) К какому типу солей относится карбонат натрия? Соль, образованная сильным основанием и слабой кислотой.

Карбонат-ионы прочно связывают катионы водорода, так как угольная кислота слабая. Катионы натрия не могут быть связаны гидроксид-ионами, так как гидроксид натрия – сильное основание и диссоциирует полностью.
![]()

Уравнение показывает, что:
в растворе есть свободные гидроксид-ионы ОН- и их концентрация больше, чем в чистой воде, поэтому раствор соли имеет щелочную среду,
в реакции с водой участвуют анионы СО-2; в таком случае говорят, что идет гидролиз по аниону.
2) К какому типу солей относится хлорид алюминия? Соль, образованная слабым основанием и сильной кислотой.

![]()
![]()
![]()
Уравнение показывает, что:
в растворе есть свободные ионы водорода Н+ и их концентрация больше чем в чистой воде, поэтому раствор соли имеет кислотную среду;
в реакции с водой участвуют катионы А13+; в таком случае говорят, что идет гидролиз по катиону.
3) К какому типу солей относится хлорид натрия? Соль, образованная сильным основанием и сильной кислотой.
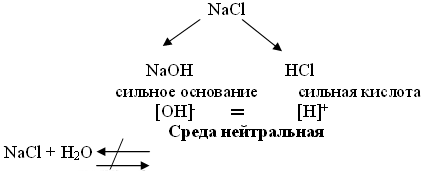
ΝаCl ↔ Νа+ + Cl - ; HOH ↔ H+ + OH-
В данном случае при диссоциации соли не образуются слабые ионы и, следовательно, не образуется слабый электролит. Все ионы останутся в растворе, они не могут объединяться, так как при этом не образуются слабые электролиты - гидролиз не происходит. Среда раствора нейтральная, так как концентрации ионов Н+ и ОН- в растворе равны, как в чистой воде.
4) Проблемный вопрос: А что происходит в растворах солей, образованных слабым основанием и слабой кислотой?
К какому типу солей относится ацетат аммония? Соль, образованная слабым основанием и слабой кислотой.
СН3СООΝН4 ↔ СН3СОО- +ΝН4+
HOH ↔H+- + OH-
Слабым ионом будут катион и анион. Гидролиз будет идти одновременно по катиону и аниону. СН3СООΝН4+ HOH ↔ СН3СООН+ ΝН4 ОН среда будет слабокислая или слабощелочная в зависимости от Кд кислоты или основания. Константы дссоциации уксусной кислоты и гидроксида аммония равны соответственно: К(СН3СООН) = 1,76×10-5 и К(NH4 ОН) = 1,79×10-5 => среда при гидролизе этой соли нейтральная.
Соль может подвергаться сразу полному и необратимому гидролизу, например, если образец соли Al2S3 опустить в воду, моментально происходит бурная реакция гидролиза:
Al2 S3 + 6H2O = 2Al(OH)3 + 3H2S
Этот гидролиз необратим, поэтому реакцией обмена в растворе Al2S3 получить нельзя. Вместо него образуются продукты гидролиза.
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3 + 3H2S + 6NaCl
На гидролиз влияет не только природа вещества, но и другие факторы, например разбавление раствора увеличение количества воды в растворе усиливает гидролиз. При нагревании гидролиз также усиливается.
Такие соли подвергаются гидролизу и по катиону, и по аниону.
Катион слабого основания связывает ионы ОН- из молекул воды, образуя слабое основание; анион слабой кислоты связывает ионы Н+ из молекул воды, образуя слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислотной или слабощелочной. Это зависит от констант диссоциации двух слабых электролитов - кислоты и основания, которые образуются в результате гидролиза.
