
- •1 Механическое движение. Система отсчета. Путь и перемещение.
- •2 Скорость. Ускорение
- •3 Вращательное движение, его кинематические и динамические характеристики
- •4 Сила и масса. Законы ньютона
- •5 Импульс силы и импульс тела. Закон сохранения импульса. Неупругий удар.
- •6 Работа и механическая энергия. Закон сохранения энергии в механике. Упругий удар.
- •7 Момент импульса. Закон сохранения момента импульса.
- •8 Гравитационное поле. Его напряженность и потенциал.
- •9 Принцип относительности галилея. Сложение скоростей.
- •10 Принцип относительности эйнштейна.
- •11 Идеальный газ уравнения состояния идеального газа.
- •12 Теплоемкость идеального гаа. Теплоемкость в изопроцессах.
- •13. Изотермический, изобарный, изохорный и адиабатный процессы в идеальных газах
- •14 Внутренняя энергия идеального газа. Работа газа и теплота.
- •15 Первое правило термодинамики. Его применение к изопроцессам.
- •16 Круговые процессы. Цикл карно.
- •17 Энтропия. Второе и третье начала термодинамики.
- •18 Распределение максвела по скоростям и энергиям. Наиболее вероятная, средняя арифметическая и средняя квадратичная скорости молекул.
- •19 Барометрическая формула. Распределение больцмана.
- •20 Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы.
- •21.Точечный электроический заряд.Закон сохранения электрического заряда.Закон кулона
- •22.Электростатическое поле, его напряженность и потенциал
- •23.Проводники в электростатическом поле.Электроемкость.Конденсаторы
- •24.Полярные и неполярные диэлектрики.Диэлектрическая проницаемость вещества.Электрическое смещение.Условия для электростатического поля на границе раздела сред
- •25.Энергия электростатического поля.Энергия заряженного конденсатора
- •26.Постоянный ток и его характиристики
- •27.Законы ома и джоуля-ленца.Дифференциальная форма законов ома и джоуля-ленца
- •28.Закон ома для полной цепи.Правила кирхгофа
- •29.Классические представления об электропроводимисти металлов
- •31. Магнитное поле и его характеристики
- •32.Закон био-савара-лапласа
- •33.Закон полного тока для магнитного поля
- •34.Работа сил магнитного поля по перемещению проводника с током.Магнитный поток
- •35.Энергия магнитного поля
- •36.Основной закон электромагнитной индукции
- •37.Самоиндукция.Индуктивность
- •38.Взаимная индукция.Трансформаторы
- •39.Гармонические колебания.Характеристики колебаний
- •40.Сложение гармонических колебаний.Биения
- •41.Электромагнитные волны.Шкала электромагнитных волн
- •42.Продольные и поперечные волны.Уравнение волны.Характеристики волн.Интерференция волн.Стоячие волны
- •43.Пространственная и временная когерентность.Интерференция света
- •44.Дифракция света
- •45.Поляризация света.Закон маллюса.Закон брюстера
- •46.Тепловое излучение.Законы теплового излучения абсолютно черного тела.Гипотеза планка
- •47.Фотоэффект.Виды фотоэффекта.Законы столетова.Уравнение эйнштейна для внешнего фотоэффекта. Эффект комптона
- •48.Опыты резерфорда.Планетарная модель атома
- •49.Гипотеза де бройля и её эксперементальное подтверждение
- •50.Соотношение неопределенностей.Уравнение шредингера
- •51.Пространственное квантование.Опыт штена и герлаха.Спин электрона
- •52.Спектр атома водорода.Электронные оболочки.Квантовые числа
- •53.Строение ядра.Дефект массы,энергия связи ядра
- •54.Радиоактивность.Активность,постоянная распада,период полураспада.Закон радиоактивного распада.
- •57.Ядерные реакции.Цепная реакция деления ядер.Реакции термоядерного синтеза.
- •58.Дозиметрические величины.Приборы для измерения уровня радиации
- •59.Классификация элементарных частиц
- •60.Понятие о кварках
52.Спектр атома водорода.Электронные оболочки.Квантовые числа
Спектральные серии водорода — набор спектральных серий, составляющих спектр атома водорода. Поскольку водород — наиболее простой атом, его спектральные серии наиболее изучены. Они хорошо подчиняются формуле Ридберга:
![]() ,
,
где R = 109 677 см−1 — постоянная Ридберга для водорода, n′ — основной уровень серии.
Спектральные линии, возникающие при переходах на основной энергетический уровень, называются резонансными, все остальные — субординатными.
Электронная оболочка атома— область пространства вероятного местонахожденияэлектронов, характеризующихся одинаковым значениемглавного квантового числаn и, как следствие, располагающихся на близкихэнергетических уровнях. Число электронов в каждой электронной оболочке не превышает определенного максимального значения.
Порядок заполнения электронных оболочек (орбиталейс одинаковым значением главного квантового числа n) определяетсяправилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталейс одинаковыми значениямиглавного квантового числаn иорбитального квантового числаl) определяетсяПравилом Хунда.
Ква́нтовое число́ в квантовой механике— численное значение какой-либо квантованной переменной микроскопического объекта (элементарной частицы,ядра,атомаи т. д.), характеризующее состояние частицы. Задание квантовых чисел полностью характеризует состояние частицы.
Некоторые
квантовые числа связаны с движением в
пространстве и характеризуют вид волновой
функциичастицы. Это, например, радиальное
(главное) (![]() ),орбитальное(
),орбитальное(![]() ),магнитное(
),магнитное(![]() )
испиновое
числоквантовые числа электрона
в атоме, которые определяются как число
узлов радиальной волновой функции,
значение орбитального углового момента,
его проекция на заданную ось и спин
частицы, соответственно.
)
испиновое
числоквантовые числа электрона
в атоме, которые определяются как число
узлов радиальной волновой функции,
значение орбитального углового момента,
его проекция на заданную ось и спин
частицы, соответственно.
Некоторые другие квантовые числа никак не связаны с перемещением в обычном пространстве, а отражают «внутреннее» состояние частицы. К таким квантовым числам относится спини его проекция. Вядерной физикевводится такжеизоспин, а вфизике элементарных частицпоявляетсяцвет,очарование,прелесть(или красота[1]) иистинность.
53.Строение ядра.Дефект массы,энергия связи ядра
В
1932г. после открытия протона и нейтрона
учеными Д.Д. Иваненко (СССР) и В. Гейзенберг
(Германия) была выдвинута протонно-нейтронная
модель ядра атома.
 Согласно
этой модели:
- ядра всех химических
элементов состоят из нуклонов:
протонов и нейтронов
- заряд ядра
обусловлен только протонами
- число
протонов в ядре равно порядковому номеру
элемента
- число нейтронов равно
разности между массовым числом и числом
протонов (N=A-Z)
Условное обозначение
ядра атома химического элемента:
Согласно
этой модели:
- ядра всех химических
элементов состоят из нуклонов:
протонов и нейтронов
- заряд ядра
обусловлен только протонами
- число
протонов в ядре равно порядковому номеру
элемента
- число нейтронов равно
разности между массовым числом и числом
протонов (N=A-Z)
Условное обозначение
ядра атома химического элемента:
 X
– символ химического элемента
А
– массовое число, которое показывает
:
- массу ядра в целых атомных
единицах массы (а.е.м.)
(1а.е.м. =
1/12 массы атома углерода)
- число
нуклонов в ядре
- (A = N + Z) , где N –
число нейтронов в ядре атома
Z
– зарядовое число, которое показывает:
-
заряд ядра в элементарных электрических
зарядах (э.э.з.)
( 1э.э.з. = заряду электрона
= 1,6 х 10 -19 Кл)
- число протонов
- число
электронов в атоме
- порядковый номер
в таблице Менделеева
Масса ядра всегда
меньше суммы масс покоя свободных
протонов и нейтронов, его составляющих.
Это
объясняется тем, что протоны и нейтроны
в ядре очень сильно притягиваются друг
к другу. Чтобы разъединить их требуется
затратить большую работу. Поэтому полная
энергия покоя ядра не равна энергии
покоя составляющих его частиц. Она
меньше на величину работы по преодолению
ядерных сил притяжения.
Разность между
массой ядра и суммой масс протонов и
нейтронов называется дефектом масс.
X
– символ химического элемента
А
– массовое число, которое показывает
:
- массу ядра в целых атомных
единицах массы (а.е.м.)
(1а.е.м. =
1/12 массы атома углерода)
- число
нуклонов в ядре
- (A = N + Z) , где N –
число нейтронов в ядре атома
Z
– зарядовое число, которое показывает:
-
заряд ядра в элементарных электрических
зарядах (э.э.з.)
( 1э.э.з. = заряду электрона
= 1,6 х 10 -19 Кл)
- число протонов
- число
электронов в атоме
- порядковый номер
в таблице Менделеева
Масса ядра всегда
меньше суммы масс покоя свободных
протонов и нейтронов, его составляющих.
Это
объясняется тем, что протоны и нейтроны
в ядре очень сильно притягиваются друг
к другу. Чтобы разъединить их требуется
затратить большую работу. Поэтому полная
энергия покоя ядра не равна энергии
покоя составляющих его частиц. Она
меньше на величину работы по преодолению
ядерных сил притяжения.
Разность между
массой ядра и суммой масс протонов и
нейтронов называется дефектом масс.
ЭНЕРГИЯ СВЯЗИ АТОМНЫХ ЯДЕР
Ядра атомов представляют собой сильно связанные системы из большого числа нуклонов. Для полного расщепления ядра на составные части и удаление их на большие расстояния друг от друга необходимо затратитьопределенную работу А. Энергией связи называют энергию, равную работе, которую надо совершить, чтобы расщепить ядро на свободные нуклоны. Е связи = - А По закону сохранения энергия связи одновременно равна энергии, которая выделяется при образовании ядра из отдельных свободных нуклонов. Удельная энергия связи - это энергия связи, приходящаяся на один нуклон.
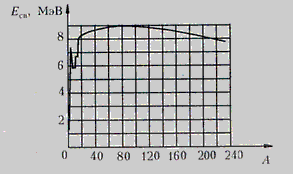
Если не считать самых легких ядер, удельная энергия связи примерно постоянна и равна 8 МэВ/нуклон. Максимальную удельную энергию связи (8,6МэВ/нуклон) имеют элементы с массовыми числами от 50 до 60. Ядра этих элементов наиболее устойчивы.
По мере перегрузки ядер нейтронами удельная энергия связи убывает. Для элементов в конце таблицы Менделеева она равна 7,6 МэВ/нуклон (например для урана). Выделение энергии в результате расщепления или синтеза ядра
Для того, чтобы расщепить ядро надо затратить определенную энергию для преодоления ядерных сил. Для того, чтобы синтезировать ядро из отдельных частиц надо преодолеть кулоновские силы отталкивания (для этого надо затратить энергию, чтобы разогнать эти частицы до больших скоростей). То есть, чтобы провести расщепление ядра или синтез ядра надо затратить какую-то энергию. При синтезе ядра на малых расстояниях на нуклоны начинают действовать ядерные силы, которые побуждают их двигаться с ускорением. Ускоренные нуклоны излучают гамма-кванты, которые и обладают энергией, равной энергии связи. На выходе реакции расщепления ядра или синтеза энергия выделяется. Есть смысл проводить расщепление ядра или синтез ядра, если получаемая, т.е. выделенная энергия в результате расщепления или синтеза, будет больше, чем затраченная. Согласно графику, выйгрыш в энергии можно получить или при делении (расщеплении) тяжелых ядер, или при при слиянии легких ядер, что и делается на практике.
ДЕФЕКТ МАСС
Измерения масс ядер показывают, что масса ядра (Мя) всегда меньше суммы масс покоя слагающих его свободных нейтронов и протонов. При делении ядра: масса ядра всегда меньше суммы масс покоя образовавшихся свободных частиц. При синтезе ядра: масса образовавшегося ядра всегда меньше суммы масс покоя свободных частиц, его образовавших.
![]() Дефект
масс является мерой энергии
связи атомного ядра.
Дефект
масс равен разности между суммарной
массой всех нуклонов ядра в свободном
состоянии и массой ядра:
Дефект
масс является мерой энергии
связи атомного ядра.
Дефект
масс равен разности между суммарной
массой всех нуклонов ядра в свободном
состоянии и массой ядра:
![]() где
Мя – масса ядра ( из справочника)
Z –
число протонов в ядре
mp – масса
покоя свободного протона (из справочника)
N
– число нейтронов в ядре
mn – масса
покоя свободного нейтрона (из
справочника)
Уменьшение массы при
образовании ядра означает, что при этом
уменьшается энергия системы нуклонов.
где
Мя – масса ядра ( из справочника)
Z –
число протонов в ядре
mp – масса
покоя свободного протона (из справочника)
N
– число нейтронов в ядре
mn – масса
покоя свободного нейтрона (из
справочника)
Уменьшение массы при
образовании ядра означает, что при этом
уменьшается энергия системы нуклонов.
