
- •Лабораторный практикум по физике с компьютерными моделями
- •Часть III
- •«Оптика, атомная и ядерная»
- •Введение
- •Раздел V
- •Порядок выполнения лабораторной работы
- •Примерные значения длины волны
- •Дифракционная решетка
- •Краткая теория
- •Порядок выполнения лабораторной работы
- •Примерные значения длины волны
- •Контрольные вопросы
- •Проверка закона малюса
- •Порядок выполнения лабораторной работы
- •Контрольные вопросы
- •Внешний фотоэффект
- •Порядок выполнения лабораторной работы
- •Значения запирающего напряжения
- •Значения работы выхода для некоторых материалов
- •Значения длины волны падающего излучения
- •Контрольные вопросы
- •Комптоновское рассеивание
- •Краткая теория
- •Порядок выполнения лабораторной работы
- •Контрольные вопросы
- •Постулаты бора. Спектр излучения атома водорода
- •Контрольные вопросы
- •Упругое рассеяние нерелятивистской частицы в отсутствии силовых полей
- •Краткая теория
- •Порядок выполнения лабораторной работы
- •Значение массы соударяющихся шаров и начальной скорости снаряда
- •Результаты измерений
- •Контрольные вопросы
- •Содержание
- •Раздел V
- •Лабораторный практикум по физике
Постулаты бора. Спектр излучения атома водорода
Цель работы:
экспериментальное подтверждение закономерностей формирования линейчатого спектра излучения атомарного водорода при низких давлениях с помощью виртуальной модели
экспериментальное определение постоянной Ридберга с помощью виртуальной модели.
Приборы и принадлежности:
персональный компьютер
компьютерные модели «Открытая физика 1.1».
Краткая теория
В настоящее время установлено, что атомы являются сложными частицами, состоящих из отрицательно заряженных электронов, положительно заряженных протонов и незаряженных нейтронов. Это квантово-механическая модель атома. Она базируется на законах квантовой физики, согласно которым энергия колебаний связанных атомных электронов квантуется, т.е. принимает определенные значения. Этим значениям сопоставляют энергетические уровни и говорят: атом (молекула) находится на энергетическом уровне.
Электрон – это частица, имеющая наименьший отрицательный заряд, равный е = 1,602110-19 Кл и массу покоя mе = 9,10910-31 кг. Протон имеет массу mp = 1,6605710-27 кг и несет элементарный положительный заряд. Нейтрон не имеет заряда, а его масса немного меньше массы протона.
При изучении большинства физических явлений достаточно классических представлений о строении атома, т. е. использование планетарной (ядерной) модели атома Резерфорда-Бора: в центре атома расположено очень малое положительно заряженное ядро, вокруг которого по определенным (разрешенным) стационарным орбитам движутся электроны, масса которых во много раз меньше массы ядра.
Н. Бор предложил для атома водорода и водородоподобных ионов теорию, которая основывалась на планетарной модели атома и трехегопостулатах:
Атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует своя энергия; в стационарном состоянии атом не излучает и не поглощает энергию.
При переходе из одного энергетического состояния в другое испускается или поглощается квант энергии, величина которого равна разности энергий:
E = h=E2 – E1, (1)
где h = 6,62 ·10 – 34 Дж×с. При переходе электрона на более удаленную орбиту от ядра атом поглощает квант энергии. При переходе с орбиты более удаленной от ядра на ближнюю орбиту электрон излучает квант энергии.
Из всех возможных орбит стационарное состояние соответствует только тем, для которых момент количества движения электрона кратен постоянной Планка
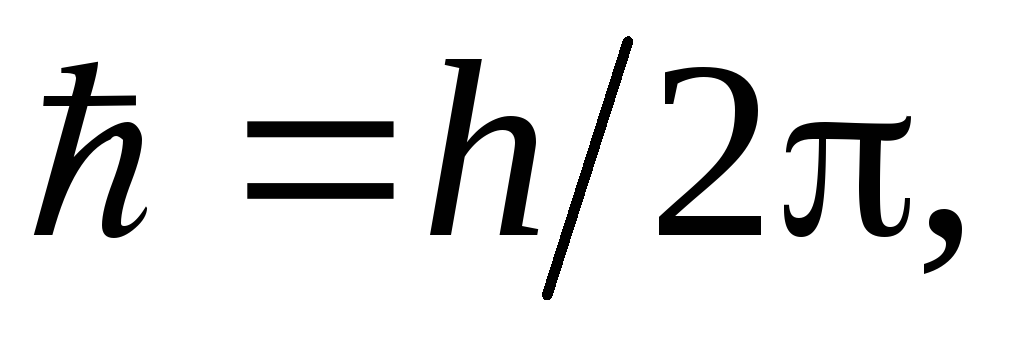 т.е.
т.е.
![]() (2)
(2)
где
![]() ,
,![]() ,
,![]() –
масса, скорость и радиус орбиты электрона;
n
– целое
число, соответствующее порядковому
номеру орбиты и называемое главным
квантовым числом.
Условие (2) называется правилом
квантования орбит Бора.
Для движения электрона в атоме водорода
на стационарной орбите правило
квантования имеет вид
–
масса, скорость и радиус орбиты электрона;
n
– целое
число, соответствующее порядковому
номеру орбиты и называемое главным
квантовым числом.
Условие (2) называется правилом
квантования орбит Бора.
Для движения электрона в атоме водорода
на стационарной орбите правило
квантования имеет вид
![]() .
.
Спектром электромагнитного излученияназывается совокупность электромагнитных волн, излучаемых или поглощаемых атомами (молекулами) данного вещества.
Линейчатый спектр состоит из резко очерченных цветных линий, отделённых друг от друга широкими тёмными промежуткам. Линейчатые спектры излучаются отдельными возбуждёнными атомами, не взаимодействующими друг с другом. Излучение обусловлено переходами связанных электронов на более низкие энергетические уровни (орбиты).
Полосатыйспектрсостоит из большого числа линий, расположенных отдельными группами. Полосатые спектры излучаются отдельными возбуждёнными молекулами. Излучение вызвано как электронными, так и колебательными движениями самих атомов в молекуле.
Сплошной спектр состоит из всех цветов, причём переход от одного цвета к другому совершается постепенно (непрерывно). Сплошные спектры испускаются совокупностями многих взаимодействующих между собой молекулярных и атомных ионов.
Движение электрона в атоме водорода по круговой орбите радиусом r описывается уравнением:
![]() .
(3)
.
(3)
Правая часть
уравнения (3) есть кулоновская сила
взаимодействия двух зарядов: электрона
e
и ядра Ze,
а величина
![]() характеризует центростремительное
ускорение электрона. Подстав в уравнение
(3) выражение для скорости из уравнения
(2) и найдем радиусn-орбиты:
характеризует центростремительное
ускорение электрона. Подстав в уравнение
(3) выражение для скорости из уравнения
(2) и найдем радиусn-орбиты:
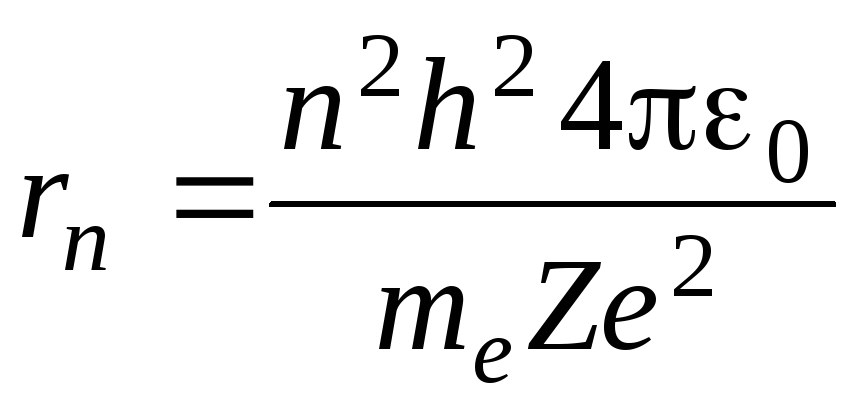 .
(4)
.
(4)
Для атома водорода радиус первой орбиты электрона (первый боровский радиус) равен
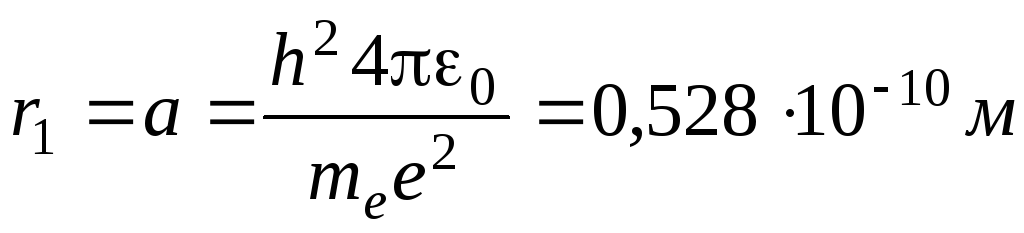 .
(5)
.
(5)
Из (4) и (5) видно,
что радиусы орбит растут пропорционально
квадратам главных квантовых чисел:
![]() .
.
Полная энергия
электрона, движущегося по орбите, равна
сумме потенциальной энергии в
электростатическом поле ядра (![]() )
и кинетической энергии (
)
и кинетической энергии (![]() ):
):
![]() ,
(6)
,
(6)
где
![]() .
Подставив в уравнение (6) выражение (4),
получим, что энергия электрона может
принимать только следующие дискретные
значения:
.
Подставив в уравнение (6) выражение (4),
получим, что энергия электрона может
принимать только следующие дискретные
значения:
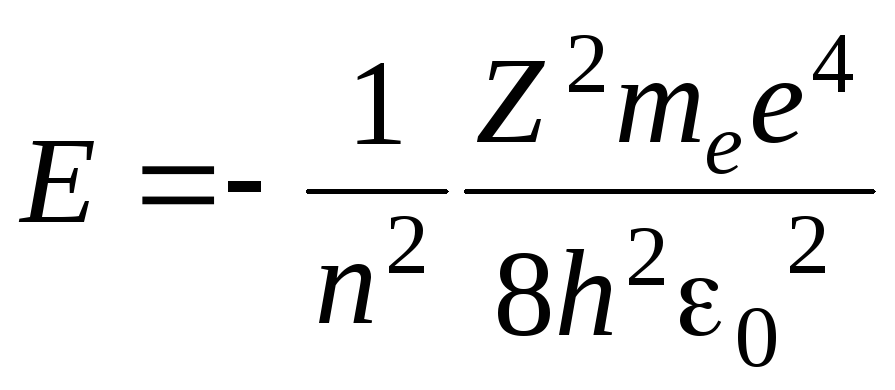 ,
(7)
,
(7)
где знак минус означает, что электрон находится в связанном состоянии. Потенциальная энергия является отрицательной, т. к. энергия притяжения в данном случае считается отрицательной. Она зависит от расстояния электрона до ядра и убывает при приближении электрона к ядру.
Энергетический уровень с n = 1 называют основным состоянием. Уровни, для которых n > 1, называются возбужденными состояниями. Атом водорода обладает минимальной энергией (Е1= –13,55 эВ) при n = 1. Согласно второму постулату Бора при переходе атома водорода из стационарного состояния n в состояние m с меньшей энергией испускается квант энергии:
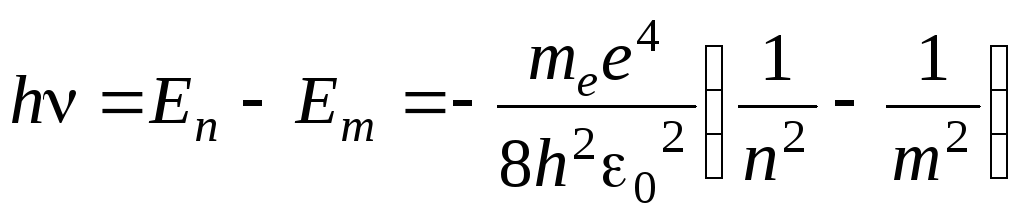 ,
,
откуда частота излучения
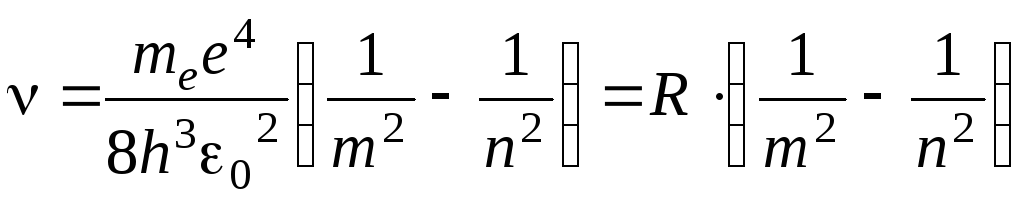 ,
(8)
,
(8)
где
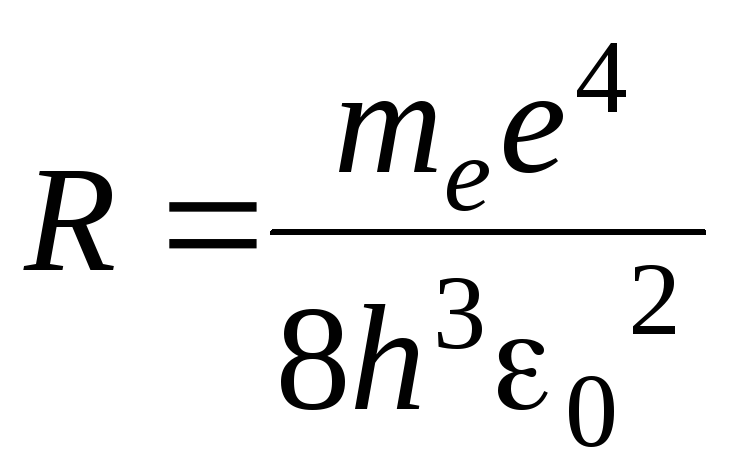 – постоянная Ридберга,
n
= 1, 2, 3, 4, 5… определенное для каждой
спектральной серии, а внутри серии m
принимает
ряд значений, начиная с (n
+ 1).
– постоянная Ридберга,
n
= 1, 2, 3, 4, 5… определенное для каждой
спектральной серии, а внутри серии m
принимает
ряд значений, начиная с (n
+ 1).
Спектральной серией называется совокупность линий излучения, соответствующих переходу в атоме на один и тот же нижний уровень энергии. Спектральные линии серии Лаймана излучаются атомом водорода при переходе электронов со второй, третьей, четвертой и т. д. орбит на первую и наоборот; линии серии Бальмера излучаются атомом водорода при переходе электронов с третьей, четвертой, пятой и т. д. орбит на вторую и наоборот; линии серии Пашена излучаются атомом водорода при переходе электрона с четвертой пятой, шестой и т. д. орбит на третью и наоборот. Линий серии Брэккета в спектре излучения атома водорода нет. Формула (8) называется обобщенной формулой Бальмера. Спектральный терм связан с энергией атома формулой
![]() ,
,
![]() .
.
С учетом понятия спектральных термов выражение (8) принимает вид,
![]() .
(9)
.
(9)
В. Ритц сформулировал комбинационный принцип:
Все линии в спектре излучения атома могут быть представлены как комбинации спектральных термов.
Подставляя в (9) различные значения m и n получим серии Лаймана, Бальмера, Пашена и другие серии линий в спектре водорода, наблюдаемые ранее И. Бальмером.
Состояние
электрона в атоме водорода описывается
волновой
функцией
![]() ,
удовлетворяющейстационарному
уравнению Шредингера:
,
удовлетворяющейстационарному
уравнению Шредингера:
![]() ,
(10)
,
(10)
где
![]() – оператор Лапласа,E
– полная энергия электрона,
– оператор Лапласа,E
– полная энергия электрона,![]() – удовлетворяет требованиям определенности,
конечности и непрерывности. В результате
решения уравнения (10) получаем, что
волновая функция зависит не только от
координаты
– удовлетворяет требованиям определенности,
конечности и непрерывности. В результате
решения уравнения (10) получаем, что
волновая функция зависит не только от
координаты![]() и времениt,
но и от четырёх параметров, имеющих
дискретный набор значений и называемых
квантовыми
числами:
главное,
азимутальное, магнитное и спиновое
квантовые числа.
и времениt,
но и от четырёх параметров, имеющих
дискретный набор значений и называемых
квантовыми
числами:
главное,
азимутальное, магнитное и спиновое
квантовые числа.
Решение уравнения Шредингера приводит к появлению дискретных энергетических уровней, удовлетворяющих формуле
![]() ,
(11)
,
(11)
где n = 1, 2, 3… совпадает с уровнями энергии в модели атома Бора и является главным квантовым числом. Оно определяет величину энергии электрона в атоме:
![]() ,
(12)
,
(12)
где Еi – энергия ионизации атома водорода (13, 6 эВ). Электроны с одинаковым главным квантовым числом n образуют электронные оболочки, которые обозначаются:
n = 1 2 3 4 5 .
K L M N O
Решение уравнения Шредингера (11) для водородоподобных систем показывает, что момент импульса электрона в атоме квантуется:
![]() ,
(13)
,
(13)
где
![]() = 0, 1, 2 ..(n
– 1) –
орбитальное
квантовое
или побочное
главное квантовое число,
определяющее форму орбиты и степень ее
возмущения. Состояние электрона,
обладающего различными значениями
орбитального квантового числа, в атомной
физике принято обозначать следующим
образом:
= 0, 1, 2 ..(n
– 1) –
орбитальное
квантовое
или побочное
главное квантовое число,
определяющее форму орбиты и степень ее
возмущения. Состояние электрона,
обладающего различными значениями
орбитального квантового числа, в атомной
физике принято обозначать следующим
образом:
![]() =
0 –s-состояние;
=
0 –s-состояние;
![]() =
1 –p-состояние;
=
1 –p-состояние;
![]() =
2 –d-состояние;
=
2 –d-состояние;
![]() =
3 –f-состояние.
Электроны с одинаковым орбитальным
числом
=
3 –f-состояние.
Электроны с одинаковым орбитальным
числом
![]() образуютэнергетический
подуровень.
образуютэнергетический
подуровень.
Магнитное
квантовое число
![]() характеризует положение плоскости
орбиты электрона во внешнем магнитном
поле, т.е. определяет проекцию вектора
момента импульса орбитального движения
электрона
на направление
внешнего магнитного поля
характеризует положение плоскости
орбиты электрона во внешнем магнитном
поле, т.е. определяет проекцию вектора
момента импульса орбитального движения
электрона
на направление
внешнего магнитного поля
![]() .
Оно принимает положительные и отрицательные
целочисленные значения, по модулю
меньшие или равные
.
Оно принимает положительные и отрицательные
целочисленные значения, по модулю
меньшие или равные
![]()
![]() =
0, 1,
2,
... ,
=
0, 1,
2,
... , ![]() .
.
Изменение плоскости орбиты электрона связано с изменением потенциальной энергии электрона, и у него появляются дополнительные энергетические уровни, которые обнаруживаются по расщеплению спектральных линий в магнитном поле.
Магнитное
спиновое квантовое число
![]() характеризует ориентировку (знак) спина
электрона: “+” при параллельной и “–“
при антипараллельной ориентировки
спина.Спином
называется
механический момент электрона
характеризует ориентировку (знак) спина
электрона: “+” при параллельной и “–“
при антипараллельной ориентировки
спина.Спином
называется
механический момент электрона
![]() .
Каждый электрон вращаясь вокруг
собственной оси обладает постоянным
механическим моментом количества
движения
.
Каждый электрон вращаясь вокруг
собственной оси обладает постоянным
механическим моментом количества
движения![]() ,
численно равным
,
численно равным![]() и постоянным магнитным моментом
и постоянным магнитным моментом![]() ,
численно равным одному магнетону Бора
,
численно равным одному магнетону Бора![]() .
.
Распределение электронов в атоме по энергетическим уровням и подуровням осуществляется на основе двух принципов и правила:
Принцип Паули:
В атоме не может быть электронов, характеризующихся одинаковой комбинацией значений квантовых чисел, иначе говоря: в атоме состояния всех электронов различны.
Принцип минимума энергии:
Распределение электронов в атоме соответствует минимуму энергии атома.
Правило отбора азимутального квантового числа –
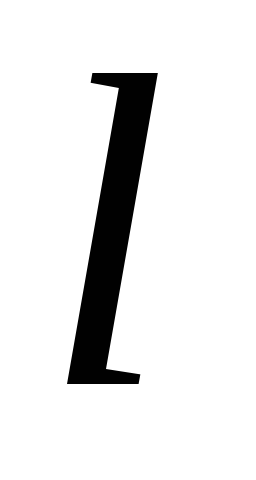 = 1.
Электрон в атоме может переходить
только между состояниями, удовлетворяющему
указанному правилу.
= 1.
Электрон в атоме может переходить
только между состояниями, удовлетворяющему
указанному правилу.
Наибольшее
количество N
электронов,
которое может находиться в одном слое,
определяется квантовым соотношением
![]() ,n
– главное квантовое число или номер
орбиты.
,n
– главное квантовое число или номер
орбиты.
При энергии (10 – 15 эВ) переход на дополнительные уровни обусловлен электронами наружного слоя атома. Частота излучения фотонов соответствует оптической части спектра. При энергии возбуждения > 15 эВ осуществляются переходы между внутренними слоями, что соответствует излучению в УФ (ультрафиолетовой) и рентгеновской области.
Порядок выполнения лабораторной работы
Запустите на компьютере программу «Открытая физика 1.1», на экране монитора выберите раздел «Квантовая физика», затем «Постулаты Бора».
Подведите маркер мыши к уровню энергии электрона с номером n = 2 (возбужденному состоянию) и нажмите левую кнопку мыши. Затем подведите маркер мыши к уровню энергии электрона с номером n0 = 1 (основному состоянию) и нажмите левую кнопку мыши. Наблюдайте за происходящим процессом на модели атома водорода.
Запишите в таблицу 1 длину волны линии в спектре, соответствующую данному переходу и значения энергий каждого уровня.
Повторите п. 1-2 для значений n = 3, 4, каждый раз осуществляя переход с возбужденного на основной уровень. Запишите все значения энергий и длин волн в таблицу 1.
Таблица 1
|
№ |
n0 |
n |
λi |
1/λi |
1/n2 |
E0 |
En |
|
серия |
|
1 |
1 |
2 |
|
|
|
|
|
|
|
|
|
1 |
3 |
|
|
|
|
|
|
|
|
|
1 |
4 |
|
|
|
|
|
|
|
|
2 |
2 |
3 |
|
|
|
|
|
|
|
|
|
2 |
4 |
|
|
|
|
|
|
|
|
|
2 |
5 |
|
|
|
|
|
|
|
|
3 |
3 |
4 |
|
|
|
|
|
|
|
|
|
3 |
5 |
|
|
|
|
|
|
|
|
|
3 |
6 |
|
|
|
|
|
|
|
Вычислите и запишите в таблицу 1 обратную величину длины волн.
Определите серию спектральных линий, соответствующих каждому переходу, по таблице 2. Запишите её название в таблицу 1.
Вычислите и запишите в таблицу 1 обратную величину квадрата главного квантового числа (1/n2 ).
Вычислите по формуле значение постоянной Ридберга
![]() .
.
(Попарно брать значения обратных длин волн и главного квантового числа, соответствующего конечному состоянию электрона для каждого перехода из таблицы 1)
По формуле

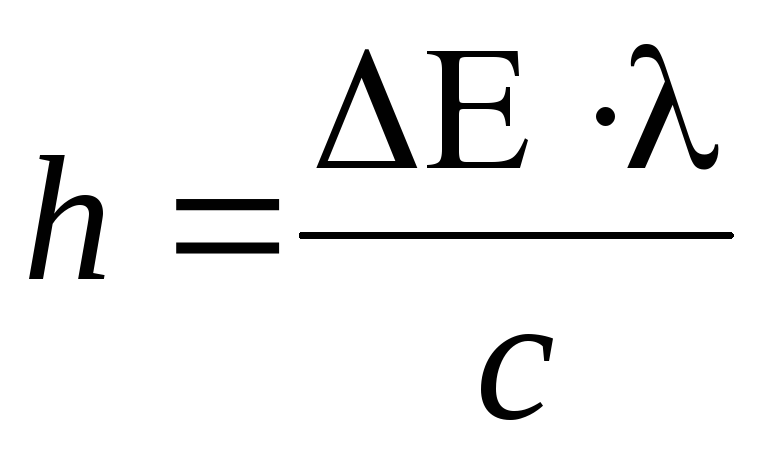 вычислите постоянную Планка для любой
из трех наблюдаемых серий в атоме
водорода (1 эВ = 1,6·10-19
Дж). Рассчитайте среднее значение
постоянной Планка и сравните с табличным
значением.
вычислите постоянную Планка для любой
из трех наблюдаемых серий в атоме
водорода (1 эВ = 1,6·10-19
Дж). Рассчитайте среднее значение
постоянной Планка и сравните с табличным
значением.Проанализируйте результаты и сделайте вывод.
ТАБЛИЧНОЕ ЗНАЧЕНИЕ: Постоянная Ридберга R = 1,1107 м-1
Таблица 2
|
Серия |
Лаймана |
Бальмера |
Пашена |
Брэкета |
|
Переходы |
np1s |
ns2p,nd2p |
nf3d,np3d |
ng4f,nd4f |
