
- •Оглавление
- •Введение
- •Лабораторная работа 1 Основные классы неорганических соединений
- •Теоретическое введение
- •Химические свойства оксидов
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 2 Определение молярной массы эквивалентов цинка
- •Теоретическое введение
- •Выполнение работы
- •Данные опыта и результаты расчетов
- •Давление насыщенного водяного пара при различных температурах
- •Примеры решения задач
- •3,5 Г/моль n2 – х
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 3 Определение теплоты реакции нейтрализации
- •Теоретическое введение
- •Выполнение работы
- •Данные опыта и результаты расчетов
- •Примеры решения задач
- •После подстановки справочных данных из табл. Б. 1 получаем:
- •Таким образом, тепловой эффект реакции равен –853,8 кДж, а составляет –822,2 кДж/моль.
- •Подставляем в формулу справочные данные из табл. Б. 1 и получаем:
- •Используя справочные данные табл. Б. 1 получаем:
- •Решение. ВычисляемDh°х.Р.ИDs°х.Р.:
- •Задачи и упражнения для самостоятельного решения
- •При сгорании 1 л с2н4при нормальных условиях выделяется 59,06 кДж теплоты. Определить стандартную энтальпию образования этилена. (Ответ: 52,3 кДж/моль).
- •3.3. А). Сожжены с образованиемH2o (г)равные объемы водорода и ацетилена, взятые при одинаковых условиях. В каком случае выделится больше теплоты? Во сколько раз? (Ответ:5,2).
- •Лабораторная работа 4 Скорость химической реакции
- •Теоретическое введение
- •Выполнение работы
- •Данные опыта и результаты расчетов
- •Опыт 2. Зависимость скорости реакции от температуры
- •Данные опыта и результаты расчетов
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 5 Катализ
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 6 Химическое равновесие
- •Теоретическое введение
- •Выполнение работы
- •Для опыта удобно воспользоваться реакцией
- •Опыт 2. Влияние изменения температуры на смещение равновесия
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 7 Определение концентрации раствора кислоты
- •Теоретическое введение
- •Выполнение работы
- •Данные опыта и результаты расчетов
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 8 Реакции в растворах электролитов
- •Теоретическое введение
- •Выполнение работы Опыт 1. Сравнение химической активности кислот
- •Опыт 2. Реакции, идущие с образованием осадка
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 9 Гидролиз солей
- •Теоретическое введение
- •Выполнение работы
- •Опыт 2. Смещение равновесия гидролиза при разбавлении раствора
- •Опыт 3. Смещение равновесия гидролиза при изменении температуры
- •Опыт 4. Реакции обмена, сопровождаемые гидролизом
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 10 Коллоидные растворы
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 11 Окислительно-восстановительные реакции
- •Теоретическое введение
- •2O−2 – 4ē → o20 ½3 − окисление
- •Выполнение работы Опыт 1. Влияние среды на окислительно-восстановительные реакции
- •Опыт 3. Реакция диспропорционирования
- •Опыт 4. Внутримолекулярная реакция (групповой)
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 12 Коррозия металлов
- •Теоретическое введение
- •Выполнение работы Опыт 1. Влияние образования гальванической пары на процесс растворения металла в кислоте
- •Опыт 2. Роль защитной пленки в ослаблении коррозии
- •Примеры решения задач
- •Для первого электрода
- •Для второго электрода
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 13 Электролиз
- •Теоретическое введение
- •Выполнение работы Опыт 1. Электролиз раствора иодида калия
- •Опыт 2. Электролиз раствора сульфата натрия
- •Опыт 3. Электролиз раствора сульфата меди
- •Опыт 4. Электролиз с растворимым анодом
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 14 Химические свойства металлов
- •Теоретическое введение
- •Выполнение работы
- •Опыт 4. Действие щелочи на металлы
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 15 Комплексные соединения
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 16
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 17 Жесткость воды
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 18 Алюминий, олово, свинец
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 19 Металлы подгрупп меди и цинка
- •Теоретическое введение
- •Выполнение работы
- •Задачи для самостоятельного решения
- •Лабораторная работа 20 Хром
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 21 Марганец
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •21.3. Рассчитать молярную массу эквивалентов перманганата калия в реакции
- •Лабораторная работа 22 Железо, кобальт, никель
- •Теоретическое введение
- •Выполнение работы
- •Опыт 3. Получение и свойства гидроксида никеля (II)
- •Опыт 6. Получение комплексных соединений кобальта
- •Опыт 7. Получение комплексных соединений никеля
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 23 Галогены
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 24 Кислород. Пероксид водорода
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 25 Сера
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •25.13. Закончить уравнения реакций гидролиза в молекулярном и ионном виде:
- •Лабораторная работа 26 Азот
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 27 Углерод, кремний
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 28 Углеводороды
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 29 Спирты, альдегиды, кетоны
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 30 Органические кислоты
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 31 Распознавание высокомолекуляных материалов
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 32 Получение фенолоформальдегидных смол
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 33 Качественный анализ металлов
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 34 Качественные реакции на анионы
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 35 Количественное определение железа в растворе его соли
- •Теоретическое введение
- •Выполнение работы
- •Данные опыта и результаты расчетов
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Заключение
- •Библиографический список
- •Требования к оформлению отчета по лабораторной работе
- •ИрГту кафедра химии и пищевой технологии Отчет
- •Стандартные энтальпии образования ∆fН°298, энтропии s°298 и энергии Гиббса образования ∆fG°298 некоторых веществ при 298 к (25 °с)
- •Плотность раствора соляной кислоты при 15 °с
- •Растворимость некоторых солей и оснований в воде
- •Стандартные электродные потенциалы (jo) при 25 °с и электродные реакции для некоторых металлов
- •Периодическая система
- •Элементов д.И. Менделеева
Растворимость некоторых солей и оснований в воде
|
Анионы |
Катионы | ||||||||||||||||||
|
Li+ |
Na+ |
K+ |
NH4+ |
Cu2+ |
Ag+ |
Mg2+ |
Ca2+ |
Ba2+ |
Zn2+ |
Hg2+ |
Al3+ |
Sn2+ |
Pb2+ |
Ni2+ |
Cr3+ |
Mn2+ |
Fe3+ |
Fe2+ | |
|
Cl− |
р |
р |
р |
р |
р |
н |
р |
р |
р |
р |
р |
р |
р |
м |
р |
р |
р |
р |
р |
|
Br− |
р |
р |
р |
р |
р |
н |
р |
р |
р |
р |
м |
р |
р |
м |
р |
р |
р |
р |
р |
|
I− |
р |
р |
р |
р |
− |
н |
р |
р |
р |
р |
н |
р |
р |
н |
р |
р |
р |
− |
р |
|
NO3− |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
− |
р |
р |
р |
− |
р |
р |
|
CH3COO− |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
− |
р |
р |
− |
р |
− |
р |
|
S |
р |
р |
р |
р |
н |
н |
− |
р |
р |
н |
н |
− |
н |
н |
н |
− |
н |
н |
н |
|
SO32− |
р |
р |
р |
р |
− |
н |
н |
н |
н |
н |
н |
− |
− |
н |
н |
− |
н |
− |
н |
|
SO42− |
р |
р |
р |
р |
р |
м |
р |
м |
н |
р |
− |
р |
р |
н |
р |
р |
р |
р |
р |
|
CO32− |
м |
р |
р |
р |
− |
н |
н |
н |
н |
н |
− |
− |
− |
н |
н |
− |
н |
− |
н |
|
SiO32− |
р |
р |
р |
− |
− |
− |
н |
н |
н |
н |
− |
н |
− |
н |
− |
− |
н |
н |
н |
|
CrO42− |
р |
р |
р |
р |
н |
н |
р |
м |
н |
н |
н |
− |
− |
н |
− |
р |
н |
− |
− |
|
PO43− |
н |
р |
р |
р |
н |
н |
н |
н |
н |
н |
н |
н |
н |
н |
н |
н |
н |
н |
н |
|
OH− |
р |
р |
р |
р |
н |
− |
н |
м |
р |
н |
− |
н |
н |
н |
н |
н |
н |
н |
н |
Примечание: р – растворимое; м – малорастворимое; н – практически нерастворимое вещество; «−» − вещество не существует или разлагается водой.
Таблица 4
Стандартные электродные потенциалы (jo) при 25 °с и электродные реакции для некоторых металлов
|
Электрод |
Электродная реакция |
jo , В |
Электрод |
Электродная реакция |
jo , В |
|
Li+/Li |
Li+ + ē = Li |
–3,045 |
Cd2+/Cd |
Cd2+ + 2ē = Cd |
–0,403 |
|
Rb+/Rb |
Rb+ + ē = Rb |
–2,925 |
Co2+/Co |
Co2+ + 2ē = Co |
–0,277 |
|
K+/K |
K+ + ē = K |
–2,924 |
Ni2+/Ni |
Ni2+ + 2ē = Ni |
–0,250 |
|
Cs+/Cs |
Cs+ + ē = Cs |
–2,923 |
Sn2+/Sn |
Sn2+ + 2ē = Sn |
–0,136 |
|
Ba2+/Ba |
Ba2+ + 2ē = Ba |
–2,906 |
Pb2+/Pb |
Pb2+ + 2ē = Pb |
–0,126 |
|
Ca2+/Ca |
Ca2+ + 2ē = Ca |
–2,866 |
Fe3+/Fe |
Fe3+ + 3ē = Fe |
–0,036 |
|
Na+/Na |
Na+ + ē = Na |
–2,714 |
2H+/H2 |
2H+ + 2ē = H2 |
0,000 |
|
Mg2+/Mg |
Mg2+ + 2ē = Mg |
–2,363 |
Bi3+/Bi |
Bi3+ + 3ē = Bi |
+0,215 |
|
A13+/A1 |
Al3+ + 3ē = Al |
–1,662 |
Cu2+/Cu |
Cu2+ + 2ē = Cu |
+0,337 |
|
Ti2+/Ti |
Ti2+ + 2ē = Ti |
–1,628 |
Ag+/Ag |
Ag+ + ē = Ag |
+0,799 |
|
Mn2+/Mn |
Mn2+ + 2ē = Mn |
–1,180 |
Hg2+/Hg |
Hg2+ + 2ē = Hg |
+0,854 |
|
Zn2+/Zn |
Zn2+ + 2ē = Zn |
–0,763 |
Pt2+/Pt |
Pt2+ + 2ē = Pt |
+1,190 |
|
Cr3+/Cr |
Cr3+ + 3ē = Cr |
–0,744 |
Au3+/Au |
Au3+ + 3ē = Au |
+1,498 |
|
Fe2+/Fe |
Fe2+ + 2ē = Fe |
–0,440 |
Au+/Au |
Au+ + ē = Au |
+1,691 |

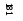 2−
2−