
- •Оглавление
- •Введение
- •Лабораторная работа 1 Основные классы неорганических соединений
- •Теоретическое введение
- •Химические свойства оксидов
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 2 Определение молярной массы эквивалентов цинка
- •Теоретическое введение
- •Выполнение работы
- •Данные опыта и результаты расчетов
- •Давление насыщенного водяного пара при различных температурах
- •Примеры решения задач
- •3,5 Г/моль n2 – х
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 3 Определение теплоты реакции нейтрализации
- •Теоретическое введение
- •Выполнение работы
- •Данные опыта и результаты расчетов
- •Примеры решения задач
- •После подстановки справочных данных из табл. Б. 1 получаем:
- •Таким образом, тепловой эффект реакции равен –853,8 кДж, а составляет –822,2 кДж/моль.
- •Подставляем в формулу справочные данные из табл. Б. 1 и получаем:
- •Используя справочные данные табл. Б. 1 получаем:
- •Решение. ВычисляемDh°х.Р.ИDs°х.Р.:
- •Задачи и упражнения для самостоятельного решения
- •При сгорании 1 л с2н4при нормальных условиях выделяется 59,06 кДж теплоты. Определить стандартную энтальпию образования этилена. (Ответ: 52,3 кДж/моль).
- •3.3. А). Сожжены с образованиемH2o (г)равные объемы водорода и ацетилена, взятые при одинаковых условиях. В каком случае выделится больше теплоты? Во сколько раз? (Ответ:5,2).
- •Лабораторная работа 4 Скорость химической реакции
- •Теоретическое введение
- •Выполнение работы
- •Данные опыта и результаты расчетов
- •Опыт 2. Зависимость скорости реакции от температуры
- •Данные опыта и результаты расчетов
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 5 Катализ
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 6 Химическое равновесие
- •Теоретическое введение
- •Выполнение работы
- •Для опыта удобно воспользоваться реакцией
- •Опыт 2. Влияние изменения температуры на смещение равновесия
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 7 Определение концентрации раствора кислоты
- •Теоретическое введение
- •Выполнение работы
- •Данные опыта и результаты расчетов
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 8 Реакции в растворах электролитов
- •Теоретическое введение
- •Выполнение работы Опыт 1. Сравнение химической активности кислот
- •Опыт 2. Реакции, идущие с образованием осадка
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 9 Гидролиз солей
- •Теоретическое введение
- •Выполнение работы
- •Опыт 2. Смещение равновесия гидролиза при разбавлении раствора
- •Опыт 3. Смещение равновесия гидролиза при изменении температуры
- •Опыт 4. Реакции обмена, сопровождаемые гидролизом
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 10 Коллоидные растворы
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 11 Окислительно-восстановительные реакции
- •Теоретическое введение
- •2O−2 – 4ē → o20 ½3 − окисление
- •Выполнение работы Опыт 1. Влияние среды на окислительно-восстановительные реакции
- •Опыт 3. Реакция диспропорционирования
- •Опыт 4. Внутримолекулярная реакция (групповой)
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 12 Коррозия металлов
- •Теоретическое введение
- •Выполнение работы Опыт 1. Влияние образования гальванической пары на процесс растворения металла в кислоте
- •Опыт 2. Роль защитной пленки в ослаблении коррозии
- •Примеры решения задач
- •Для первого электрода
- •Для второго электрода
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 13 Электролиз
- •Теоретическое введение
- •Выполнение работы Опыт 1. Электролиз раствора иодида калия
- •Опыт 2. Электролиз раствора сульфата натрия
- •Опыт 3. Электролиз раствора сульфата меди
- •Опыт 4. Электролиз с растворимым анодом
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 14 Химические свойства металлов
- •Теоретическое введение
- •Выполнение работы
- •Опыт 4. Действие щелочи на металлы
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 15 Комплексные соединения
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 16
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 17 Жесткость воды
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 18 Алюминий, олово, свинец
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 19 Металлы подгрупп меди и цинка
- •Теоретическое введение
- •Выполнение работы
- •Задачи для самостоятельного решения
- •Лабораторная работа 20 Хром
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 21 Марганец
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •21.3. Рассчитать молярную массу эквивалентов перманганата калия в реакции
- •Лабораторная работа 22 Железо, кобальт, никель
- •Теоретическое введение
- •Выполнение работы
- •Опыт 3. Получение и свойства гидроксида никеля (II)
- •Опыт 6. Получение комплексных соединений кобальта
- •Опыт 7. Получение комплексных соединений никеля
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 23 Галогены
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 24 Кислород. Пероксид водорода
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 25 Сера
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •25.13. Закончить уравнения реакций гидролиза в молекулярном и ионном виде:
- •Лабораторная работа 26 Азот
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 27 Углерод, кремний
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 28 Углеводороды
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 29 Спирты, альдегиды, кетоны
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 30 Органические кислоты
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 31 Распознавание высокомолекуляных материалов
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 32 Получение фенолоформальдегидных смол
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 33 Качественный анализ металлов
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 34 Качественные реакции на анионы
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 35 Количественное определение железа в растворе его соли
- •Теоретическое введение
- •Выполнение работы
- •Данные опыта и результаты расчетов
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Заключение
- •Библиографический список
- •Требования к оформлению отчета по лабораторной работе
- •ИрГту кафедра химии и пищевой технологии Отчет
- •Стандартные энтальпии образования ∆fН°298, энтропии s°298 и энергии Гиббса образования ∆fG°298 некоторых веществ при 298 к (25 °с)
- •Плотность раствора соляной кислоты при 15 °с
- •Растворимость некоторых солей и оснований в воде
- •Стандартные электродные потенциалы (jo) при 25 °с и электродные реакции для некоторых металлов
- •Периодическая система
- •Элементов д.И. Менделеева
Данные опыта и результаты расчетов
|
Номер титрования |
V (FeSO4) Объем соли железа |
V (KMnO4) Объем перманганата калия |
Vср (KMnO4) Средний объем перманганата калия |
|
1 |
|
|
|
|
2 |
|
| |
|
3 |
|
|
Требования к результатам опыта
1. Рассчитать молярную концентрацию эквивалентов раствора соли железа по закону эквивалентов:
сэк (FeSO4) · V (FeSO4) = сэк (KMnO4) · V (KMnO4) ,
откуда
![]()
![]()
![]()
![]()
![]()
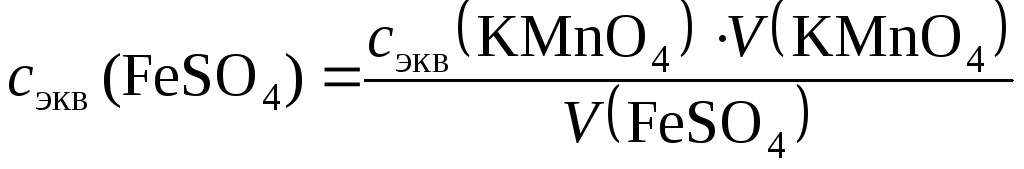
![]() ,
,
где сэк (FeSO4) исэк (KMnO4) – молярные концентрации эквивалентов растворов;V(FeSO4) иV(KMnO4) − объемы реагирующих растворов.
2. Рассчитать, какому количеству металлического железа соответствует содержание FeSO4в объеме исследуемого раствора по формуле
m (Fe) = Mэк (Fe) · сэк (FeSO4),
где Mэк(Fe) – молярная масса эквивалентов железа.
3. Рассчитать титр раствора FeSO4 по формуле
![]() ,
г/мл,
,
г/мл,
где Мэк (FeSO4) – молярная масса эквивалентов FeSO4; сэк (FeSO4) – молярная концентрация эквивалентов FeSO4.
Примеры решения задач
Пример 35.1. Вычислить молярную массу эквивалентов и эквивалент KCrO2 как восстановителя, если KCrO2 окисляется до K2CrO4.
Решение. При окислении KCrO2 степень окисления хрома повышается с +3 до +6. Молярная масса эквивалентов восстановителя равна частному от деления молярной массы восстановителя на число отданных электронов:
Мэк (KCrO2) = 123 / 3 = 41 г/моль; эквивалент KCrO2 равен ⅓ KCrO2.
Пример 35.2. Найти нормальность раствора NaOH, если нa титрование 20 мл 0,1 н. раствора щавелевой кислоты израсходовано 21мл NaOH.
Решение. Поскольку вещества взаимодействуют в эквивалентных количествах, то можно записать н.к ∙ Vк = н.щ ∙ Vщ
где н.к. – нормальность раствора кислоты, Vк − объем кислоты; н.щ – нормальность раствора щелочи, Vщ – объем щелочи. Следовательно, нормальность NaOH равна н.щ = н.к.∙ Vк / Vщ = 0,1∙20 / 21 = 0,952.
Таким образом, для титрования был использован 0,952 н. раствор NaOH.
Задачи и упражнения для самостоятельного решения
35.1. На титрование 20 мл 0,1 М раствора HCl потребовалось 16 мл КОН. Чему равна молярная концентрация КОН? (Ответ: 0,125 моль/л).
35.2. Вычислить титры растворов: а) 0,05 М NaCl; б) 0,004 н. Ca(OH)2;
в) 0,5 н. HNO3. (Ответ: а) 0,00292 г/мл; б) 0,148∙10−3 г/мл; в) 0,0315 г/мл).
35.3. Чему равна масса осадка, образующегося при сливании 250 мл раствора карбоната натрия с молярной концентрацией 0,1 моль/л и 200 мл хлорида бария с молярной концентрацией 0,15 моль/л? (Ответ: 4,925 г).
35.4. При гравиметрическом определении свинца в сплаве получено 1,4642 г PbSO4. Какова масса свинца в сплаве? (Ответ: 1 г).
35.5. Вычислить титры растворов: а) 1 н. H2SO4, б) 1 M H3PO4,
в) 0,1 н. расвора КОН. (Ответ: а) 0,049 г/мл; б) 0,098 г/мл; в) 0,0056 г/мл).
35.6. На осаждение гидроксида железа (Ш) из 15 мл раствора FeCl3 пошло
10 мл 0,1 н. щелочи. Вычислить массу образовавшегося осадка гидроксида железа (Ш). (Ответ: 0,0356 г).
35.7. На нейтрализацию 10 мл соляной кислоты неизвестной концентрации пошло 12 мл 0,1 н. раствора NaOH. Определить нормальность и титр раствора соляной кислоты. (Ответ: 0,12 н.; 4,38∙10−3 г/мл).
35.8. Написать уравнения реакций взаимодействия перманганата калия KMnO4 с сульфитом натрия Na2SO3 в: а) кислой среде, б) нейтральной среде и вычислить эквивалент и молярную массу эквивалентов в каждом случае.
(Ответ: а) 1/5 KMnO4; 31,6 моль/л; б) 1/3 KMnO4; 52,7 моль/л).
35.9. Вычислить нормальность одномолярного раствора дихромата калия K2Cr2O7 в окислительно-восстановительном титровании, сопровождающимся образованием сульфата хрома (Ш). (Ответ: 6 н.).
35.10. Для осаждения в виде AgCl всего серебра, содержащегося в 100 мл раствора AgNO3, потребовалось 50 мл 0,2 н. раствора соляной кислоты HCl. Какова нормальность раствора AgNO3? Какая масса AgCl выпала в осадок?
(Ответ: 0,1 н.; 1,433 г).
35.11. Какая массаHNO3содержалась в растворе, если на нейтрализацию его потребовалось 35 мл 0,4 н. раствораNaOH? Каков титр раствораNaOH?
(Ответ: 0,882 г; 0,016 г/мл).
35.12.25 мл КОН нейтрализуется 20,5 мл 0,2 н. раствора соляной кислоты. Чему равна нормальность раствора КОН? (Ответ: 0,164 н.).
35.13.Навеска 5,912 г хлорида натрия растворена в 2 л раствора. Чему равны молярная концентрация эквивалентов и титр этого раствора?
(Ответ: 0,05 моль/л; 0,002956 г/мл).
35.14.Сколко граммовH2SO4содержится в растворе, если на нейтрализацию израсходовано 20 мл раствора КОН, титр которого равен 0,0046 г/мл?
(Ответ: 0,805 г).
35.15.Для нейтрализации 20 мл 0,1 н. раствораNaOHрасходуется 30 мл соляной кислоты. Чему равна молярная концентрация эквивалентовHCl?
(Ответ: 0,067 моль/л).
35.16. На нейтрализацию 31 мл 0,16 н. раствора щелочи требуется 217 мл раствора серной кислоты. Чему равна нормальность и титр серной кислоты?
(Ответ: 0,023 н.; 0,0011 г/мл).
35.17.Какой объем 2Мраствора соляной кислотыHClпотребуется для нейтрализации 14 г гидроксида калия КОН, содержащихся в 1 л раствора? Чему равна молярная концентрация эквивалентов такого раствора?
(Ответ: 125 мл; 0,25 моль/л).
35.18.Определить содержание железа в 1 л раствора сульфата железа (II), если на титрование 10 мл его пошло 5 мл 0,1 н. раствора перманганата калияKMnO4. (Ответ: 75,9 г).
35.19.Какова молярная концентрация эквивалентов раствораNaCl, если на титрование 20 мл его израсходовано 18,3 мл 0,1 н. раствора нитрата серебраAgNO3. (Ответ: 0,0915 моль/л).
35.20.Вычислить, сколько процентов кристаллизационной воды содержалось вBaCl2∙2H2O, если навеска хлорида бария до высушивания составляла 1,5723 г, а после высушивания 1,3395 г. (Ответ: 14,8 %).
