
- •Равновесие в системе жидкость газ
- •Двухфазное равновесие
- •Диаграмма состояния p-V
- •Относительная различимость жидкости и газа
- •Метастабильное и лабильное состояние
- •Равновесие трех фаз в однокомпонентной системе
- •Вариантность трехфазного равновесия
- •Вид линий двухфазного равновесия на диаграмме состояния.
- •Вариантность m– фазного состояния (по Гиббсу)
Вид линий двухфазного равновесия на диаграмме состояния.
Рассмотрим вид
линий двухфазного равновесия на диаграмме
состояния, представляющей собой три
агрегатных состояния однокомпонентного
вещества. При достаточно малых давлениях
стабильной фазой любого вещества
является газ. С другой стороны, при
достаточно низкой температуре стабильной
фазой любого вещества (за исключением
гелия и может быть водорода) является
кристалл. (не путать с амморфными
веществами не достигшими равновесного
состояния в силу кинетических причин)
Поэтому можно полагать, что линия кристал
газ выходит из начала координат диаграммы
(P-T). Если к
соотношению Клаузиса-Клайперона
применить третье начало) в формулировке
Нернста![]() ,то
,то![]() Это означает, что в начале координат
линия равновесия «кристалл-газ» касается
оси температур. Всегда можно пренебречь
мольным объемом твердого тела в сравнении
с газом . Так, что
Это означает, что в начале координат
линия равновесия «кристалл-газ» касается
оси температур. Всегда можно пренебречь
мольным объемом твердого тела в сравнении
с газом . Так, что![]() .
Предположим, что газовая фаза, находящаяся
в равновесии с кристаллом, представляет
идеальный газ. При малых давлениях это
допущение не слишком грубо. Тогда
.
Предположим, что газовая фаза, находящаяся
в равновесии с кристаллом, представляет
идеальный газ. При малых давлениях это
допущение не слишком грубо. Тогда![]() .
Опыт показывает, что теплота возгонки
всегда большеRTотсюда
получается, что
.
Опыт показывает, что теплота возгонки
всегда большеRTотсюда
получается, что![]() .
Это означает, что линия равновесия
«кристал-газ» обращена выпуклость вниз.
При значительных отклонениях газа от
идеальностиpv>RT, и
отсюда можно получить неравенство
.
Это означает, что линия равновесия
«кристал-газ» обращена выпуклость вниз.
При значительных отклонениях газа от
идеальностиpv>RT, и
отсюда можно получить неравенство![]() Эти же рассуждения применимы и к линии
жидкость газ, в той области где можно
пренебречь мольным объемом жидкости в
сравнении с газом (т.е. вдали от критической
точки). Опыт показывает, что на всем
протяжении линия равновесия жидкость
газ обращена выпуклостью вниз. Линия
равновесия жидкость газ заканчивается
в критической точке.
Эти же рассуждения применимы и к линии
жидкость газ, в той области где можно
пренебречь мольным объемом жидкости в
сравнении с газом (т.е. вдали от критической
точки). Опыт показывает, что на всем
протяжении линия равновесия жидкость
газ обращена выпуклостью вниз. Линия
равновесия жидкость газ заканчивается
в критической точке.
Угол между любыми двумя соседними линиями (сплошными) сходящимися в критической точке не может превышать 180о. Если линии пересечения поверхностей не имеют изломов, то не возможно так пересечь в одной точке три поверхности, чтобы угол между двумя соседними линиями (точнее между касательными к этим линиям) был больше 180ов точке пересечения.
Практически
в тройной точке линия жидкость-газ имеет
наклон не намного меньший, чем линия
кристалл-газ. Действительно qкр-ж<qж-г<qкр-г.
Далее, так как тройная точка удалена от
критическойй, то можно пренебречь как
малым объемом кристалла , так и жидкости.
Тогда Практически
различие в наклоне линии «жидкость-газ»
и «кристалл –газ» очень мало и трудно
выделяется на опыте.
Практически
различие в наклоне линии «жидкость-газ»
и «кристалл –газ» очень мало и трудно
выделяется на опыте.
Хотя qкр-ж<qкр-г,
но различие между этими величинами
намного меньше, чем междуvж,vкр
иvг.
Поэтому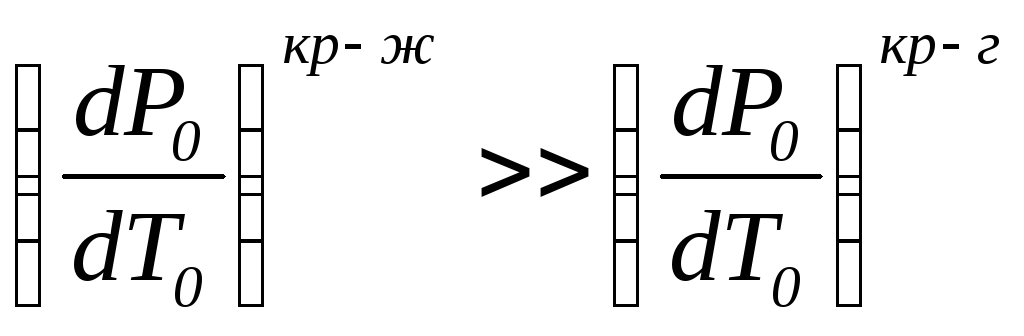 т.е. наклон линий «кристалл-газ»
значительно меньше наклона линии
«кристалл-жидкость». Он может превышать
даже 90о. Это соответствует
отрицательному значениюvж-vкр(аномальный случай) С увеличением
давления разность объемаvж-vкрнепрерывно уменьшается и наклон
«кристалл-жидкость» становится большим
(линия почти вертикальна). Линия кристалл
жидкость не должна обрываться. Симметрия
кристаллической фазы не может непрерывно
изменяться. Поэтому переход из
кристаллической фазы в жидкую не возможен
без двухфазного состояния.
т.е. наклон линий «кристалл-газ»
значительно меньше наклона линии
«кристалл-жидкость». Он может превышать
даже 90о. Это соответствует
отрицательному значениюvж-vкр(аномальный случай) С увеличением
давления разность объемаvж-vкрнепрерывно уменьшается и наклон
«кристалл-жидкость» становится большим
(линия почти вертикальна). Линия кристалл
жидкость не должна обрываться. Симметрия
кристаллической фазы не может непрерывно
изменяться. Поэтому переход из
кристаллической фазы в жидкую не возможен
без двухфазного состояния.
Вариантность m– фазного состояния (по Гиббсу)
Количество параметров (из числа переменных в уравнениях равновесия) которые можно менять, не изменяя m –количество фаз, находящихся в равновесии, определяет вариантностьm – фазного состояния
