
- •Равновесие в системе жидкость газ
- •Двухфазное равновесие
- •Диаграмма состояния p-V
- •Относительная различимость жидкости и газа
- •Метастабильное и лабильное состояние
- •Равновесие трех фаз в однокомпонентной системе
- •Вариантность трехфазного равновесия
- •Вид линий двухфазного равновесия на диаграмме состояния.
- •Вариантность m– фазного состояния (по Гиббсу)
В случае диаграмм состояния построенных на основе графиков (h-s)P и (f-v)Tнеобходимо знание коноды или же ее проекции на ось абcцисс и т.д.

Равновесие в системе жидкость газ
Мы рассмотрели схему, согласно которой, если задать свойства фаз, т.е. уравнение состояния , в виде определенных линий на соответствующих графиках, то можно графически исследовать поведение двухфазной равновесной системы. Применим это к исследованию равновесия жидкость газ. Эта проблема не однократно решалась на разных теоретических уровнях в статистической физике и продолжает решаться. Му рассмотрим упрощенную, но качественно удовлетворительную модель Ван-дер Ваальса. Особенность системы жидкость- газ заключается в том, что две фазы – жидкая и газообразная имея различную плотность на отличаются друг от друга макросимметрией. Для анализа равновесия в системе имеется простое аналитическое уравнение Ван-дер Ваальса. Для построения диаграммы воспользуемся методами геометрической термодинамики.
Уравнение Ван-дер- Ваальса можно записать как результат обобщения уравнения состояния идеального газа. Pv=RT для одного моля газа. В отличие от модели идеального газа в модели Ван-дер-Ваальса учтены: 1) собственные размеры атомов – посредством замены в уравнении объема системыvдоступным или свободным объемом (v-b), гдеb- суммарный собственный объем атомов или молекул;
2) Притяжение между молекулами в виде внутреннего, отрицательного давления –a/v2, обратно пропорционального квадрату объема; В уравнении Ван-дер Ваальса вместо полного давленияP входит разностьPи(-a/v2)
Таким образом, собираем уравнение Ван-дер-Ваальса в виде (P+a/v2)(v-b)=RT илиP=RT/(v-b)-a/v2.
Последняя запись в явном виде определяет изотерму Ван-дер-Ваальса [P(v)]T.Качественный вид изотермы можно исследовать, получив ее экстремумы.
![]()
![]() .
.
Следовательно, экстремумы соответствует решением кубического уравнения.
Это уравнение
легче всего исследовать графически,
как точки пересечения линии
![]() и прямой
и прямой![]() на вспомогательном графике. Линияy1
характеризуется следующим:
y1(b)=0
(b – наименьшее,
возможное значение объема).
y1()=0
на вспомогательном графике. Линияy1
характеризуется следующим:
y1(b)=0
(b – наименьшее,
возможное значение объема).
y1()=0
![]() приv=b, v=
иv=3b так как
приv=b, v=
иv=3b так как![]() .
.
Далее max y1=y1(3b)=4/(27b);Горизонтальy2 при малых значениях температурыT (рис .26) пересекает кривую в двух точках, что соответствует двум экстремумам изотермы[P(v)]T.При высоких температурах горизонтальT>Tкр.не пересекает кривуюy1(v), что означает отсутствие экстремумов на изотерме[P(v)]TКритическая температураTкр, при которой исчезают экстремумы на изотерме определится из условияy2=max y1 как Tкр.=(8/27)(a/Rb), а критическое давление получается подстановкой в уравнение Ван-дер-Ваальса значенияTкр.
Pкр.=(1/27)(a/b2).
П
 осколькуTкриPкр
экспериментально определяемые
величины, то их эмпирические значения
могут быть использованы для оценки
констант. Уравнение Ван-дер-Ваальса
качественно весьма хорошо соответствует
экспериментальным данным, а в некоторых
случаях дает и количественные совпадения.
На основе графика (y-v)можно воспроизвести качественный вид
изотермы Ван-дер-Ваальса.
осколькуTкриPкр
экспериментально определяемые
величины, то их эмпирические значения
могут быть использованы для оценки
констант. Уравнение Ван-дер-Ваальса
качественно весьма хорошо соответствует
экспериментальным данным, а в некоторых
случаях дает и количественные совпадения.
На основе графика (y-v)можно воспроизвести качественный вид
изотермы Ван-дер-Ваальса.
При T>Tкр. Изотермы не имеют экстремумов. Поскольку при неограниченном возрастанииv (уравнение Ван-дер-Ваальса переходит в уравнение состояния идеального газа)
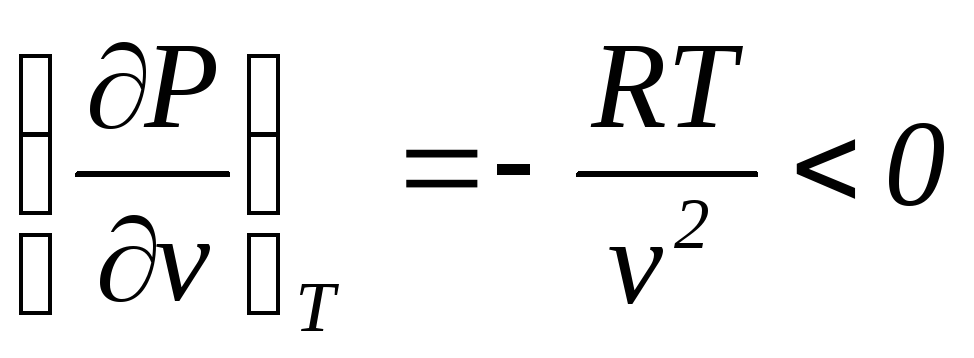 ;
можно заключить, что приvпри.Изотермы на всем протяжении
имеют отрицательный наклон и тем самым
удовлетворяют условиям механической
устойчивости
;
можно заключить, что приvпри.Изотермы на всем протяжении
имеют отрицательный наклон и тем самым
удовлетворяют условиям механической
устойчивости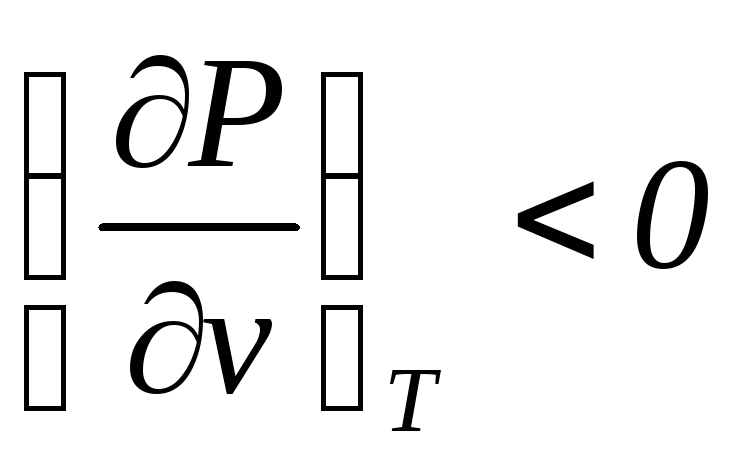
П
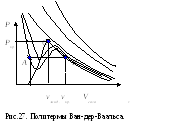 риT<Tкризотермы содержат два экстремума.
Поскольку и а этом случае для большихv
риT<Tкризотермы содержат два экстремума.
Поскольку и а этом случае для большихv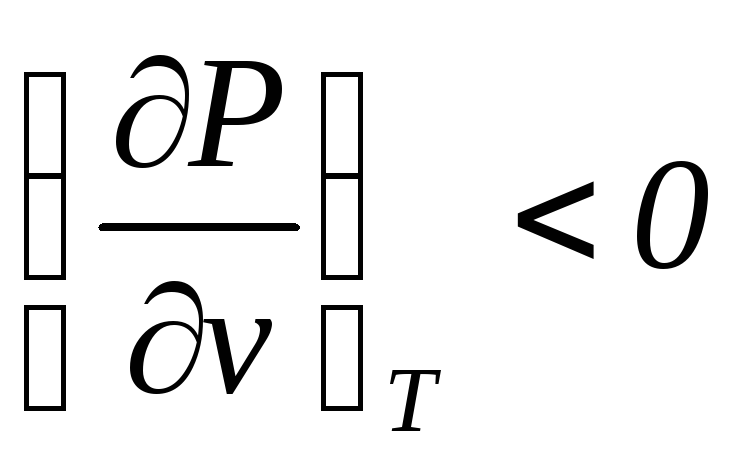 , то правый экстремум являетсяmax,
а левыйmin.С повышением
температуры все изотермы смещаются
вверх; При приближении кTкрэкстремумы сближаются и исчезают в
определенной критической точке. ТочкаC на рис.27.
, то правый экстремум являетсяmax,
а левыйmin.С повышением
температуры все изотермы смещаются
вверх; При приближении кTкрэкстремумы сближаются и исчезают в
определенной критической точке. ТочкаC на рис.27.
