
- •1. Предмет и структура физики.
- •2. Предмет механики.
- •3. Материальная точка. Система отсчёта. Радиус-вектор. Траектория. Путь. Вектор перемещения. Скорость.
- •4. Вычисление пройденного пути. Средняя скорость прохождения пути.
- •5. Ускорение. Понятие о кривизне. Нормальное и тангенциальное ускорение.
- •6. Основная задача механики.
- •7.Абсолютно твердое тело. Поступательное и вращательное движение. Вектора элементарного угла поворота, угловой скорости и углового ускорения. Связь линейных и угловых характеристик движения.
- •8. Первый закон Ньютона - постулат существования инерциальной системы отсчета.
- •9. Понятие силы и инертной массы. Импульс. Второй закон Ньютона.
- •10. Третий закон Ньютона.
- •11. Понятие о механической системе. Закон сохранения импульса (зси).
- •12. Центр масс. Теорема о движении центра масс.
- •13. Центр масс. Теорема о движении центра масс.
- •14. Реактивное движение. Формула Циолковского.
- •15. Проблемы космических полетов.
- •16. Понятие о механической работе и энергии. Мощность
- •17. Кинетическая энергия.
- •24. Абсолютно упругий удар.
- •25. Абсолютно не упругий удар.
- •26. Момент силы, момент импульса относительно точки и оси.
- •27. Уравнение моментов.
- •28. Закон сохранения момента импульса системы материальных точек.
- •29.Основное ур-ие динамики вращ. Движения.
- •30. Момент инерции. Теорема Гюйгенса – Штейнера.
- •32. Кинетическая энергия вращательного движения.
- •33. Работа и мощность при вращательном движении.
- •36.Скорость света –инвариант относительно исо. Опыт Бронч - Бруевича.
- •39. Преобразования Лоренца
- •40.Относительность одновременности.
- •41. Длина отрезка в разных системах отсчета.
- •42. Интервал времени в разных системах отсчета. Опыт с мюонами.
- •46. Взаимосвязь массы и энергии. Кинетическая энергия в релятивисткой механике.
- •47. Взаимосвязь импульса и энергии, кинетической энергии и импульса.
- •48. Частицы с массой покоя, равной нулю.
- •49. Понятие о неинерциальных системах отсчета.
- •50. Сила инерции. Принцип Даламбера.
- •51. Центробежная сила инерции.
- •52. Сила Кориолиса. Закон Бэра.
- •53. Закон всемирного тяготения.
- •54. Напряженность поля тяготения. Принцип суперпозиций для потенциалов.
- •55. Работа в поле тяготения. Потенциальная энергия в поле тяготения.
- •56. Потенциал поля тяготения. Принцип суперпозиций для потенциалов. Эквипотенциальные поверхности.
- •57. Космические скорости.
- •58. Законы Кеплера
- •59. Статистический и термодинамический методы.
- •60. Понятие об идеальном газе. Законы идеального газа.
- •61. Поток молекул.
- •62. Уравнение Клаузиуса - основное ур-е мкт идеального газа.
- •63. Следствия из основного ур-ия мкт.
- •Законы идеального газа
- •67. Поток молекул смотреть в билете №61
- •68. Следствия из основного уравнения смотреть в билете №63
- •69. Эргодическая система
- •70. Распределение молекул по скоростям.
- •1. Средняя арифмитическая скорость
- •2.Средняя квадратичная.
- •72. Барометрическая формула.
- •73. Распределение Больцмана по потенциальным энергиям. Опыт Перрена.
- •74. Степени свободы. Закон равномерного распределение энергии по степеням свободы.
- •75. Внутренняя энергия системы - функция состояния. Макроскопическая работа. Теплота. Эквивалентность теплоты и работы. Первое начало термодинамики.
- •81.Неполноценность I начала термодинамики. Различные формулировки второго начала. Круговые процессы. Тепловые машины.
- •80. Адиабатный процесс. Уравнение адиабаты. Политропный процесс.
- •76.Применение 1 начала терм-ки к изопроцессам в идеальном газе
- •82.Цикл Карно с идеальным газом
- •86.Закон возрастания энтропии. Гипотеза о тепловой смерти Вселенной
- •87.Статистический смысл 2-го начал термодинамики.
- •90.Общие сведения о явлениях переноса. Средн длина свободн пробега молекул.
- •91. Диффузия.
- •84.Термодинамическая вероятность макроскопического состояния. Распределение молекул по объёму.
- •85.Энтропия. Формула Больцмана.
75. Внутренняя энергия системы - функция состояния. Макроскопическая работа. Теплота. Эквивалентность теплоты и работы. Первое начало термодинамики.
Э![]() нергия
системы:
нергия
системы:
Ek
- Кинетическая
энергия поступательного движения
системы как ![]() целого,
целого,
Ep -потенциальная энергия системы во внешнем поле.
U-внутренняя энергия системы.
Внутренняя энергия
![]() -атомов и молекул
-атомов и молекул
![]()
![]() -ядер
и электронов
-ядер
и электронов
-энергия движения и взаимодействия всех частиц, составляющих систему.
При обычных процессах структура молекул и атомов не меняется, следовательно, U2 (ядер и электронов)=const, и рассматривают U1(атомов и молекул). При взаимодействии термодинамической системы с внешней средой её внутренняя энергия изменяется.
![]()
При этом возможны два способа передачи энергии:
1.процесс совершения работы,
2 .
теплопередача (теплопроводность,
конвекция, излучения)
.
теплопередача (теплопроводность,
конвекция, излучения)
Макроскопическая (термодинамическая) работа.
Принято считать, что если система совершает работу против действия внешних сил, то эта работа положительная. Если внешние силы совершают работу над системой, то работа отрицательная.
![]()

М акроскопическая
работа
акроскопическая
работа
-это мера изменения внутренней энергии системы в процессе совершения работы. Работа является функцией процесса но не является функцией состояния.
![]()
A=площади «под кривой»
Аналитическая формулировка 1 начало термодинамики
1
начало термодинамики- закон сохранения
энергии для тепловых процессов
![]()
тепло, подводимое к системе, расходуется на увеличение её внутренней энергии и совершение работы против действия внешних сил.
1
н. т/д- частный случай всеобщего(фундаментального)
закона сохранения энергии:
![]()
полная энергия замкнутой системы может изменяться только качественно оставаясь неизменной.
77.Изохорный процесс. (V=const)
Диаграмма этого процесса (изохора) в координатах p,V изобр-ся прямой, параллельной оси ординат
δQ=dU δA=pdV=>δA=0
Удельная теплоемкость равна кол-ву теплоты, которое небход. Затратить для нагрев. 1кг вещ-ва на 1К.
С=δQ/mdT [Дж/кг*К]
Молярная теплоемкость при V=const
Сv=δQ/νdT Cv=δQ/νdT=(ν=1; δQ=dU)=dU/dT
U=i/2kT*Na=i/2RT
Cv=i/2R-не зависит от Т, опр-ся только числом степеней свободы i
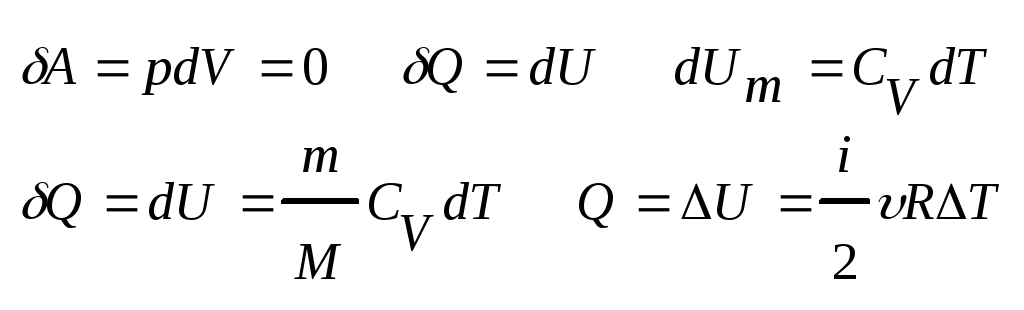

78. Изобарный процесс (p=const)
Диаграмма
этого процесса в координатах p,V
изобр-ся прямой параллельной оси  V.
При изобарном процессе работа газа при
увеличении объема от V1
до V2
равна
V.
При изобарном процессе работа газа при
увеличении объема от V1
до V2
равна

79.Изотермический процесс (T=const)
Описывается законом Бойля-Мариотта
Диаграмма этого процесса (изотерма) в координатах p,V представляет собой гиперболу, расположенную на диаграмме тем выше, чем выше температура, при которой происходит процесс.

 Следовательно,
для того чтобы при расширении газа
температура на понижалась, к газу в
течение изотермич. процесса необходимо
подводить кол-во теплоты, эквивалентное
внешней работе расширения.
Следовательно,
для того чтобы при расширении газа
температура на понижалась, к газу в
течение изотермич. процесса необходимо
подводить кол-во теплоты, эквивалентное
внешней работе расширения.
81.Неполноценность I начала термодинамики. Различные формулировки второго начала. Круговые процессы. Тепловые машины.
I начало терм-ки не указывает направление протекания процесса , поэтому его недостаточно для описания темодинамич. процессов.
Феноменологич. формулировка II начала терм-ки: вечный двигатель II рода невозможен.
Вечный двигатель II рода - периодически действующий двигатель, совершающий работу только за счёт охлаждения источника тепла.
Его КПД = 1, т.е. это двигатель, работающий только за счёт получения тепла из вне.
Различные формулировки 2 начала терм-ки:
Клаузиус: невозможен самопроизвольный переход тепла от менее нагретого тела к более нагретому телу.
Томсон: не возможен круг
Кельвин: невозможны процессы, единственным результатом которых было бы превращение тепла целиком в работу. Другими словами – невозможен тепловой двигатель второго рода с КПД=1.
 Круговой
процесс –
это процесс при котором система проходя
через ряд состояний возвращается в
исходное. Круговые процессы делятся на
прямые(проходят по часовой стрелки
работа за цикл больше 0;1а2-А2б1)
и обратные(процесс проходит против
часовой, работа за цикл меньше 0)
А=А2в1-А1а2.
В результате кругового процесса система
возвращается в исходное состояние и
следовательно полное изменение внутренней
энергии газа равно 0, поэтому первое
начало термодинамики для кругового
процесса Q=A.
Прямой цикл используется в тепловых
двигателях, обратный цикл в холодильных
машинах.
Круговой
процесс –
это процесс при котором система проходя
через ряд состояний возвращается в
исходное. Круговые процессы делятся на
прямые(проходят по часовой стрелки
работа за цикл больше 0;1а2-А2б1)
и обратные(процесс проходит против
часовой, работа за цикл меньше 0)
А=А2в1-А1а2.
В результате кругового процесса система
возвращается в исходное состояние и
следовательно полное изменение внутренней
энергии газа равно 0, поэтому первое
начало термодинамики для кругового
процесса Q=A.
Прямой цикл используется в тепловых
двигателях, обратный цикл в холодильных
машинах.
