
- •1. Предмет и структура физики.
- •2. Предмет механики.
- •3. Материальная точка. Система отсчёта. Радиус-вектор. Траектория. Путь. Вектор перемещения. Скорость.
- •4. Вычисление пройденного пути. Средняя скорость прохождения пути.
- •5. Ускорение. Понятие о кривизне. Нормальное и тангенциальное ускорение.
- •6. Основная задача механики.
- •7.Абсолютно твердое тело. Поступательное и вращательное движение. Вектора элементарного угла поворота, угловой скорости и углового ускорения. Связь линейных и угловых характеристик движения.
- •8. Первый закон Ньютона - постулат существования инерциальной системы отсчета.
- •9. Понятие силы и инертной массы. Импульс. Второй закон Ньютона.
- •10. Третий закон Ньютона.
- •11. Понятие о механической системе. Закон сохранения импульса (зси).
- •12. Центр масс. Теорема о движении центра масс.
- •13. Центр масс. Теорема о движении центра масс.
- •14. Реактивное движение. Формула Циолковского.
- •15. Проблемы космических полетов.
- •16. Понятие о механической работе и энергии. Мощность
- •17. Кинетическая энергия.
- •24. Абсолютно упругий удар.
- •25. Абсолютно не упругий удар.
- •26. Момент силы, момент импульса относительно точки и оси.
- •27. Уравнение моментов.
- •28. Закон сохранения момента импульса системы материальных точек.
- •29.Основное ур-ие динамики вращ. Движения.
- •30. Момент инерции. Теорема Гюйгенса – Штейнера.
- •32. Кинетическая энергия вращательного движения.
- •33. Работа и мощность при вращательном движении.
- •36.Скорость света –инвариант относительно исо. Опыт Бронч - Бруевича.
- •39. Преобразования Лоренца
- •40.Относительность одновременности.
- •41. Длина отрезка в разных системах отсчета.
- •42. Интервал времени в разных системах отсчета. Опыт с мюонами.
- •46. Взаимосвязь массы и энергии. Кинетическая энергия в релятивисткой механике.
- •47. Взаимосвязь импульса и энергии, кинетической энергии и импульса.
- •48. Частицы с массой покоя, равной нулю.
- •49. Понятие о неинерциальных системах отсчета.
- •50. Сила инерции. Принцип Даламбера.
- •51. Центробежная сила инерции.
- •52. Сила Кориолиса. Закон Бэра.
- •53. Закон всемирного тяготения.
- •54. Напряженность поля тяготения. Принцип суперпозиций для потенциалов.
- •55. Работа в поле тяготения. Потенциальная энергия в поле тяготения.
- •56. Потенциал поля тяготения. Принцип суперпозиций для потенциалов. Эквипотенциальные поверхности.
- •57. Космические скорости.
- •58. Законы Кеплера
- •59. Статистический и термодинамический методы.
- •60. Понятие об идеальном газе. Законы идеального газа.
- •61. Поток молекул.
- •62. Уравнение Клаузиуса - основное ур-е мкт идеального газа.
- •63. Следствия из основного ур-ия мкт.
- •Законы идеального газа
- •67. Поток молекул смотреть в билете №61
- •68. Следствия из основного уравнения смотреть в билете №63
- •69. Эргодическая система
- •70. Распределение молекул по скоростям.
- •1. Средняя арифмитическая скорость
- •2.Средняя квадратичная.
- •72. Барометрическая формула.
- •73. Распределение Больцмана по потенциальным энергиям. Опыт Перрена.
- •74. Степени свободы. Закон равномерного распределение энергии по степеням свободы.
- •75. Внутренняя энергия системы - функция состояния. Макроскопическая работа. Теплота. Эквивалентность теплоты и работы. Первое начало термодинамики.
- •81.Неполноценность I начала термодинамики. Различные формулировки второго начала. Круговые процессы. Тепловые машины.
- •80. Адиабатный процесс. Уравнение адиабаты. Политропный процесс.
- •76.Применение 1 начала терм-ки к изопроцессам в идеальном газе
- •82.Цикл Карно с идеальным газом
- •86.Закон возрастания энтропии. Гипотеза о тепловой смерти Вселенной
- •87.Статистический смысл 2-го начал термодинамики.
- •90.Общие сведения о явлениях переноса. Средн длина свободн пробега молекул.
- •91. Диффузия.
- •84.Термодинамическая вероятность макроскопического состояния. Распределение молекул по объёму.
- •85.Энтропия. Формула Больцмана.
59. Статистический и термодинамический методы.
Статистический метод в основе лежит модель которая описывается уравнениями теории вероятности и математической статистики.
Основываясь на молекулярно-кинетических
Представлениях о веществе сформулированы статистические распределения.
1.Распределение молекул по объему.
2.Распределение молекул по скоростям
3.Распределение молекул по потенциальным энергиям
4.Распределение молекул по степеням свободы
Они характеризуют состояние системы
Термодинамический метод в основе лежат опытные факты проверенные человеком.
Достоверность этого метода выше.
Общие свойства макроскопических систем
Находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями.
60. Понятие об идеальном газе. Законы идеального газа.
Изотермический процесс
Т=const
Изобарный процесс
Р=const
Изохорный процесс
V=const
Закон Авогадро - моли любых газов при одинаковой температуре и давлении занимают одинаковые объемы.
Закон Дальтона-давление смеси идеальных газов равно сумме порциональных давлений входящих в него газов.
Уравнение Клайперона-Менделеева
Pv=M/mRT
Парциальное давление – давление, которое бы производил газ, входящий в состав газовой смеси, если бы он один занимал весь объём, в котором находится смесь.
61. Поток молекул.
д![]() ля
упрощения
ля
упрощения
хаотичное движение молекул
заменяют движением по
3![]() -м
осям x,y,z.
-м
осям x,y,z.
![]()
-плотность потока молекул число молекул,
прошедших через единичную площадку,
расположенную перпендикулярно направлению движения
1все молекулы имеют одинаковую скорость
2молекулы движутся только вдоль координатных осей x,y,z.
Т.к. пространство изотропно, то вдоль каждой из осей могут двигаться 1/3 всех молекул, находящихся в объеме. при этом половина этого числа может двигаться в положительном направлении оси, другая половина – в отрицательном направлении.
![]() -концентрация
молекул.
-концентрация
молекул.
![]() -число молекул в
объеме
-число молекул в
объеме ![]()
![]() -число
молекул, движущихся в положительном
направлении одной из осей.
-число
молекул, движущихся в положительном
направлении одной из осей.
Уравнение(3)
подставляем в (1):![]()
Плотность
потока молекул.![]() -в
векторном виде.
-в
векторном виде.
Если ввести понятие средней скорости, и всё учесть, то
![]()
62. Уравнение Клаузиуса - основное ур-е мкт идеального газа.
![]() -давление
газа на стенку.
-давление
газа на стенку.
Е![]() сли
газ состоит изN
молекул, движущихся со скоростями
сли
газ состоит изN
молекул, движущихся со скоростями
-то вводится понятие средней квадратичной
скорости:

![]()
Уравнение Клаузиуса связывает
характеристики
макромира ![]() с
с
Характеристиками
микромира ![]()
В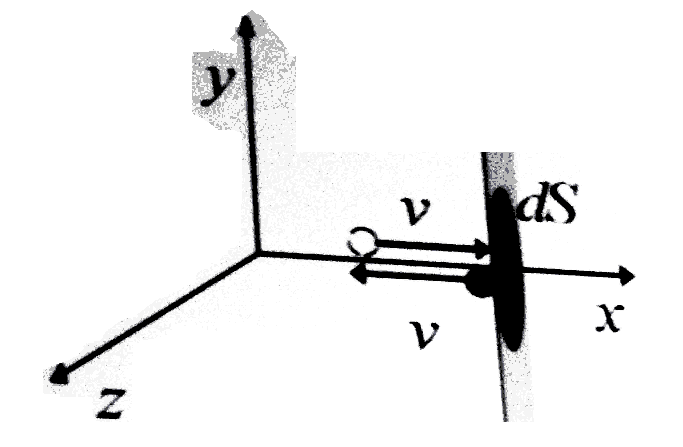 ывод
уравнения Клаузиуса
ывод
уравнения Клаузиуса
Удар о стенку – абсолютно упругий.
За счет действия силы реакции опоры импульс меняется на противоположный:
![]()
![]() -изменение
импульса молекулы
-изменение
импульса молекулы
при ударе об стенку
63. Следствия из основного ур-ия мкт.
1.Внутренняя энергия идеального газа.
В
сосуде N
молекул, каждая обладает энергией![]()
![]()
Внутренняя
энергия: ![]()
![]() .
.
![]()
![]()
2![]()
 .Абсолютная
температура – мера интенсивности
хаотического движения атомов и молекул.
.Абсолютная
температура – мера интенсивности
хаотического движения атомов и молекул.
![]()

![]()
![]()
![]()
![]()
подставляем в (1)

Абсолютная температура – мера энергии хаотического движения (мера интенсивности хаотического движения).
3.Другой вид уравнения.
![]()

![]()
![]()
![]()
![]()
64. Макроскопические тела. Статистический и термодинамический метод.
*статистический метод:
В основе лежит модель, которая описывается уравнениями теории вероятности и математической статистики.
Основываясь на молекулярно-кинетических представлениях о веществе (все тела состоят из молекул, находящихся в непрерывном хаотическом движении), сформулированы статические распределения
Статистические распределения:
1распределение молекул по объему- n=const
2 распределение молекул по скоростям–распределение максвелла
3 распределение молекул по потенциальным энергиям – распределение Больцмана
4.закон равномерного распределения энергии по степеням свободы.
Из этих распределений получают средние значения физических величин, которые характеризуют состояние системы.
*термодинамический метод:
В основе лежат опытные факты, проверенные человеком.
Достоверность этого метода выше.
Метод изучает общие свойства макроскопических систем, находящиеся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями.
Основные законы термодинамики:
1 начало термодинамики
- закон сохранения энергии тепловых
процессов. ![]() ,
,
![]() -тепло,
подводимое к системе,
-тепло,
подводимое к системе,
![]() -внутренняя энергия
системы
-внутренняя энергия
системы
![]() -работа
,совершаемая системой
-работа
,совершаемая системой
2 начало термодинамики - характеризует направление протекания процессов. дополняет 1 начало термодинамики.
Формулировка Клаузиуса (1850г):тепло не может самопроизвольно переходить от тепла, менее нагретого, к более нагретому.
Для кругового
процесса:![]()
3 начало термодинамики: абсолютный нуль температуры недостижим- теорема Нернста.
![]()
Абсолютный нуль температуры, при которой прекращается хаотическое движение молекул.
65. Термодинамическая система- совокупность макроскопических тел, которые обмениваются энергией, как между собой, так и с внешним телами(внешней средой).
Одно макроскопическое тело это уже термодинамическая система.
Статический и термодинамический метод(смотреть в 1ом билете)
Равновесные процессы –процесс при которых скоростью изменения термодинамических параметров бесконечно мала, т.е. изменение термод-их параметров происходит за бесконечно большие времена.
Р авновесные
процессы –процесс, который проходит
через последовательность равновесных
сотояний.
авновесные
процессы –процесс, который проходит
через последовательность равновесных
сотояний.
Любое равновесное состояние
может быть изображено точкой.
Следовательно, любой равновес процесс можно изобразить
графически.
Неравновесный процесс – процесс, при котором изменение термодинамических параметров на конечную величину происходит за конечное время.
66. Идеальный газ – модель.
1.Собственны объем молекул газа пренебрежимо мал по сравнению с объемом пренебрежимо мал по сравнению с объемом сосуда. Молекула – материальная точка.
2. Между молекулами газа отсутствуют силы взаимодействия.
3.Столкновения молекул газа между собой и со стенками сосуда абсолютно упругие. Следовательно идеальный газ – система независимых материальных точек.
