
- •Учебно-методический комплекс дисциплины «физическая химия» для студентов всех форм обучения
- •Содержание
- •1. Цели освоения учебной дисциплины
- •2. Место учебной дисциплины в структуре ооп университета
- •2.1. Из курса «Химия»
- •2.2. Из курса «Физика»
- •2.3.Из курса «Математика»
- •3. Компетенции студента, формируемые в результате освоения дисциплины
- •По окончании изучения курса студент должен:
- •4. Структура дисциплины Объем дисциплины и виды учебной работы
- •Содержание и тематическое планирование дисциплины
- •5. Образовательные технологии
- •6. Оценочные средства для текущего контроля успеваемости, промежуточной аттестации по итогам освоения дисциплины и учебно-методическое обеспечение самостоятельной работы студентов
- •6.1.Задания и методические указания для выполнения контрольной работы
- •6.1.1. Теоретические сведения
- •1. Первый закон термодинамики для химических процессов
- •Изохорический и изобарический тепловые эффекты
- •Связь между изобарическим и изохорическим тепловыми эффектами
- •Термохимическое уравнение
- •Стандартное состояние
- •Теплота образования химического соединения
- •Расчет стандартного теплового эффекта (стандартной энтальпии) при заданной температуре реакции
- •2. Второй закон термодинамики
- •2.1.Определительное уравнение энтропии
- •2.2 Расчеты изменений энтропии различных систем Изобарический нагрев веществ без фазовых превращений
- •Учет фазовых превращений 1-го рода при расчете энтропии системы
- •Расчет стандартного изменения энтропии () при протекании химической реакции
- •При нагревании от 298к до заданной температуры т
- •3. Основные фрагменты по теме “химическое равновесие. Константа равновесия”
- •Влияние температуры на константу равновесия. Уравнение изобары
- •Расчет химического сродства () в нестандартных условиях. Уравнение изотермы
- •6.1.2. Задания к контрольной работе
- •6.2. Вопросы для подготовки к зачету
- •Поверхностные явления в физико-химических системах
- •Кинетика растекания жидкостей (расплавов. Кинетика химических реакций
- •6.3. Практические работы
- •6.3.1. Практическая работа «первый закон термодинамики» Задание 1
- •Задание 2
- •Задание 3
- •Задание 4
- •Задание 5
- •Задание 6
- •Задание 7
- •Задание 8
- •Задание 9
- •Задание 10
- •6.3.2. Практическая работа «Стандартное химическое сродство элементов к кислороду"
- •Контрольные задания
- •6.3.3. Практическая работа «расчет химических равновесий» Задание 1
- •6.3.4. Практическая работа « поверхностные явления
- •6.3.5. Практическая работа «кинетика химических реакций»
- •Задание 5
- •8. Материально-техническое обеспечение дисциплины
Влияние температуры на константу равновесия. Уравнение изобары
Уравнение, определяющее зависимость константы равновесия химической реакции от температуры, называют уравнением изобары
![]() (46)
(46)
Из этого уравнения
следует, что знак первой производной
![]() определяется знаком теплового эффекта
реакции (∆Н).
определяется знаком теплового эффекта
реакции (∆Н).
а) ∆Н > 0, Т – растет, К – увеличивается;
б) ∆Н < 0, Т – растет, К – уменьшается;
в) ∆Н = 0, Т – растет, К – постоянно.
Расчет химического сродства () в нестандартных условиях. Уравнение изотермы
Значения
![]() находят по уравнению изотермы химической
реакции
находят по уравнению изотермы химической
реакции
![]() ,
(47)
,
(47)
где
К – константа равновесия химической
реакции;
![]() –
произведение фактических активностей
записывается также, как константа
равновесия, но в выражение входят не
равновесные, а фактические активности
реагентов.
–
произведение фактических активностей
записывается также, как константа
равновесия, но в выражение входят не
равновесные, а фактические активности
реагентов.
Согласно этому уравнению возможны варианты:
а)
![]() <
К ,
<
К ,![]() <
0 – реакция идет в прямом направлении;
<
0 – реакция идет в прямом направлении;
б)
![]() >
К ,
>
К ,![]() >
0 – возможна только обратная реакция;
>
0 – возможна только обратная реакция;
в)
![]() =
К ,
=
К ,![]() =
0 – в системе равновесие.
=
0 – в системе равновесие.
ПРИМЕР
Будет ли окисляться
углерод, при Т = 1800К, если в стали [% С] =
0,25; {% О} = 30; {% CО}
= 70;
![]() атм?
атм?
![]() ,(
расплав считать идеальным).
,(
расплав считать идеальным).
Решение:
 , т.к.
раствор идеальный, =1,
следовательно
, т.к.
раствор идеальный, =1,
следовательно

![]()
![]() Дж,
Дж,
![]() 210,72
Дж/К.
210,72
Дж/К.
![]() Дж
Дж
К
=
![]() .
.

![]() атм
атм
![]() атм
атм
![]() .
.
DGT = RT (ln 52,27 – ln7,3 × 1033)
![]() ,
следовательно, DGT
< 0, углерод
будет окисляться в стали при
Т = 1800К при заданных фактических
концентрациях.
,
следовательно, DGT
< 0, углерод
будет окисляться в стали при
Т = 1800К при заданных фактических
концентрациях.
6.1.2. Задания к контрольной работе
Контрольная работа состоит из теоретической и практической частей. В теоретической части необходимо представить ответ на задание в реферативном виде, основываясь на материал, изученный по учебникам, учебным пособиям, монографиям и средствам Интернета. В практической части необходимо подробно с пояснениями представить решение 2-х задач.
Выбор варианта контрольной работы осуществляется преподавателем в соответствии с порядковым номером студента в экзаменационной ведомости или кафедральном журнале. Затем студент выбирает номера вопросов.
Таблица 4 - Варианты контрольных вопросов
|
Номер варианта контрольной работы |
Номера заданий | ||
|
1 |
2 |
3 |
4 |
|
1 |
1 |
26 |
51 |
|
2 |
2 |
27 |
52 |
|
3 |
3 |
28 |
53 |
|
4 |
4 |
29 |
54 |
|
5 |
5 |
30 |
55 |
|
6 |
6 |
31 |
56 |
|
7 |
7 |
32 |
57 |
|
8 |
8 |
33 |
58 |
|
9 |
9 |
34 |
59 |
|
10 |
10 |
35 |
60 |
|
11 |
11 |
36 |
61 |
|
12 |
12 |
37 |
62 |
|
13 |
13 |
38 |
63 |
|
14 |
14 |
39 |
64 |
Окончание табл. 4
|
1 |
2 |
3 |
4 |
|
15 |
15 |
40 |
65 |
|
16 |
16 |
41 |
66 |
|
17 |
17 |
42 |
67 |
|
18 |
18 |
43 |
68 |
|
19 |
19 |
44 |
69 |
|
20 |
20 |
45 |
70 |
|
21 |
21 |
46 |
71 |
|
22 |
22 |
47 |
72 |
|
23 |
23 |
48 |
73 |
|
24 |
24 |
49 |
74 |
|
25 |
25 |
50 |
75 |
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Первый закон термодинамики. Применение первого закона термодинамики к изобарическим процессам.
Первый закон термодинамики и химические процессы. Закон Гесса. Тепловой эффект химической реакции.
Скорость химической реакции. Кинетическое уравнение скорости химической реакции. Зависимость скорости от температуры. Понятие об энергии активации процессов. Порядок реакции. Молекулярность реакции.
Второй закон термодинамики. Энтропия, ее физический смысл.
Вырожденное состояние веществ, его характеристика. «Третий закон термодинамики».
Энтропия. Статистическое толкование энтропии.
Тепловой эффект химической реакции. Экзо- и эндотермические реакции. Зависимость теплового эффекта реакции от температуры (уравнение Кирхгофа).
Поверхностные явления (поверхностное натяжение, адгезия, когезия, явление смачивания), их проявление в условиях сварки.
Энтропия. Вычисление энтропии веществ при нагреве и в результате химических реакций. Учет фазовых превращений 1-го рода.
Изменение свободной энергии Гиббса – критерий направленности химических процессов. Химическое сродство веществ, его характеристика и возможность определения.
Парциальные молярные величины в растворах. Парциальная молярная свободная энергия.
Парциальные молярные величины. Уравнения Гиббса-Дюгема.
Гомогенные и гетерогенные реакции. Кинетика и механизм гетерогенных реакций в условиях сварки.
Растворы. Виды и характеристика растворов, участвующих в сварочных процессах. Термодинамическая активность компонентов растворов. Коэффициент активности вещества.
Равновесие. Константа равновесия – мера глубины протекания химических процессов. Использование термодинамических активностей веществ для выражения константы равновесия в различных системах.
Равновесие. Влияние температуры и давления на химическое равновесие. Уравнение изобары.
Фазовые превращения 1-го рода, их характеристика. Учет фазовых превращений 1-го рода в термохимических расчетах.
Нестандартный химический потенциал и термодинамическая активность газообразного вещества.
Растворы. Идеализированные растворы (бесконечно разбавленные и совершенные растворы) и реальные растворы. Применение закона Рауля и закона Генри для идеализированных и реальных растворов.
Явление диффузии. Диффузия в твердых телах. Законы Фика. Коэффициент диффузии. Характеристика диффузионных процессов, протекающих при сварке плавлением.
Правило фаз Гиббса.
Растворы. Межчастичное взаимодействие компонентов растворов. Параметры взаимодействия.
Роль поверхностных явлений в физико-химических процессах. Адсорбция.
Мера термодинамического сродства. Мера сродства по Гиббсу.
Химическое равновесие. Закон действующих масс.
ПРАКТИЧЕСКАЯ ЧАСТЬ
Определить количество теплоты, которое необходимо для нагревания при V = const 25 г кислорода, находящегося при 3500 С от 1013 до 5065 ГПа.
Определить тепловой эффект химической реакции при различных температурах при температуре Т = 800 К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А):
Са(ОН)2 кр = СаОт + Н2Ог, ∆Н0800
Определить тепловой эффект химической реакции при различных температурах при температуре Т = 900 К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А):
СаСО3 т = СаОт + СО2 г, ∆Н0900
Определить работу адиабатического сжатия 1 моля двухатомного идеального газа при повышении температуры от 15 до 250 С.
Определить тепловой эффект химической реакции при различных температурах при температуре Т = 800 К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А):
Са(ОН)2 кр = СаОт + Н2Ог, ∆Н0800
Теплоты образования воды и водяного пара равны соответственно -285,8 и – 241, 8 кДж/моль. Рассчитать теплоту испарения 1,8 кг воды при 25 0С.
Определить тепловой эффект химической реакции при различных температурах при температуре Т = 600 К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А):
СО + Cl2 г = СОCl2 г, ∆Н0600
Медь плавится при 1065 0С, теплота плавления равна 179,9 Дж/г. К 1 кг меди, взятому при 15 0С, подведено 541,2 кДж. Истинная удельная теплоемкость меди Ср = 0,3563 + 9,88 10-5 Т Дж/(г× К). Какое количество меди расплавится?
Определить тепловой эффект химической реакции при различных температурах при температуре Т = 500 К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А):
2NO2 г = 2NO г + O2 г, ∆Н0500
Средняя удельная теплоемкость СО2 при постоянном давлении в интервале температур от 0 до 1000 0С выражается уравнением Ср = 1,003+10,27 10-5Т + 19,41 103 Т-2 Дж/(г× К). Найти истинную молярную теплоемкость СО2 при 500 0С.
Определить тепловой эффект химической реакции при различных температурах при температуре Т = 1200 К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А):
СО2 г+ Н2 г = СО г+ Н2O г, ∆Н01200
Тепловые эффекты реакций при 0 0С и постоянном давлении 1013 ГПа:
С + О2 г = СО2 г -405,8 кДж;
СО + 1/2О2 г = СО2 г -284,5 кДж;
Н2 + 1/2О2 г = Н2Ог -246,8 кДж.
Рассчитать при тех же условиях тепловые эффекты следующих реакций:
Сграф +1/2О2 г = СОг , ∆Н1;
С + 2 Н2Ог = СО2 г + 2Н2 г, ∆Н2;
С + Н2Ог = СО г + Н2 г, ∆Н3;
2СО г = С + СО2 г, ∆Н4.
Определить тепловой эффект химической реакции при различных температурах при температуре Т = 2000 К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А):
2СО2 г = СО г+ O2 г, ∆Н02000
Теплота образования Fe2O3 т составляет -821,3 кДж/моль, а теплота образования Al2O3 равна – 1675,0 кДж/моль. Рассчитать тепловой эффект реакции восстановления 1 моля Fe2O3 т металлическим алюминием.
Определить тепловой эффект химической реакции при различных температурах при температуре Т = 1000К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А):
СО + 3Н2 г = СН4 г + Н2Ог, ∆Н01000
Теплота сгорания аморфного углерода, графита и алмаза соответственно равны – 409,2; -394, 6 и -395,3 кДж/моль. Рассчитать теплоту аллотропного превращения: 1) аморфного углерода в графит; 2) аморфного углерода в алмаз; 3) графита в алмаз.
Определить тепловой эффект химической реакции при различных температурах при температуре Т = 600К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А):
СН4 г + СО2 г = 2СО г +2Н2 г, ∆Н0600
Вычислить тепловой эффект реакции восстановления оксида железа (2) водородом, пользуясь следующими данными:
FeOт + СОг = FeOт +СО2 г, ∆Н = 13,18 кДж/моль;
СО + 1/2О2 г = СО2 г -284,5 кДж;
Н2 г+ 1/2О2 г = Н2Ог -246,8 кДж.
Определить тепловой эффект химической реакции при различных температурах при температуре Т = 700 К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А):
2Н2 г + СО г = СН3ОН г, ∆Н0700
Определить тепловой эффект химической реакции при различных температурах при температуре Т = 800 К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А):
3Fe3O4 кр + 8Al кр = 4 Al2О3 т + 9Fe т, ∆Н0800
Определить тепловой эффект химической реакции при различных температурах при температуре Т = 800 К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А)
MgO т + Н2 г = Mg т + Н2Ог, ∆Н0800
Определить тепловой эффект химической реакции при различных температурах при температуре Т = 1000 К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А)
Fe2O3 кр + 2Al кр = Al2О3 т + 2Fe т, ∆Н01000
Вычислите изменение энтропии при нагревании 16 кг кислорода от 273 до 373 К: 1) при постоянном объеме; 2) при постоянном давлении. Считать кислород идеальным газом.
Определить тепловой эффект химической реакции при различных температурах при температуре Т = 600 К (температурные зависимости изобарных теплоемкостей веществ приведены в таблице Приложения А)
2H2S г + 3O2 г = 2SO2 г+ 2Н2Ог, ∆Н0600
Рассчитать изменение энтропии при нагревании 58,82 кг В2О3 от 298 до 800 К, теплоемкость В2О3 С0р = 36,5525 + 106,345 10-3Т Дж/(моль×К).
Твердый хлороводород (HCl) претерпевает фазовый переход при 98,36 К, при этом энтальпия изменяется на 1,19 кДж/моль. Рассчитайте молярную энтропию и внутреннюю энергию фазового перехода.
Выразить константу равновесия химической реакции (К).
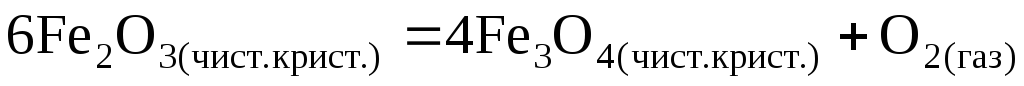 .
Возможна ли данная реакция при
Т = 1800 К, если
.
Возможна ли данная реакция при
Т = 1800 К, если ?
?
Выразить константу равновесия химической реакции (К)
 (приняв
расплав идеальным). Будет ли окисляться
кремний в атмосфере воздуха
(приняв
расплав идеальным). Будет ли окисляться
кремний в атмосфере воздуха
 при Т = 1800 К и
при Т = 1800 К и
 ?
?
Определите изменение энтропии, если 100×10-3 кг воды, взятой при 273 К, превращается в пар при 390 К. Удельная теплота испарения воды при 373 К равна 2263,8×103 Дж/кг; удельная теплоемкость жидкой воды 4,2 Дж/(кг×К); удельная теплоемкость пара при постоянном давлении 2,0×103 Дж/(кг×К).
Выразить константу равновесия химической реакции (К).
 .
Возможно ли осуществление данной
реакции при Т = 1000 К, если
.
Возможно ли осуществление данной
реакции при Т = 1000 К, если
 ?
?
Выразить константу равновесия химической реакции (К).
![]() .
Будет ли разлагаться водяной пар при
.
Будет ли разлагаться водяной пар при
![]() ,
если
,
если![]() ?
?
Выразить константу равновесия химической реакции (К)
 .
Возможен ли прямой процесс при
Т = 1000К и
.
Возможен ли прямой процесс при
Т = 1000К и ?
?
Бромбензол (С6Н5Br) кипит при 429,8 К, его теплота парообразования при этой температуре 241,9 103 Дж/кг. Рассчитайте изменение энтропии при испарении 10 кг бромбензола.
Выразить константу равновесия химической реакции (К)
C6H6
(чист.
жидк.)
+7,5O2
(газ) = 6СО2
(газ)
+ 3Н2О(газ)
. Возможно ли горение бензола при
Т = 2000 К и
![]()
Рассчитайте изменение энтропии в процессе смешения 5 кг воды при температуре Т1 = 353 К с 10 кг воды при Т2 = 290 К. Теплоемкость воды считать постоянной и равной 4,2 Дж/(моль×К).
Выразить константу равновесия химической реакции (К)
С(чист.
графит.)
+2N2O(газ)
= СО2
(газ)
+2N2
(газ).
Возможна ли данная реакция при
Т = 2000К, если
![]() ?
?
Выразить константу равновесия химической реакции (К)
2(FeО) + [Si] = 2[Fe](чист.) + (SiO2), приняв расплав идеальным. Будет ли окисляться кремний при T = 2200K, если в металле [%Si] = 2; в шлаке (% FeO) = 10, (% SiO2) = 30?
Выразить константу равновесия химической реакции (К)
2H2S
(газ)
+ 3O2
(газ)
= 2H2O
(газ)
+ 2SO2
(газ).
Возможна
ли данная реакция при Т =
1800К, если {%SO2}(факт.)=
11,5;
![]()
Выразить константу равновесия химической реакции (К)
2CaF2
(чист.)
+ SiO2
(чист.)
= 2СаО (чист.)
+ SiF4
(г). Будет
ли выделяться фтористый кремний SiF4
в атмосферу при Т = 2000К и
![]() атм?
атм?
Выразить константу равновесия химической реакции 2[Mn] + {O2} = 2(MnO) (чист) . Окислится ли марганец в расплаве при Т = 2800 К, если
 (расплав считать идеальным)?
(расплав считать идеальным)?
Выразить константу равновесия химической реакции (К)
CuO (крист. чист.) + СОг = Сu (крист. чист.) + СО2 г. Возможна ли реакция при Т = 2100К, если %{CO}(факт.)= 80; {%CO2}(факт)= 20; pобщ.= 2 атм ?
Выразить константу равновесия химической реакции (К)
СaCO3
(чист.
крист.)=
СaO(чист.
крист.) +
СО2
(г).
Будет ли
осуществляться данная реакция при Т =
3600К и
![]() ?
?
Выразить константу равновесия химической реакции
2H2 (г) + O2 (г) = 2Н2О (г). Возможна ли диссоциация Н2О при Т = 1500 К, если pобщ.= 0,5 атм., {%H2}(факт.)= 20, {%O2}(факт.) = 10, {%H2O}(факт.) = 70?
Выразить константу равновесия химической реакции (К).
FeO (чист. крист.) + Н2 (г) = Fe (чист. крист.) + Н2О (г). Будет ли происходить восстановление оксида железа при Т = 2100 К, если {%H2}(факт.)= 90; {%H2O}(факт.)= 10; pобщ. = 0,8 атм?
Выразить константу равновесия химической реакции (K)
![]() .
Возможен ли прямой процесс при
Т = 2800 К, если
.
Возможен ли прямой процесс при
Т = 2800 К, если
![]() ?
?
Выразить константу равновесия химической реакции (К)
![]() .
Возможно ли разложение оксида кальция
при Т = 3200 К,
.
Возможно ли разложение оксида кальция
при Т = 3200 К,
![]() ?
?
Выразить константу равновесия химической реакции (К)
NiO (чист. крист.) + СО (г) = Ni (чист. крист.) + СО2 (г). Возможна ли данная реакция в прямом направлении при Т = 2000К и {%СО}(факт.) = 90, {%CO2}(факт.)= 10, робщ= 0,6 атм ?
Выразить константу равновесия химической реакции (К)
2[Al]
+ 3[O]
= Al2O3
(чист. крист.)
, cчитая
расплав идеальным. Вычислить константу
равновесия химической реакции при Т =
2200 К, если известно, что
![]() = -390 кДж. Будет ли окислятся алюминий
при Т = 2200К, если в стали 0,015%[Al] и 0,15%[O] ?
= -390 кДж. Будет ли окислятся алюминий
при Т = 2200К, если в стали 0,015%[Al] и 0,15%[O] ?
Выразить константу равновесия химической реакции (К)
SiO2 (чист. крист.) + H2 (г) = Si (чист. крист.) + H2O (г). Возможна ли данная реакция в обратном направлении при Т = 2500 К и {%H2O} (факт.)= 10, {%H2} (факт.)= 90, pобщ.= 1,2 атм?
Определить расчетным путем возможность протекания приведенной химической реакции при заданной температуре.
Т = 1500 К 2 MnOт = 2 Mnт + O2 г
