
- •2. 1.5. Квантовые числа и атомные орбитали
- •[Править]Концепция гибридизации
- •[Править]Виды гибридизации [править]sp-гибридизация
- •[Править]sp2-гибридизация
- •[Править]sp3-гибридизация
- •[Править]Гибридизация и геометрия молекул
- •13. 1. Характеристика вещества в - газообразном состоянии в условиях вакуума
- •14.Агрегатное состояние вещества – твёрдое тело
- •15. Агрегатное состояние вещества – жидкость
- •[Править]Способы выражения константы равновесия
- •[Править]Стандартная константа равновесия
- •[Править]Константа равновесия реакций в гетерогенных системах
- •[Править]Константа равновесия и изменение энергии Гиббса
- •21. Принцип Ле Шателье — Брауна
- •[Править]Влияние температуры
- •[Править]Влияние давления
- •[Править]Влияние инертных газов
- •[Править]Влияние концентрации
- •[Править]Примечания
- •23. 6.1. Скорость химических реакций
- •6.1.1 Зависимость скорости реакции от концентрации веществ
- •6.1.2. Особенности кинетики гетерогенных реакций
- •6.1.3. Зависимость скорости реакции от температуры
- •6.1.4. Уравнение Аррениуса
- •6.1.5. Энергия активации
- •6.1.6. Предэкспоненциальный множитель
- •6.1.7. Зависимость скорости реакции от катализатора
- •6.1.8. Гомогенный катализ
- •6.1.9. Гетерогенный катализ
- •25. Способы выражения концентрации растворов
- •Пересчет концентраций растворов из одних единиц в другие
- •Упаривание раствора
- •Концентрирование раствора
- •Смешивание растворов с разными концентрациями
- •Разбавление раствора
- •26. Физико-химические свойства разбавленных растворов неэлектролитов, приближающихся по свойствам k идеальным
- •[Править]Первый закон Рауля
- •[Править]Отклонения от закона Рауля
- •[Править]Второй закон Рауля
- •[Править]Понижение температуры кристаллизации растворов
- •[Править]Повышение температуры кипения растворов
- •[Править]Криоскопическая и эбулиоскопическая константы
- •[Править]Растворы электролитов
- •28. Понижение температуры кристаллизации растворов
- •[Править]Повышение температуры кипения растворов
- •[Править]Криоскопическая и эбулиоскопическая константы
- •[Править]Растворы электролитов
- •Равновесный электродный потенциал.
- •Трехэлектродная цепь
- •1) Гомогенный механизм электрохимической коррозии:
- •2) Гетерогенный механизм электрохимической коррозии:
[Править]Влияние концентрации
Влияние концентрации на состояние равновесия подчиняется следующим правилам:
При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
[Править]Примечания
23. 6.1. Скорость химических реакций
Раздел химии, изучающий скорости и механизмы химических реакций, называется химической кинетикой.
Химические реакции протекают с различными скоростями. Некоторые из них заканчиваются за секунды, другие - за минуты, часы, дни; некоторые для своего протекания требуют десятилетий. Кроме того, одна и та же реакция может протекать быстро при повышенных температурах и медленно – при охлаждении.
Знание скоростей химических реакций имеет большое значение, так как определяет размеры и производительность аппаратуры, количество получаемого продукта. На практике важно знать, как изменить условия, чтобы реакция протекала с требуемой скоростью.
Скорость химической реакции – это изменение количества реагирующего вещества или продукта реакции за единицу времени в единице объема (для гомогенной реакции) или на единице поверхности раздела фаз (для гетерогенной реакции).
Гомогенной называется реакция, протекающая в однородной среде (в одной фазе). Гетерогенные реакции протекают на границе раздела фаз, например твердой и жидкой, твердой и газообразной. Отношение количества вещества к единице объема называется концентрацией с, моль/л.
Различают среднюю и мгновенную скорости реакции. Средняя скорость реакции равна:
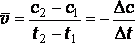 ,
,
где с2и с1 – концентрации исходного вещества в момент времени t2 и t1.
Знак минус означает, что концентрация исходного вещества уменьшается. В ходе реакции изменяются концентрации реагирующих веществ и соответственно скорость реакции. Скорость реакции в данный момент времени или, мгновенная (истинная) скорость реакции, равна:
![]()
Скорость реакции принимается всегда положительной, поэтому производная исходных концентраций берется со знаком минус, а продуктов реакции – со знаком плюс.
Скорость реакции имеет единицу измерения [моль м-3 с-1], [моль л-1с-1].
Скорость реакции зависит от природы реагирующих веществ. Некоторые реакции протекают со взрывом, другие могут идти годами. На скорость реакции влияют такие факторы как концентрация веществ, температура, катализаторы.
6.1.1 Зависимость скорости реакции от концентрации веществ
Чтобы произошла реакция, необходимо столкновение реагирующих частиц. Число столкновений растет с увеличением числа реагирующих частиц в единице объема, т.е. с увеличением концентрации веществ. Это утверждение нашло отражение в законе действующих масс, который установили в 1867 г. норвежские химики К.Гульдберг и П. Вааге:
при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для реакции
bB + dD = lL + mM
выражение кинетического уравнения скорости имеет вид
![]() ,
,
где k – константа скорости реакции, не зависит от концентрации веществ, но зависит от их природы и температуры; b и d –порядки реакции, установленные опытным путем (для простых реакций совпадают со стехиометрическими коэффициентами в уравнении), сА и сВ – концентрации реагентов.
Закон действующих масс справедлив лишь для наиболее простых по своему механизму реакций, протекающих в газах или растворах. Часто уравнение реакции не отражает ее механизма. Сложные реакции можно представить как совокупность простых процессов, протекающих последовательно или параллельно. Закон действующих масс справедлив для каждой отдельной стадии реакции, но не для всего взаимодействия в целом. Та стадия процесса, скорость которой минимальна, лимитирует (определяет) скорость реакции, в общем. Поэтому закон действующих масс для лимитирующей стадии процесса приложим и ко всей реакции в целом.
