
- •2. 1.5. Квантовые числа и атомные орбитали
- •[Править]Концепция гибридизации
- •[Править]Виды гибридизации [править]sp-гибридизация
- •[Править]sp2-гибридизация
- •[Править]sp3-гибридизация
- •[Править]Гибридизация и геометрия молекул
- •13. 1. Характеристика вещества в - газообразном состоянии в условиях вакуума
- •14.Агрегатное состояние вещества – твёрдое тело
- •15. Агрегатное состояние вещества – жидкость
- •[Править]Способы выражения константы равновесия
- •[Править]Стандартная константа равновесия
- •[Править]Константа равновесия реакций в гетерогенных системах
- •[Править]Константа равновесия и изменение энергии Гиббса
- •21. Принцип Ле Шателье — Брауна
- •[Править]Влияние температуры
- •[Править]Влияние давления
- •[Править]Влияние инертных газов
- •[Править]Влияние концентрации
- •[Править]Примечания
- •23. 6.1. Скорость химических реакций
- •6.1.1 Зависимость скорости реакции от концентрации веществ
- •6.1.2. Особенности кинетики гетерогенных реакций
- •6.1.3. Зависимость скорости реакции от температуры
- •6.1.4. Уравнение Аррениуса
- •6.1.5. Энергия активации
- •6.1.6. Предэкспоненциальный множитель
- •6.1.7. Зависимость скорости реакции от катализатора
- •6.1.8. Гомогенный катализ
- •6.1.9. Гетерогенный катализ
- •25. Способы выражения концентрации растворов
- •Пересчет концентраций растворов из одних единиц в другие
- •Упаривание раствора
- •Концентрирование раствора
- •Смешивание растворов с разными концентрациями
- •Разбавление раствора
- •26. Физико-химические свойства разбавленных растворов неэлектролитов, приближающихся по свойствам k идеальным
- •[Править]Первый закон Рауля
- •[Править]Отклонения от закона Рауля
- •[Править]Второй закон Рауля
- •[Править]Понижение температуры кристаллизации растворов
- •[Править]Повышение температуры кипения растворов
- •[Править]Криоскопическая и эбулиоскопическая константы
- •[Править]Растворы электролитов
- •28. Понижение температуры кристаллизации растворов
- •[Править]Повышение температуры кипения растворов
- •[Править]Криоскопическая и эбулиоскопическая константы
- •[Править]Растворы электролитов
- •Равновесный электродный потенциал.
- •Трехэлектродная цепь
- •1) Гомогенный механизм электрохимической коррозии:
- •2) Гетерогенный механизм электрохимической коррозии:
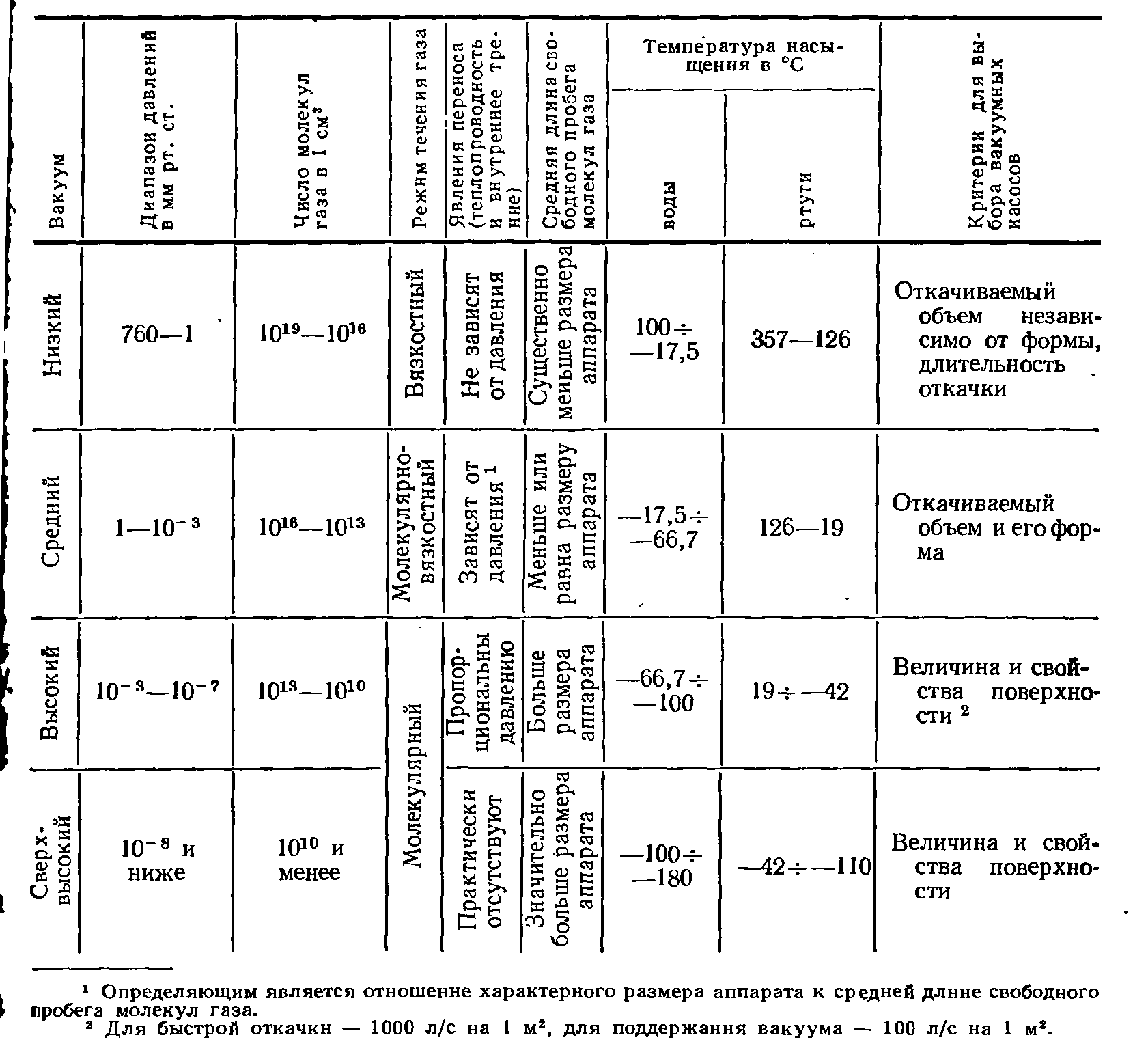
13. 1. Характеристика вещества в - газообразном состоянии в условиях вакуума
Под газообразным состоянием вещества понимается такое его состояние, которое характеризуется значительной подвижностью частиц. Вещество в газообразном состоянии вследствие большой подвижности молекул газа не может иметь определенного объема и формы; оно занимает всегда весь объем и имеет форму сосуда, в котором находится.
Давление газа в закрытом сосуде различно. В физике и технике принято называть вакуумом такое состояние газа, когда его давление меньше атмосферного. Наименьшее достигнутое в настоящее время давление составляет 10-13 мм рт. ст., наименьшее давление, применяемое в промышленных условиях, 10~9 мм рт. ст. Весь диапазон давлений от атмосферного до наименьшего достигаемого делится на области низкого, среднего, высокого и сверхвысокого вакуума (табл. 1). Сверхвысокий вакуум применяется в промышленности при проведении ядерных реакций, напылении тонких пленок, создании особо чистых поверхностей, для воспроизведения условий космоса и во многих других областях современной техники.
Основным критерием для характеристики вакуумного режима течения газа в аппарате является отношение средней длины свободного
Таблица 1
пробега молекул газа Л к характерному размеру аппарата d, так называемый критерий Кнудсена:
![]() (1)
(1)
В зависимости от величины отношения (1) различают режимы течения газа: молекулярный, когда средняя длина свободного пробега молекул значительно больше характерного размера аппарата, или Kn > 1; вязкостный, когда средняя длина свободного пробега значительно меньше характерного • размера аппарата, или Kn <С 1.
Промежуточное состояние газа характеризуется так называемым молекулярно-вязкостным режимом течения.
Таким образом, при молекулярном режиме течения газа определяющими являются столкновения молекул газа со стенками, а столкновений их одна с другой практически нет. Каждая молекула движется прямолинейно от стенки к стенке. При вязкостном режиме состояние газа приближается к состоянию, описываемому законами газовой динамики.
Давление может быть выражено в различных единицах. Для давлений, близких к атмосферному, пользуются величиной вакуума, выра,-жаемой в процентах от атмосферного давления; при более низких давлениях удобнее пользоваться абсолютными единицами. Различные единицы давления и соотношения между ними приведены в табл. 2 и на рис. 1.
Для перевода заданной величины давления из одних единиц в другие достаточно провести на рис. 1 горизонтальную прямую через известное значение давления. Тогда точки пересечения этой горизонтали с вертикальными линиями будут выражать заданное давление в соответствующих единицах.
Следует обратить внимание на то, что при давлении —10-13 мм рт. ст. число молекул газа в единице объема достаточно велико и можно еще пользоваться такими макроскопическими понятиями, как температура и давление газа, которые являются среднестатистическим результатом многочисленных столкновений молекул с твердой поверхностью.
Физическое состояние массы газа определяется тремя термодинамическими параметрами: давлением р, объемом V и температурой Т. Между этими параметрами существует определенная связь, называемая уравнением состояния, задаваемая в общем виде дается выражением f(p,V,T)=0 где каждая из переменных является функцией двух других. Французский инженер и физик Б. Клапейрон (1799—1864) получил уравнение состояния идеального газа, объединив законы Бойля—Мариотта и Гей-Люссака. Пусть данная масса газа занимает объем V1, образует давление р1 и находится при температуре T1. В другом произвольном состоянии масса газа описывается параметрами р2, V2, T2 (рис. 1). Переход из состояния 1 в состояние 2 осуществляется в виде двух процессов: 1) изотермического (изотерма 1–1'), 2) изохорного (изохора 1'–2). Гипербола вниз, потом круто вниз В соответствии с законами Бойля — Мариотта и Гей-Люссака запишем: p1v1=p2v2, p1/p2=T1/T2 Исключив из уравнений (1) и (2) получим pv/t=pv/t Так как состояния 1 и 2 были выбраны произвольно, то для данной массы газа величина pV/T остается постоянной, т. е. pV/T=const Выражение (3) является уравнением Клапейрона, в котором В — газовая постоянная, которая различна для разных газов. Русский ученый Д. И. Менделеев (1834—1907) сопоставил уравнение Клапейрона с законом Авогадро, отнеся уравнение (3) к одному молю, использовав молярный объем Vm. По закону Авогадро, при одинаковых р и Т моли всех газов занимают одинаковый молярный объем Vm, поэтому постоянная В будет равной для всех газов. Эта общая для всех газов постоянная обозначается R и называетсямолярной газовой постоянной. Уравнению pVm=RT удовлетворяет только идеальный газ, и оно является уравнением состояния идеального газа, которая называется также уравнением Менделеева-Клайперона. Числовое значение молярной газовой постоянной найдем из формулы (4), считая, что моль газа находится при нормальных условиях (р0= 1,013
·105 Па, T0=273,15 К, Vm=22,41
·10-3 м3/моль): R=8,31 Дж/(моль
·К).
От уравнения (4) для моля газа можно перейти к уравнению Менделеева-Клапейрона для произвольной массы газа. Если при данных давлении и температуре один моль газа занимает молярный объем Vm, то при тех же условиях масса m газа займет объем V= (m/М)Vm, где М — молярная масса (масса одного моля газа). Единица молярной массы — килограмм на моль (кг/моль). Уравнение Клапейрона — Менделеева для массы m газа pV=mRT/M
где nu = m/M — количество вещества. Часто пользуются несколько иной формой уравнения состояния идеального газа, вводя постоянную Больцмана: k=R/NA=1,38
·10-23 Дж/К
Исходя из этого уравнение состояния (4) запишем в виде p=RT/Vm=kNaT/Vm=nkt где NA/Vm = n — концентрация молекул (число молекул в единице объема). Таким образом, из уравнения p=nkT (6) мы видим, что давление идеального газа при данной температуре прямо пропорционально концентрации его молекул (или плотности газа). При одинаковых давлении и температуре любой газ содержат в единице объема одинаковое число молекул. Число молекул, которые содержатся в 1 м3 газа при нормальных условиях, называется числом Лошмидта: NL = p0/(kT0) = 2,68·1025 м-3
Изопроцессами называют такие равновесные процессы, при которых один из параметров состояния остается постоянным. Напомним три основных изопроцесса:
1) изотермический, Т = const., p1V1 = p2V2 (или pV = const.) – для заданной массы газа при изотермическом процессе произведение давления на объем постоянно (закон Бойля и Мариотта);
2) изобарический, р = const., (или ) – для заданной массы газа при изобарическом процессе объем пропорционален температуре (закон Гей-Люссака);
3) изохорический, V = const., (или ) – для заданной массы газа при изохорическом процессе давление пропорционально температуре (закон Шарля).
Поставим вопрос – как молекулярная физика объясняет уравнение Клапейрона-Менделеева и газовые законы? Какие понятия вводятся для ответа на этот вопрос?
Введем модельную систему под названием идеальный газ. Идеальным газом назовем физическую систему, составленную из невзаимодействующих материальных точек, находящихся в хаотическом движении. Эта модель позволит нам понять физическую природу давления газа на стенки сосуда как результат передачи импульса хаотического движения молекул (вместо молекул рассматриваются материальные точки) при ударах о стенки сосуда. При рассмотрении других свойств газов модель идеального газа будет усложняться.
n=N/V
m0=m/N=M/Na=ро/n
N= nu Na=m/m0
сктчскрсть=корень (3RT/M)= sqrt (3kT/m0)
p=1/3 m0 n v2 = 2/3 n Eкинет
Екинет=3/2 kT
пэнавэ=нюэртэ
пэ=энкаТэ
сигма= Эфпов натяж/л= Е пов натяж/S
h подъ в капилл =2сигма/рожеЭр
А=пэдельтавэ
U=3/2 nu R
U= 3/2 p (v2-v1)
U= 3/2 v (p2-p1)
Для вывода основного уравнения молекулярно-кинетической теории будем рассматривать одноатомный идеальный газ. Будем считать, что молекулы газа движутся хаотически, и число столкновений молекул газа между собой пренебрежимо мало по сравнению с числом ударов о стенки сосуда, и молекулы со стенками сосуда сталкиваются абсолютно упруго. Возьмем на стенке сосуда некоторую элементарную площадку ΔS (рис. 64) и рассчитаем оказываемое на эту площадку давление. При каждом соударении молекула, которая движется перпендикулярно площадке, передает ей импульс m0v – (– m0v) = 2m0v, где m0 — масса молекулы, v — ее скорость. За время Δt с площадкой ΔS столкнутся только те молекулы, которые находятся в объеме цилиндра с основанием ΔS и высотой vΔt (рис. 1). Число этих молекул nΔSvΔt (n — концентрация молекул).
Необходимо, учитывать, что молекулы движутся к площадке ΔS с различными скоростям и под разными углами, причем скорости молекул при каждом соударении меняются. Усредняя, хаотическое движение молекул заменяют движением вдоль трех взаимно перпендикулярных направлений, таким образом что в произвольный момент времени вдоль каждого из них движется 1/3 молекул, причем половина молекул из этих полекул (т.е. 1/6 общего числа молекул) движется вдоль данного направления в одну сторону, половина — в противоположную. Следовательно число ударов молекул, которые движутся в заданном направлении, о площадку ΔS будет (1/6)nΔSvΔt. Во время столкновении с площадкой эти молекулы передадут ей импульс
![]() Тогда
давление газа, оказываемое им на стенку
сосуда,
Тогда
давление газа, оказываемое им на стенку
сосуда,
![]() (1)
Если
газ в объеме V содержит N молекул,
движущихся со скоростями v1,
v2,
..., vN,
то целесообразно рассматривать среднюю
квадратичную скорость
(1)
Если
газ в объеме V содержит N молекул,
движущихся со скоростями v1,
v2,
..., vN,
то целесообразно рассматривать среднюю
квадратичную скорость
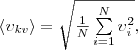 (2)
которая
характеризует всю совокупность молекул
газа. Уравнение (1) с учетом (2) примет
вид
(2)
которая
характеризует всю совокупность молекул
газа. Уравнение (1) с учетом (2) примет
вид![]() (3)
Выражение
(3) называетсяосновным
уравнением молекулярно-кинетической
теории идеальных газов.
Точный расчет с учетом движения молекул
по всевозможным направлениям дает ту
же формулу.
Учитывая, что n = N / V,
получим
(3)
Выражение
(3) называетсяосновным
уравнением молекулярно-кинетической
теории идеальных газов.
Точный расчет с учетом движения молекул
по всевозможным направлениям дает ту
же формулу.
Учитывая, что n = N / V,
получим
![]() (4)
или
(4)
или![]() (5)
(5)
