
- •2. 1.5. Квантовые числа и атомные орбитали
- •[Править]Концепция гибридизации
- •[Править]Виды гибридизации [править]sp-гибридизация
- •[Править]sp2-гибридизация
- •[Править]sp3-гибридизация
- •[Править]Гибридизация и геометрия молекул
- •13. 1. Характеристика вещества в - газообразном состоянии в условиях вакуума
- •14.Агрегатное состояние вещества – твёрдое тело
- •15. Агрегатное состояние вещества – жидкость
- •[Править]Способы выражения константы равновесия
- •[Править]Стандартная константа равновесия
- •[Править]Константа равновесия реакций в гетерогенных системах
- •[Править]Константа равновесия и изменение энергии Гиббса
- •21. Принцип Ле Шателье — Брауна
- •[Править]Влияние температуры
- •[Править]Влияние давления
- •[Править]Влияние инертных газов
- •[Править]Влияние концентрации
- •[Править]Примечания
- •23. 6.1. Скорость химических реакций
- •6.1.1 Зависимость скорости реакции от концентрации веществ
- •6.1.2. Особенности кинетики гетерогенных реакций
- •6.1.3. Зависимость скорости реакции от температуры
- •6.1.4. Уравнение Аррениуса
- •6.1.5. Энергия активации
- •6.1.6. Предэкспоненциальный множитель
- •6.1.7. Зависимость скорости реакции от катализатора
- •6.1.8. Гомогенный катализ
- •6.1.9. Гетерогенный катализ
- •25. Способы выражения концентрации растворов
- •Пересчет концентраций растворов из одних единиц в другие
- •Упаривание раствора
- •Концентрирование раствора
- •Смешивание растворов с разными концентрациями
- •Разбавление раствора
- •26. Физико-химические свойства разбавленных растворов неэлектролитов, приближающихся по свойствам k идеальным
- •[Править]Первый закон Рауля
- •[Править]Отклонения от закона Рауля
- •[Править]Второй закон Рауля
- •[Править]Понижение температуры кристаллизации растворов
- •[Править]Повышение температуры кипения растворов
- •[Править]Криоскопическая и эбулиоскопическая константы
- •[Править]Растворы электролитов
- •28. Понижение температуры кристаллизации растворов
- •[Править]Повышение температуры кипения растворов
- •[Править]Криоскопическая и эбулиоскопическая константы
- •[Править]Растворы электролитов
- •Равновесный электродный потенциал.
- •Трехэлектродная цепь
- •1) Гомогенный механизм электрохимической коррозии:
- •2) Гетерогенный механизм электрохимической коррозии:
Смешивание растворов с разными концентрациями
Смешали m1 граммов раствора №1 c массовой долей вещества w1 и m2 граммов раствора №2 c массовой долей вещества w2 . Образовался раствор (№3) с массовой долей растворенного вещества w3 . Как относятся друг к другу массы исходных растворов?
Решение Пусть w1 > w2 , тогда w1 > w3 > w2 . Масса растворенного вещества в растворе №1 составляет w1 · m1, в растворе №2 – w2 · m2. Масса образовавшегося раствора (№3) – (m1 – m2). Сумма масс растворенного вещества в растворах №1 и №2 равна массе этого вещества в образовавшемся растворе (№3):
w 1 · m1 + w 2 · m2 = w3· (m1 + m2) w1 · m1 + w 2 · m2 = w3 · m1 + w3 · m2 w 1 · m1 – w3 · m1 = w3 · m2 – w2 · m2 (w1– w3) · m1 = (w3– w2) · m2 m1 / m2 = (w3– w2 ) / (w1– w3)
Таким образом, массы смешиваемых растворов m1 и m2 обратно пропорциональны разностям массовых долей w1 и w2 смешиваемых растворов и массовой доли смеси w3. (Правило смешивания).
Для облегчения использования правила смешивания применяют правило креста :
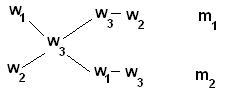
m1 / m2 = (w3 – w2) / (w1 – w3)
Для этого по диагонали из большего значения концентрации вычитают меньшую, получают (w1 – w3), w1 > w3 и (w3 – w2), w3 > w2. Затем составляют отношение масс исходных растворов m1 / m2 и вычисляют.
Пример Определите массы исходных растворов с массовыми долями гидроксида натрия 5% и 40%, если при их смешивании образовался раствор массой 210 г с массовой долей гидроксида натрия 10%.

5 / 30 = m1 / (210 - m1) 1/6 = m1 / (210 – m1) 210 – m1 = 6m1 7m1 = 210 m1 =30 г; m2 = 210 – m1 = 210 – 30 = 180 г
Разбавление раствора
Исходя из определения массовой доли, получим выражения для значений массовых долей растворенного вещества в исходном растворе №1 (w1) и полученном растворе №2 (w2):
w1 = m1 / (ρ1 · V1) откуда V1= m1 /( w1 ·ρ1) w2 = m2 / (ρ2 · V2) m2 = w2 ·ρ2 · V2
Раствор №2 получают, разбавляя раствор №1, поэтому m1 = m2. В формулу для V1 следует подставить выражение для m2. Тогда
V1= (w2 ·ρ2 · V2) / (w1 · r1) m2 = w2 ·ρ2 · V2 или
|
w1 · ρ1 · V1 |
= |
w2 · ρ2 · V2 |
|
m1(раствор) |
|
m2(раствор) |
m1(раствор) / m2(раствор) = w2 / w1
При одном и том же количестве растворенного вещества массы растворов и их массовые доли обратно пропорциональны друг другу.
Пример Определите массу 3%-ного раствора пероксида водорода, который можно получить разбавлением водой 50 г его 3%-ного раствора.
m1(раствор) / m2(раствор) = w2/ w1 50 / x = 3 / 30 3x = 50 · 30 = 1500 x = 500 г
26. Физико-химические свойства разбавленных растворов неэлектролитов, приближающихся по свойствам k идеальным
Рубрики: Физическая химия
1.1. Закон осмотического давления Вант — Гоффа (1887 г.)
Осмос – это односторонняя самопроизвольная диффузия молекул растворителя через полупроницаемую мембрану из раствора с низкой концентрацией в раствор с высокой концентрацией.
Осмотическим давлением (π) называется гидростатическое давление, которое надо приложить к раствору, чтобы задержать осмос.
Осмотическое давление не зависит от природы растворителя и растворенного вещества. При постоянной температуре оно определяется числом « кинетических элементов» — молекул, ионов, ассоциатов, коллоидных мицелл в единице объема, то есть является коллигативным свойством.
Осмотическое давление разбавленного раствора равно тому газовому давлению, которое производило бы растворенное вещество, если бы оно в виде газа при той же температуре занимало тот же объем, что и раствор:
π V = nRT (1.1) или
π = с RT (1а), где с = n/V – молярная концентрация растворенного вещества.
Первый закон Рауля (1887 г.)
Давление насыщенного пара над раствором равно его давлению над чистым растворителем, умноженному на молярную долю растворителя:
Р = ро χо (1.2),
Где ро – давление паров над чистым растворителем, р – давление паров над раствором, χо – молярная доля растворителя.
Несложные преобразования уравнения (1.2) позволяют получить другую зависимость:
χ = ро – р / ро (1.3),
Где χ = n/n + no – молярная доля растворенного вещества.
При постоянной температуре относительное понижение давления насыщенного пара над раствором нелетучего вещества равно молярной доле этого вещества в растворе.
Для разбавленных растворов (n<<no) выражение (1.3) упрощается:
(ро – р) / ро = n/nо или Δp = po×n/no (1.4).
Δp зависит только от числа частиц в растворе, следовательно, является коллигативным свойством. Так как n = m/M, появляется возможность рассчитать молярную массу растворенного вещества по величине экспериментально найденного понижения давления паров над раствором:
М = Мо×m/mo×po/(po – p) (1.5)
/В формулах (2) – (5) индекс «о» относится к чистому растворителю, а параметр без индекса относится к растворенному веществу/
1.3. Второй закон Рауля (1887 г.):
Понижение температуры замерзания или повышение температуры кипения раствора неэлектролита прямо пропорциональны его моляльной концентрации:
ΔТ = К сm (1.6),
Где сm = m×1000/ M×mо– моляльная концентрация растворенного вещества. Из уравнения (1.6) следует, что растворы с одинаковой моляльной концентрацией вызывают одинаковое изменение температуры замерзания или кипения в одном и том же растворителе, то есть обладают коллигативными свойствами.
При замерзании растворов К – криоскопическая константа растворителя, которая может быть рассчитана по формуле:
Ккр. = RT2/1000 Δh (1.7),
Где Δh – удельная теплота плавления, Дж/г (Для воды в форме льда Δh = 333,3 Дж/г).
При кипении растворов К – Эбулиоскопическая константа растворителя, которая может быть рассчитана по формуле:
Кэб. = RT2/1000 Δl (1.8),
Где Δl – удельная теплота испарения, Дж/г.
/Криоскопическая и эбулиоскопическая константы различных растворителей даны в приложении табл.4.2/
Методы косвенного определения осмотического давления
1) По связи закона Вант — Гоффа со вторым законом Рауля
В разбавленных растворах без существенной погрешности можно принять, что с = сm, тогда сопоставление уравнений (1а) и (6) дает выражение:
π = ΔТ/Ккр.×RT (1.9).
Если в качестве растворителя взята вода, то
π = ΔТ×8,314×273,15/1,86 = 1,22ΔТ (МПа)
2) По связи закона Вант — Гоффа с первым законом Рауля
Сопоставление уравнений (1а) и (2) с учетом изменения химических потенциалов при испарении /Вывод опускается/ ведет к выражению:
V¯× π = RT ln po/p (1.10),
Где V¯= М/ρ — парциальный молярный объем растворителя.
По количественной аналогии между осмотическим и газовым давлением
Если в 22,4 л раствора содержится 1 моль неэлектролита, то осмотическое давление такого раствора при ОоС должно быть равно 101,325 кПа.
Отклонения от законов Вант — Гоффа и Рауля
Рассчитанное по закону Вант — Гоффа осмотическое давление может не совпадать с полученным опытным путем в случаях, когда реальное число химических частиц в растворе будет больше или меньше расчетного. Это может произойти в том случае, если в растворе будут происходить процессы ассоциации или диссоциации молекул растворенного вещества. Оценить глубину отклонения можно с помощью изотонического коэффициента Вант — Гоффа: i = πоп./πтеор. При значениях коэффициента больше единицы в растворе идет процесс диссоциации, при значениях коэффициента меньше единицы, наоборот, происходит ассоциация.
Осмос (от греч. ōsmós — толчок, давление), диффузия вещества, обычно растворителя, через полупроницаемую мембрану, разделяющую раствор и чистый растворитель или два раствора различной концентрации. Полупроницаемая мембрана — перегородка, пропускающая малые молекулы растворителя, но непроницаемая для более крупных молекул растворённого вещества. Выравнивание концентраций по обе стороны такой мембраны возможно лишь при односторонней диффузии растворителя. Поэтому всегда идёт от чистого растворителя к раствору или от разбавленного раствора к концентрированному. О., направленный внутрь ограниченного объёма жидкости, называется эндосмосом, наружу — экзосмосом. Перенос растворителя через мембрану обусловлен осмотическим давлением. Оно равно избыточному внешнему давлению, которое следует приложить со стороны раствора, чтобы прекратить О., т. е. создать условия осмотического равновесия. Превышение избыточного давления над осмотическим может привести к обращению О. — обратной диффузии растворителя (см. Ультрафильтрация). В случаях, когда мембрана проницаема не только для растворителя, но и для некоторых растворённых веществ, диффузия последних из раствора в растворитель позволяет осуществить диализ, применяемый как способ очистки полимеров и коллоидных систем от низкомолекулярных примесей, например электролитов. Впервые О. наблюдал А. Нолле в 1748, однако исследование этого явления было начато спустя столетие. О. имеет важнейшее значение в биологических процессах (см. Осморегуляция), его широко используют в лабораторной технике: при определении молярных характеристик полимеров, концентрировании растворов, исследовании разнообразных биологических структур. Осмотические явления иногда используются в промышленности, например при получении некоторых полимерных материалов, очистке высоко-минерализованной воды методом "обратного" О. жидкостей.
27. Зако́ны Ра́уля — общее название открытых французским химиком Ф. М. Раулем в 1887 г. количественных закономерностей, описывающих некоторые коллигативные (зависящие от концентрации, но не от природы растворённого вещества) свойства растворов.
|
Содержание [убрать]
|
