
- •Глава 9. Физико-химические
- •9.1. Анализ состава газовой фазы в зоне столба дуги
- •9.1.2. Образование соединений между компонентами газовой смеси
- •9.1.3. Насыщение расплавленного металла газами в капле и сварной ванне
- •9.2. Влияние атмосферных газов на свойства стали и сплавов при сварке
- •9.2.1. Влияние кислорода на свойства стали
- •9.2.3. Влияние водорода на свойства стали
- •9.2.4 Влияние со2, со и паров н2о на свойства стали
- •9.2.5. Влияние атмосферных газов на свойства цветных металлов
- •9.3. Взаимодействие металла с защитными флюсами при сварке
- •9.3.1. Строение и свойства сварочных флюсов
- •9.3.2. Характеристика важнейших простых оксидов, входящих в состав шлаковой фазы
- •9.3.3. Основные системы сварочных шлаков
- •9.4. Массообмен между расплавленным металлом, газовой средой и шлаком
- •9.5. Расплавление электрода и перенос капель в ванну
- •9.6. Источники водорода при сварке под флюсом
- •9.7. Окисление металла шва флюсом
- •9.8. Переход вредных примесей из флюса в металл шва
- •9.9. Раскисление металла при сварке
- •9.9.1. Виды раскисли тельных процессов
- •9.9.2. Легирование наплавленного металла
- •9.10. Рафинирование сварочной ванны и модифицирование металла шва
- •9.10.1. Влияние серы на структуру и свойства шва
- •9.10.2. Десульфурация сварочной ванны
- •9.10.3. Снижение содержания фосфора в металле шва
- •9.11. Дефекты металлургического происхождения в сварных швах
- •9.11.2. Шлаковые включения в металле шва
- •9.11.3. Ликвационная неоднородность в металле шва
9.2.4 Влияние со2, со и паров н2о на свойства стали
Оксиды углерода
СО2
и СО в тех или иных количествах всегда
есть в газовой среде. Степень диссоциации
и окислительная способность СО2
при температурах дугового разряда
весьма значительны (см. рис. 9.1). В
отличие от СO2
окись углерода СО не диссоциирует в
дуговом разряде. Кроме того, СО не
растворяется в жидком металле и поэтому
непосредственной опасности для него
Не представляет. В то же время СО может
создавать защитную атмосферу у поверхности
жидкого металла, связывая кислород по
реакции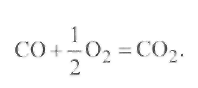
Окись углерода может непосредственно образовываться и при сварке угольным электродом, создавая достаточную газовую защиту. Иную роль играет окись углерода, образующаяся в самом металле при взаимодействии углерода с кислородом или углерода с оксидами металлов. В этом отношении наиболее характерна реакция между углеродом и закисью железа:
![]() (9.23)
(9.23)
Наблюдающееся кипение металла (выделение пузырей образующейся окиси углерода) способствует удалению посторонних включений. Однако если в металле шва в момент его кристаллизации нет нужных раскислителей (например, Si, Mn), способных подавить реакцию дальнейшего образования окиси углерода, то кипение металла сварочной ванны может продолжаться до окончания кристаллизации и привести к нежелательному снижению содержания углерода, а также к образованию пор в металле шва.
Пары воды диссоциируют в зоне столба дуги полностью на водород и кислород. Их влияние на свойства стали при сварке описано в разд. 9.2.3 и 9.2.1.
Итак, состав газовой среды в зоне столба дуги и степень активности ее компонентов при сварке плавлением позволяет сделать общий вывод о необходимости защиты жидкой фазы сварочной ванны (стали) от контакта с воздухом и тщательной металлургической обработки ее для получения качественного сварного соединения.
9.2.5. Влияние атмосферных газов на свойства цветных металлов
Медь при взаимодействии с кислородом дает стабильный оксид Сu2 О, растворимый в жидкой меди:
![]() (9.24)
(9.24)
В расплаве оксид меди Сu2О весьма устойчив, но при кристаллизации вследствие ликвации образуется эвтектика Сu - Сu2О и фаза Сu2О теряет свою устойчивость, вызывая под воздействием О2 и Н2 так называемую «водородную болезнь» меди, которая приводит к разрушению металла и является результатом последовательного взаимодействия меди с кислородом по реакции (9.24), а затем с водородом по следующей реакции:
![]() (9.25)
(9.25)
И ными
словами, водород, растворенный в
окисленном металле, взаимодействует с
оксидом Сu2О,
находящимся в эвтектике и восстанавливает
его до Сu,
но образующиеся при этом пары воды не
диффундируют через металл и разрушают
его по границам зерен.
ными
словами, водород, растворенный в
окисленном металле, взаимодействует с
оксидом Сu2О,
находящимся в эвтектике и восстанавливает
его до Сu,
но образующиеся при этом пары воды не
диффундируют через металл и разрушают
его по границам зерен.
Равновесная диаграмма плавкости Сu-О приведена на рис. 9.14. Как следует из диаграммы, в области температур ниже 1065 °С (1338 К) существует раствор Сu + Сu2О, но растворимость Сu2О в твердой фазе ничтожно мала. Таким образом, при сварке меди и ее сплавов необходимо принимать все меры для снижения степени ее окисления или вводить раскислители.
Аналогичная ситуация имеет место при сварке деталей из никеля и его сплавов. Никель с О2 образует два соединения: Ni2Оз и NiO. Первый из них неустойчив, является сильным окислителем (он применяется в щелочных аккумуляторах). Второй - NiO - устойчивый оксид. Он хорошо растворим в жидком никеле, но не растворим в твердом никеле. Диаграмма плавкости, приведенная на рис. 9.15, показывает, что содержащиеся в металле оксиды никеля при нагревании выше 1700 К легко диссоциируют, выделяя кислород, который образует поры с водородом, находящимся в жидком металле, при его кристаллизации. Никель, в отличие от железа, не взаимодействует с азотом, который может служить для него так же, как и для Сu, защитной средой.
Титан является особо активным химическим элементом по отношению к кислороду, с которым он образует ряд устойчивых оксидов, обладающих различной степенью окисления. Кроме того, кислород растворяется в твердом металле. Оксиды, особенно имеющие низкую степень окисления: TiO, Ti2O3, ТiO2, обладают большим температурным интервалом гомогенности, т. е. существуют в однофазном твердом растворе при охлаждении до нормальной температуры (рис. 9.16).

При температурах этого интервала наиболее устойчив оксид TiO. Для оксидов титана характерна ступенчатая диссоциация, которая идет по двум вариантам:
 (9.26)
(9.26)
Из оксидов титана наименьшую температуру диссоциации имеет TiО2 (∆G = 0 при 3500 К), диссоциация которого происходит согласно уравнению
![]() (9.27)
(9.27)
Титан также активно взаимодействует с азотом и водородом (см. рис. 9.7), образуя нитриды и гидриды, поэтому требуется особо тщательная защита его сплавов от атмосферы при сварке.
Алюминий соединяется с кислородом в устойчивый амфотерный оксид А12O3 (корунд), образующий соли как в кислой, так и в щелочной среде. Оксид А12O3 не растворим в алюминии и образует плотную оксидную пленку, имеющую весьма высокие температуру плавления (T > 2500 К) и плотность (выше, чем у металла). При сварке с окислением в шве образуются включения AI2O3, т. е. шлаки, которые приводят к охрупчиванию металла шва. Кроме того, поверхностные пленки из А12O3 склонны к адсорбции Н2O, т. е. к гидратации во влажной среде. Гидратная вода, входящая в А12O3 •
п Н2O, при сварке диссоциирует и это приводит к повышению парциального давления водорода в столбе дуги. При охлаждении до температуры кристаллизации растворимость водорода резко снижается практически до нулевых значений (см. рис. 9.6, а) и при кристаллизации часть выделяющегося газа создает поры в шве. Второй продукт диссоциации - кислород - окисляет основу сплава или его главный легирующий компонент (Mg, Li) и тем самым увеличивает долю шлака в шве в виде легкоплавкой эвтектики.
Таким образом, попадание атмосферных газов в большей или меньшей степени в зону столба дуги вследствие несовершенства газовой защиты или в виде примесей в защитных газах оказывает вредное воздействие на конструкционные металлы и сплавы в шве и в зоне термического влияния, так как приводит к образованию в них горячих либо холодных трещин и пор, а также к снижению прочности и пластичности сварных соединений.
