
- •Глава 9. Физико-химические
- •9.1. Анализ состава газовой фазы в зоне столба дуги
- •9.1.2. Образование соединений между компонентами газовой смеси
- •9.1.3. Насыщение расплавленного металла газами в капле и сварной ванне
- •9.2. Влияние атмосферных газов на свойства стали и сплавов при сварке
- •9.2.1. Влияние кислорода на свойства стали
- •9.2.3. Влияние водорода на свойства стали
- •9.2.4 Влияние со2, со и паров н2о на свойства стали
- •9.2.5. Влияние атмосферных газов на свойства цветных металлов
- •9.3. Взаимодействие металла с защитными флюсами при сварке
- •9.3.1. Строение и свойства сварочных флюсов
- •9.3.2. Характеристика важнейших простых оксидов, входящих в состав шлаковой фазы
- •9.3.3. Основные системы сварочных шлаков
- •9.4. Массообмен между расплавленным металлом, газовой средой и шлаком
- •9.5. Расплавление электрода и перенос капель в ванну
- •9.6. Источники водорода при сварке под флюсом
- •9.7. Окисление металла шва флюсом
- •9.8. Переход вредных примесей из флюса в металл шва
- •9.9. Раскисление металла при сварке
- •9.9.1. Виды раскисли тельных процессов
- •9.9.2. Легирование наплавленного металла
- •9.10. Рафинирование сварочной ванны и модифицирование металла шва
- •9.10.1. Влияние серы на структуру и свойства шва
- •9.10.2. Десульфурация сварочной ванны
- •9.10.3. Снижение содержания фосфора в металле шва
- •9.11. Дефекты металлургического происхождения в сварных швах
- •9.11.2. Шлаковые включения в металле шва
- •9.11.3. Ликвационная неоднородность в металле шва
9.2. Влияние атмосферных газов на свойства стали и сплавов при сварке
9.2.1. Влияние кислорода на свойства стали
Кислород растворяется во многих металлах, в том числе и в железе. Изучение особенностей растворения кислорода в железе позволяет сделать выводы относительно взаимодействия кислорода со сталью, основой которой является железо. Железо с кислородом образует три оксида в результате следующих реакций:

Из этих трех оксидов только закись железа FeO растворима в железе и поэтому наиболее сильно влияет на его свойства в составе свариваемого металла. Остальные оксиды в железе не растворяются, могут в нем присутствовать только в виде отдельных включений и легко разлагаются при высоких температурах.
Установлено, что при температуре плавления железа предельная растворимость кислорода в железе составляет сотые доли процента (0,16 %), а при комнатной температуре - тысячные доли процента. Твердый раствор О2 в Fe называют оксиферритом.
На рис. 9.8 приведена левая часть диаграммы состояния «железо - кислород». При температуре 845 К закись FeO, находящаяся в железе вне твердого раствора, разлагается с образованием закиси-окиси:
![]() (9.16)
(9.16)
Таким образом, при комнатной температуре кислород находится в железе как в твердом растворе Fe α (в оксиферрите), так и в виде включений Fe3 О4

При сварке наблюдаются существенные отклонения от равновесной диаграммы состояния «железо - кислород». Значительный перегрев жидкого металла увеличивает растворимость кислорода более чем до 0,16 % (ветвь В-В'). В этом случае максимальная растворимость в железе определяется по уравнению
![]() (9.17)
(9.17)
При быстром охлаждении железа может наблюдаться образование пересыщенного твердого раствора Fe α, а вне твердого раствора останется не успевшая разложиться закись железа FeO. Она войдет в состав легкоплавких ликватов, располагающихся по зонам срастания кристаллов.
Наличие легирующих элементов в стали также влияет на растворимость кислорода. Наиболее сильно снижают растворимость кислорода в железе элементы углерод и кремний, которые являются самыми активными раскислителями, связывающими О2 в оксиды СО и SiО2. Ввод таких элементов в металл шва относится к физико-химическим способам его защиты.
Присутствие кислорода в сталях наряду с окислением железа вызывает непосредственное окисление ряда легирующих элементов, например:
 (9.18)
(9.18)
Очередность окисления элементов обратно пропорциональна их химическому потенциалу (вариант такого расчета приведен в гл. 8, см. пример 8.4).
Кроме того, параллельно могут идти нежелательные обменные реакции взаимодействия легирующих элементов с закисью железа, когда окислителем выступает не свободный кислород, а связанный в оксид FeO:
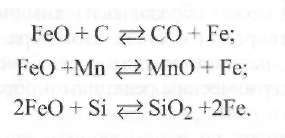 (9.19)
(9.19)
Эти реакции прогнозируют по энергии Гиббса. Возможность окисления легирующих элементов устанавливают в результате термодинамических расчетов, которые приведены в гл. 8.
Т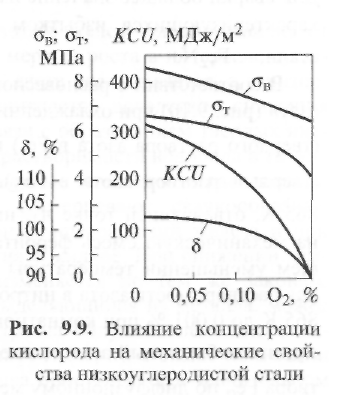 аким
образом, кислород в стали присутствует
главным образом в виде оксидовFeO,
MnO,
СаО и др., в том числе в виде комплексов
с SiО2,
ТiО2
и другими кислыми оксидами. Как правило,
оксиды FeO
располагаются по границам зерен металла
в виде стекловидных игл и поэтому
играют роль микронадрезов, а комплексы
- в виде легкоплавких ликватов, образующих
при высоких температурах жидкие
прослойки, которые после затвердевания
становятся хрупкими.
аким
образом, кислород в стали присутствует
главным образом в виде оксидовFeO,
MnO,
СаО и др., в том числе в виде комплексов
с SiО2,
ТiО2
и другими кислыми оксидами. Как правило,
оксиды FeO
располагаются по границам зерен металла
в виде стекловидных игл и поэтому
играют роль микронадрезов, а комплексы
- в виде легкоплавких ликватов, образующих
при высоких температурах жидкие
прослойки, которые после затвердевания
становятся хрупкими.
Наличие кислорода
в стали ухудшает все свойства свариваемого
металла (рис. 9.9). С Увеличением содержания
кислорода
резко уменьшаются пределы прочности
σВ
и текучести σт,
относительное удлинение δ и ударная
вязкость KCU,
причем
особенно значительно снижается
ударная вязкость.
Наряду с этим при увеличении содержания кислорода в стали происходит следующее: уменьшается стойкость против коррозии; обнаруживается склонность к старению; при содержании кислорода более 0,08 % появляется склонность к хладно- и красноломкости; усиливается рост зерен при нагреве; ухудшается способность к обработке резанием и ковке; понижается магнитная проницаемость и увеличивается электрическое сопротивление.
9.2.2. Влияние азота на свойства стали
Атомарный азот растворяется преимущественно в тех металлах, с которыми он может образовывать химические соединения -нитриды. При растворении в стали азот образует нитриды как с железом, так и с большинством примесей. С железом азот взаимодействует по эндотермическим реакциям и образует два типа нитридов:

Нитрид Fe4 N содержит 5,88 % N2, а нитрид Fe2N - 11,1 % N2.
Для сварки большее значение имеет нитрид Fe4N, а для процессов, характеризующихся избытком азота, например для азотизации стали,- Fe2N.
В соответствии с равновесной диаграммой состояния «железо -азот» (рис. 9.10) при охлаждении сплава вначале из нитроаустенита
(твердого раствора азота в Feγ) выпадает α -фаза, или нитроферрит (твердый раствор азота в Feα). После достижения температуры 865 К, отвечающей точке А1, нитроферрит-эвтектоид распадается на механическую смесь феррита и нитрида железа. При дальнейшем уменьшении температуры в равновесных условиях предельная растворимость азота в нитроферрите снижается от 0,135 % при 865 К до 0,001 % при комнатной температуре. Это приводит к тому, что избыточный азот в виде Fe4N выделяется из твердого раствора Feα по диффузионному механизму.
В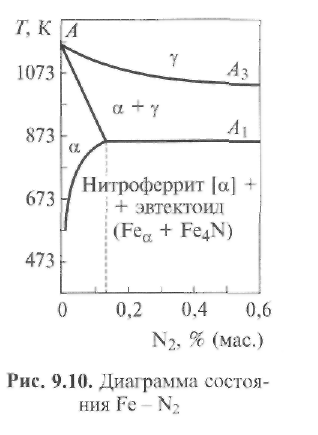 неравновесных условиях сварки этот
процесс практически не развивается,
и получают сталь, пересыщенную азотом.
При последующем нагреве или при
вылеживании происходит медленное
выделение нитридов железа. Это явление
называют старением. Оно снижает
пластичность стали. При нагревании
выше 900 К сталей, содержащих нитриды
железа, они диссоциируют.
неравновесных условиях сварки этот
процесс практически не развивается,
и получают сталь, пересыщенную азотом.
При последующем нагреве или при
вылеживании происходит медленное
выделение нитридов железа. Это явление
называют старением. Оно снижает
пластичность стали. При нагревании
выше 900 К сталей, содержащих нитриды
железа, они диссоциируют.
Таким образом, в железе азот может находиться в твердом растворе Feα и в виде отдельных включений нитридов - главным образом Fe4N. В результате сварки и здесь имеют место существенные отклонения от равновесной диаграммы состояния Fe - N2. Поэтому общее количество растворенного в металле азота вследствие перегрева металла может быть увеличенным. Кроме того, при повышенной скорости охлаждения металла может не закончиться процесс выпадения нитридов железа из твердого раствора Feα, который останется пересыщенным азотом.
С легирующими элементами стали азот также образует нитриды, часто значительно более стойкие, чем нитриды железа. Особенно стойкими в области высоких температур являются нитриды кремния и титана.
Равновесная растворимость азота в железе сильно зависит от температуры (см. рис. 9.6, б). По мере ее роста в интервале существования феррита растворимость азота увеличивается, а в интервале существования аустенита снижается вследствие снижения парциального давления азота в связи с образованием твердых нитридов по аналогии со снижением растворимости водорода в титане (см. рис. 9.7). В этом интервале кривые зависимости равновесной растворимости от температуры претерпевают скачкообразные изменения в моменты полиморфных превращений железа и при переходе его из твердого состояния в жидкое. При снижении температуры растворимость азота изменяется по тем же законам. В период кристаллизации азот, выделяющийся из металла, может вызвать порообразование. Несмотря на малую степень диссоциации азота в зоне столба дуги (см. рис. 8.9, а), а также ионизации (см. рис. 8.9, б), азот в металле шва присутствует в значительном количестве, что объясняется большим содержанием его в атмосфере и спецификой его поведения в зоне сварки.
Исследования процесса насыщения металла азотом показали, что возможны следующие пути его протекания.
1. Диссоциированный азот непосредственно растворяется в жидком металле капель. При последующем охлаждении металла образуются нитриды железа. Роль этого процесса мала, так как степень диссоциации при сварке незначительна.
2. Диссоциированный азот образует в высокотемпературной области дугового разряда (см. рис. 9.1) окись азота NО, которая растворяется в каплях. При температурах металла ниже 3300 К окись азота диссоциирует на поверхности сварочной ванны, при этом атомарный азот, вступая во взаимодействие с железом, обра- зует нитриды железа, а кислород - оксиды железа. Термодинами- ческим расчетом и экспериментом (см. рис. 9.5) подтверждено, что последний вариант (с участием кислорода) наиболее вероятен.
3. Диссоциированный азот непосредственно образует с диссо- циированным кислородом в области высоких температур стойкие нитриды, которые, растворяясь согласно закону Сивертса в жидком металле капли, насыщают его азотом. В этом случае по мере охла ждения металла сварочной ванны из раствора может выделиться атомарный азот, который, вступая во взаимодействие с железом, образует нитриды железа.
Содержащиеся в
стали нитриды азота весьма сильно влияют
на ее свойства. Из рис. 9.11 следует, что
с увеличением содержания  азота
N в металле повышаются пределы
прочности (σВ)
и текучести (σТ).
Этим влияние азота на свойства стали
принципиально отличается от влияния
кислорода. Вместе с тем по аналогии с
кислородом снижаются пластические
свойства и особенно резко — ударная
вязкость стали. Наряду с этим происходят
и другие нежелательные изменения:
появляется склонность металла к старению
и к хладноломкости (синеломкости);
увеличивается склонность к закалке;
понижается магнитная проницаемость;
увеличивается электрическое
сопротивление металла.
азота
N в металле повышаются пределы
прочности (σВ)
и текучести (σТ).
Этим влияние азота на свойства стали
принципиально отличается от влияния
кислорода. Вместе с тем по аналогии с
кислородом снижаются пластические
свойства и особенно резко — ударная
вязкость стали. Наряду с этим происходят
и другие нежелательные изменения:
появляется склонность металла к старению
и к хладноломкости (синеломкости);
увеличивается склонность к закалке;
понижается магнитная проницаемость;
увеличивается электрическое
сопротивление металла.
Итак, для углеродистых и низколегированных сталей азот -нежелательная примесь в металле шва, особенно при действии на него динамической нагрузки. При сварке легированных сталей осуществляют микролегирование азотом с целью частичной замены углерода и увеличения пластичности и прочности сталей. Азот, как и углерод, образует твердый раствор внедрения, т. е. является сильным упрочнителем, но в отличие от углерода не образует карбидов, которые при нагреве растворяются в стали. Нитриды железа более термостойки, чем Fe3C.
При сварке деталей из высоколегированных сталей аустенитного класса азот вводится специально, так как он повышает устойчивость аустенита и выступает как легирующая добавка, способная заменить некоторое количество углерода и никеля. В таких сталях азот устраняет явление транскристаллизации и улучшает механические свойства, а также может вызвать и эффект упрочнения чугуна.
В условиях сварки деталей из меди азот применяют в качестве инертного защитного газа, не взаимодействующего с медью.
