
- •1. Химия ғылымының пайда болуы, дамуы және маңызы
- •2. Иондық байланыс Мысалдар 169 бет
- •3. Алюминий гидроксиді (Al(oh)3) құрамындағы элементтердің массалық үлесін есепте
- •1 Заттардың және олардың физикалық қасиеттері
- •2 Ковалентті байланыс дегеніміз не? Мысалдар.
- •3 Темір (III) оксидінің Fe2o3 40 грамында қанша грам темір бар екендігін табыңдар
- •1 Атом молекулалық ілімнің қағидаларын мысалдар келтіре отырып осы ілімнің қалыптасуына қай елдің ғалымдарының үлесі болды?
- •2 Атомның құрамы және құрылысы 143, 145 бет
- •3 Алюминий оксидінің Al2o3 қандай массасында 15.5 г алюминий болады
- •1. Атомдар, молекулалар дегеніміз не? 44 бет
- •2. Тотығу тотықсыздану реакциялары мысалдар 144 бет
- •1. Химиялық элементтер, олардың таңбалары және атауы. Оны кім шығарды?
- •2. Экзотермиялық және эндотермиялық реакциялар дегеніміз не?
- •3. 1.5 Моль натрий сульфаты Na2so4 берілген. Осы тұздың массасын тап.
- •1. Жай және күделі заттар. Салыстырмалы атомдық масса. Салыстырмалы молекулалық масса анықтама және мысал келтір
- •2. Негіздер: құрамы, жіктелуі, химиялық қасиеттері, алынуы. 119 бет
- •1. Химиялық формула. Химиялық элементтердің валенттілігі дегеніміз не және валенттілік термині нені білдіреді? 35 бет.
- •2. Қышқылдар: құрамы, жіктелуі, химиялық қасиеттері, алынуы.Мысал келтір 87, 90, 122 бет
- •Қышқылдардың химиялық қасиеттері
- •3. Массасы 22г көмірқышқыл газының зат мөлшерін есепте.
- •1. Физикалық және химиялық құбылыстар дегеніміз не және айырмашылығы Химиялық реакциялар. Мысалдар
- •2. Оксидтер: алынуы, жіктелуі, химиялық қасиеттері. 114-116 бет.
- •Жай және күрделі заттарды жағу арқылы:
- •3. Құрамындағы элементтердің массалық үлесі мынадай: к39.69% Mn 27.87% o 32.46% тұздың қарапайым формуласын есепте.
- •1. Сутекке жалпы сипаттама. Алыну жолдарын реакция теңдеуі арқылы өрнекте.
- •2. Сілтілік металдар және галогендердің периодтық жүйеге орналасуы. Мысалдар.
- •3. 30Г тұзды 170г суда еріткенде түзілетін ерітіндідегі тұздың массалық үлесі қандай болады?
- •1. Химиялық реакциялардың теңдеулері, зат массасының сақталу заңы.
- •2. Натрий пжо (периодтық жүйедегі орны) және оның маңызды қосылыстары. Мысалдар
- •2. Оттектің аллотропиясы деген не? Озон және озон қабатының жердегі тіршілік үшін маңызы қандай?
- •3. CuSo4 5h2o-ның салыстырмалы молекулалық массасын есепте.
- •1. Химиялық элементтердің қасиеттерінің периодтық орны бойынша сипаттамасы Периодтық жүйедегі орнына қарай элементті және оның қосылыстарын сипаттау
- •Химиялық элементтердің электртерістілігі
- •2. Хлор пжо (периодтық жүйедегі орны) бойынша сипатта. Олардың маңызды қосылыстарының мысалдары
- •Химиялық қасиеттері
- •Cl2-нің алынуы және қолданылуы
- •1. Атомның құрамы және құрылысы дегеніміз не? Ол қандай бөлшектерден тұрады?
- •Мазмұны
- •Электрон
- •Атом құрылысы[өңдеу]
- •2. Тұздар: құрамы, жіктелуі, қасиеттері, алынуы 92 бет.
- •3. 20%-Тік 500г ерітінді даярлау үшін қанша грамм тұз қанша грамм су қажет?
- •1. Химиялық элементтердің жіктелуі мысалдар келтіріп заттардың формуласын жазыңдар.
- •2. Жай және күрделі заттардың жіктелуі. Генетикалық байланысты қалай қалпына келтіруге болады? Металдар және бейметалдар.
- •3. Массасы 12,6 г азот қышқылын бейтараптау үшін мыс(II) гидроксиді қанша массасы және мөлшері қажет екенін есептеңдер.
- •1. Химиялық элементтердің электр терістігі ұғымдарының айырмасы неде?
- •2. Ерігіштік дегеніміз не? Ерігіштік өлшемін қандай шам алар арқылы анықталады?
- •3. Массасы 620г натрий оксиді әрекеттескенде сілтінің қандай массасы және қанша мөлшері түзілетінін есептеңдер.
- •1. Заттың аморфты және кристалды жүйелері
- •2. Ерітінділер концентрациясы дегеніміз не және оны қандай тәсілдермен көрсетуге болады? Тұздардың алыну жолдары ...
- •3. Массасы 7,4 г кальций гидрооксиді қанша грамм фосфор қышқылымен әрекеттеседі.
- •1. Кристалл торларының түрлері және оның түйіндері дегеніміз не? Заттардың қасиеттерінің құрылысына тәуелділігі
- •2. Отттекті зертханада қалай алуға болатынын түсіндір.
- •3. Массасы 4,6 г натрийді 150 г суда еріту арқылы алынған ерітіндідегі натрий сілтісінің массалық үлесі
- •1. Ауа-газдар қоспасын қалай түсінесің? Атмосфералық ауаны ластанудан қалай қорғаймыз?
- •2. Зертханада хлордың алыну жолдарын реакциялар теңдеуі арқылы өрнекте.
- •3. Массасы 28 г. Литий суда ерігенде сутектің қанша көлемі түзіледі?
- •1. Оттегі химиялық элементінің аллотропиясы қалай аталады? Қандай зат екендігін түсіндір.
- •2. Тотықтырғыш және тотықсыздандырғыш туралы түсінік
- •3. Массасы 0,1 моль барий хлориді қанша моль күкірт қышқылымен әрекеттесе алады?
- •1. Табиғаттағы судың маңызы және физикалық/химиялық қасиеті және қолданылуы
- •2. Химиялық реакцияның жылу эффекті деген не? Өлшем бірлігі
- •3. 50 Г 16%-тік сілті ерітіндісін дайындау үшін қанша грамм сілті алу керек?
- •1. Табиғаттағы тірі организмдердегі және адам тіршілігіндегі химиялық реакциялардың биологиялық маңызы қандай? Мысал келтір.
- •2. Изотоп деген не? Сутектің изотоптары қалай аталады? Молекулалық фолрмуласын жаз және аттарын ата.
- •3. 78 Г калий сумен әрекеттескенде калий гидроксидінің қандай массасы және қанша мөлшері түзіледі?
- •1. Химиялық элементтердің тірі және өлі табиғатта таралуы. HCl физикалық-химиялық реакция теңдеуі.
- •2. Зат мөлшері деген не? Өлшем бірлігі. Авагадро саны нені көрсетеді?
- •3. Дәріханада 500 г 9%-тік ерітінді дайындау үшін ас тұзының және судың қандай массасы қажет?
- •1. Бейтараптану реакциясын теңдеулер арқылы көрсет
- •2. Бейорганикалық қосылыстар арасындағы генетикалық байланыс деген не? Мысалдарды теңдеу арқылы өрнекте.
- •1. Галогендердің атом құрылысы қандай агрегаттық күйінде қандай заңдылықтар болады?
- •2. Металдардың кернеу қатарын және оны қалай түсінесің?
3. Массасы 28 г. Литий суда ерігенде сутектің қанша көлемі түзіледі?
Шешуі:
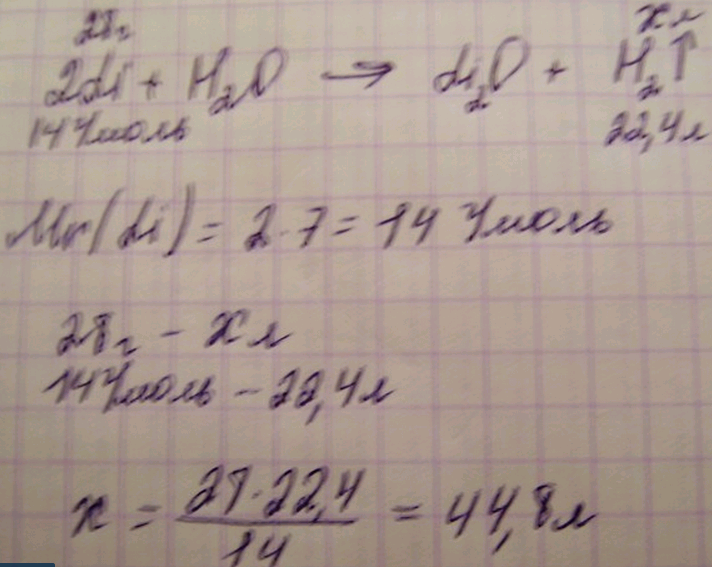
№20 Билет
1. Оттегі химиялық элементінің аллотропиясы қалай аталады? Қандай зат екендігін түсіндір.
Оттегінің аллотропиялық түр өзгерістері. Озон
Оттегі табиғатта екі түрлі жай зат күйінде кездеседі, оның бірі O2, екіншісі O3, ол озон деп аталады. Енді озонмен жете таныссақ, озон найзағай ойнағанда ауада пайда болады. Сонда электр зарядының әсерінен мына реакция жүреді:
3O2 → 2O3
Бір элементтің бірнеше жай зат күйінде болу құбылысы аллотропия деп аталады.
Озонның формуласы О3, салыстырмалы молекулалық массасы 48, оттегінен 1,5 есе ауыр (48 : 32 = 1,5), суда аз еритін, -112°С-да қайнайтын, -193°С-да балқитын газ күйінде қою-көк түсті, ал қатты күйінде көктен қара-күлгін түске дейін боялады.
Озонның химиялық қасиеттері
Озон оттегіне қарағанда химиялық белсенді зат. Ол тіпті алтын, күміс, платина сияқты асыл металдарды да тотықтыра алады (7-кесте).
6Ag + O3= 3Ag2O
Нөсер жаңбырдан кейін орманға барсақ, онда ауа тазарып дем алу жеңілдейді, себебі ауада пайда болған озон айырылып, ауаны тазартады. Озонның атмосферадағы мөлшері өте аз - 0,004%.
О3 →
O2 +
"О"
Озоннан молекулалық және атом күйіндегі оттек бөлінеді, соңғысы күштірек тотықтырғыш, ауадағы бактерияларды жояды. Озон осы қасиетіне қарай ауыз суды, құдыктарды, өндірістік сарқын суларды тазарту үшін (залалсыздандыру) және ағартқыш зат ретінде қолданылады. Атмосфераның жоғары қабатында, жерден 25 км биіктікте (стратосферада) күн сәулесінің әсерінен жерді қорғап тұратын өте жұқа озон қабаты әр түрлі кері әсерлердің салдарынан «тесіліп», сол жерлерден күннің ультракүлгін сәулелері жер бетіне жетіп, ондағы әр түрлі табиғи апаттарға әкеліп соғады. Олар: жер бетінің температурасының біртіндеп артуы, мәңгілік мұздақтар мен мұхиттардағы мұзтауларының еруі, терінің қауіпті ісігі көбейеді. Озонды зертханада озонатор деп аталатын құралда алуға болады.
Оттегі мен озонның салыстырмалы сипаттамалары
Оттегі (O2) Озон (O3)
Ауадан сәл ауыр, түссіз, иіссіз, суда нашар еритін газ (20°С-да судың 100 көлемінде оттегінің 3 көлемі, ал 0°С-да 5 көлемі ериді. Тыныс алу, жану, тотығу, шіру үдерістеріне қатысады. Ашық көк түсті өзіне тән иісі бар, суда жақсы еритін, ауадан 1,655 есе, оттегіден 1,5 есе ауыр газ. Озон оттегіне қарағанда химиялық белсенділігі жоғары зат, бактерицидтік, ағартқыштық қасиеттері бар. Ол озонның ыдырауы нәтижесінде атом күйіндегі оттек бөлінуімен түсіндіріледі: O3 ↔ O2 + "O". Концентрациясы 10-5%-дан артқанда улы болады.
Табиғатта озон найзағай жарқылдаған кезде және кейбір органикалық заттар тотыққанда түзіледі (Озоносфера қабаты). Таза озон – улы, микроорганизмдерді өлтіреді, сол себепті суды, ауаны дезинфекциялауда, күшті тотықтырғыш болғандықтан қағаз ағартуда, т.б. қолданылады.
2. Тотықтырғыш және тотықсыздандырғыш туралы түсінік
Реакция барысында электрондарын беретін атомдар, иондар және молекулалар тотықсыздандырғыш болып есептеледі.
Реакция барысында электрондардың берілуі тотығуға, ал электрондардың қосып алынуы тотықсыздануға жатады. Сол себепті тотығу-тотықсыздану реакцияларының нәтижесінде тотықсыздандырғыш электрондарын беріп, тотығады, ал тотықтырғыш электрондарды қосып алып, тотықсызданады.
Электрондардың тотықсыздандырғыштан тотықтырғышқа тасымалдануы барысында белгілі бір атомның, молекуланың немесе ионның тотығу дәрежесі өзгереді және тотығатын заттың тотығу дәрежесі жоғарылайды, ал тотықсызданатын заттікі-төмендейді.
Тотығу-тотықсыздану реакцияларын теңестірудің екі тәсілі бар, электронды баланс және ионды-электрондытәсілдері. 2 тәсілдің де негізі бірдей: ол-тотығу-тотықсыздану процесінде тотықсыздандырғыш берген электрондардың саны тотықтырғыш қосып алған электрондар санына тең болуы шарт.
Электронды баланс тәсілі:
Na2SO3+KmnO4+H2SO4→Na2SO4+MnSO4+K2SO4+H2O
Реакция кезінде тотығу дәрежесі өзгеретін элементтерді тауып, олардың үстіне жазамыз:
+4 +7 +6 +2
Na2SO3+KMnO4+H2SO4→Na2SO4+MnSO4+K2SO4+H2O
ТОТЫҚСЫЗДАНДЫРҒЫШ ТОТЫҚТЫРҒЫШ
S+4-2e=S+6
Mn+7+5e=Mn+2
Тотығу және тотықсыздану процесіне қатысушы заттардың коэффициенттері электрондық баланс тәсілінің шарты бойынша тотықсыздандырғыш берген, тотықтырғыш қосып алған электрондар санына тең болады:
5S+4-2e=S+6
2Mn+7+5e=Mn+2
Негізгі тотықтырғыштар мен тотықсыздандырғыштар. Медицинада қолданылуы. Практикада көп қолданылатын аса маңызды тотықтырғыштарға металл еместер (F2, Cl2, Br2, I2, O2), калий перманганаты KmnO4, калий дихроматы мен хроматы K2Cr2O7, K2CrO4, азот қышқылы және оның тұздары, концентрлі H2SO4, галогендердің құрамында оттегі бар қышқылдары және олардың тұздары (KClO3 -калий хлораты және KClO–гипохлориті), және жоғары тотығу дәрежедегі металл иондары, сутек ионы +1тотығу дәрежесінде (негізінен қышқылдардың құрамында).
Аса маңызды тотықсыздандырғыштарға кернеу қатарында сутектен бұрын орналасқан активті металдар (сілтілік және сілтілік жер металдар, Zn, Al, Fe), сондай-ақ кейбір металл еместер H2, C, P, Si, галогенсутектер, күкіртсутек(HCl, HBr, HI, H2S) және кейбір төменгі зарядты металл иондары (Sn2+, Fe2+, Cu+) жатады.
