
- •Государственный комитет Российской Федерации по высшему образованию
- •Председатель методического совета нпи________________ в.В. Дьяченко Содержание
- •Mетоды синтеза органических полимеров
- •Полимеризация
- •Поликонденсация
- •Особенности физико-химических свойств полимеров
- •Физические состояния полимеров
- •Физико-механические свойства полимеров и связь их со строением цепных макромолекул
- •Разветвленные полимеры
- •Пространственные полимеры
- •Старение полимеров
- •Свойства высокомолекулярных соединений и их растворов
- •Физико-химические свойства растворов полимеров
- •Природа растворов полимеров
- •Особенности процесса растворения полимеров
- •Особенности термодинамики растворов полимеров Умеренно концентрированные растворы
- •Разбавленные растворы полимеров
- •Коэффициент набухания макромолекулы
- •Молекулярно-массовые характеристики полимеров
- •Гидродинамические свойства макромолекул в разбавленных растворах
- •Справочные данные
- •Вискозиметр стеклянный капиллярный типа впж-2. Устройство и принцип работы
- •Экспериментальная часть Лабораторная работа 11 «Определение молекулярного веса веществ вискозиметрическим методом»
- •Лабораторная работа 11а «Определение молекулярного веса полиметилметокрилата»
- •Лабораторная работа 12 «Определение иэт желатина методом набухания»
- •Лабораторная работа 13 «Определение иэт желатина методом вязкости»
- •Контрольные вопросы
- •Литература
Особенности термодинамики растворов полимеров Умеренно концентрированные растворы
Под умеренно концентрированными растворами понимают растворы, в которых содержание полимера достаточно для установления одинаковой концентрации звеньев во всем объеме раствора.
Положение граничной области между разбавленным и умеренно концентрированным раствором зависит от степени полимеризации макромолекул и от природы полимера и растворителя. Для систем, с которыми чаще всего приходится иметь дело на практике такое состояние достигается уже при концентрациях раствора, не превышающих единиц процентов.
Отклонение от идеального поведения. В случае растворов низкомолекулярных веществ в низкомолекулярных растворителях условие Hсм= 0 означает их подчинение законам идеальных растворов.
При образовании идеального раствора тепло не выделяется и не поглощается; объем раствора равен сумме объемов компонентов, т. е. Vсм=0. Энтропия смешения для идеального раствора полностью определяется числом энергетически эквивалентных микросостояний, реализуемых путем всех возможных перестановок разнородных молекул в системе и называется геометрической или комбинаториальной. Она всегда положительна и равна
Sсм. ид = – k(N1 ln Х1 + N2 ln Х2) (2)
где Х1, Х2 – мольные доли компонентов;
N1, N2 – числа молекул компонентов;
k – постоянная Больцмана.
Растворы полимеров никогда не удовлетворяют всей совокупности этих условий. Они обнаруживают существенные отклонения от идеального поведения даже при Hсм = 0. Флори и Хаггинс вывели выражение для комбинаториальной энтропии смешения для атермического раствора модельных гибких цепей в низкомолекулярном растворителе:
Sсм. комб. = – k(N1 ln 1 + N2 ln 2) (3)
где 1, 2 – объемные доли растворителя и полимера.
Формула (3) отличается от формулы (2) тем, что в ней фактически учтен объем полимерной молекулы, который существенно больше объема молекулы растворителя. Следовательно, учет разницы в размерах гибких макромолекул и молекул растворителя уже предсказывает отклонение растворов полимеров от идеального поведения.
В термодинамике растворов отклонение от идеального поведения (например, от закона Рауля) называют положительным, когда парциальное давление растворителя над раствором больше, чем идеальное. В этом случае Gсм. > Gсм. ид, т. е. компоненты смешиваются хуже, чем в идеальном растворе. Отрицательным называют отклонение от закона Рауля, при котором парциальное давление растворителя над раствором меньше, чем идеальное. При этом Gсм. < Gсм. ид, т. е. компоненты имеют сродство друг к другу и смешиваются лучше, чем в идеальном растворе.
Атермический раствор полимера обнаруживает отрицательное отклонение от идеальности, поскольку из сопоставления уравнений (2) и (3) легко показать, что при одинаковой мольной концентрации растворенного вещества Sсм. комб > Sсм. ид и, следовательно, Gсм. < Gсм. ид .
Однако на самом деле при растворении полимера обычно Нсм. 0 и Vсм. 0. В свою очередь, наличие взаимодействия между компонентами приводит к их взаимной координации, и энтропия смешения в такой системе отличается от Sсм. комб. Для получения выражения для изменения энергии Гиббса при образовании реального раствора полимера, т. е. с учетом указанных факторов, используют выражение для Gсм атермического раствора, в которое вводят дополнительный член, содержащий некоторый безразмерный параметр :
Gсм. = RT(n1 ln 1 + n2 ln 2 + n12) (4)
где R – газовая постоянная;
n1, n2 – число молей растворителя и полимера.
Принимают, что параметр учитывают как энтальпийный, так и энтропийный вклад взаимодействия в Gсм .
Из уравнения (4) можно получить выражение для изменения химического потенциала растворителя при образовании полимерного раствора:
![]() (5)
(5)
где z – число звеньев в модельной цепи.
Это соотношение, несмотря на целый ряд допущений, сделанных при его выводе, удовлетворительно объясняет основные закономерности термодинамического поведения гибкоцепных полимеров.
Флори и Ренер провели теоретическое рассмотрение процесса набухания полимера сетчатого строения. Набухание такого полимера происходит до тех пор, пока осмотическая сила растворителя, проникающего в фазу полимера, не уравновесится упругой силой полимерной сетки. Поглощение растворителя набухающим полимером сопровождается увеличением энтропии растворителя за счет смешения его с полимером и уменьшением энтропии полимера из-за распрямления его цепей. Для изменения химического потенциала растворителя при набухании полимера сетчатого строения было получено выражение
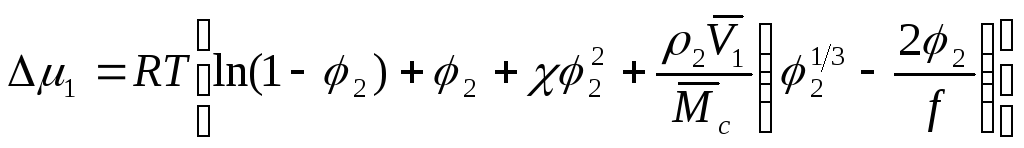
где 2 – объемная доля полимера в набухшем образце;
2 – плотность полимера;
![]() –парциальный
мольный объем растворителя;
–парциальный
мольный объем растворителя;
f – функциональность сетки (обычно принимают, что сетка тетрафункциональна, f = 4, т. е. каждый отрезок цепи ограничивается двумя узлами сетки);
![]() –молекулярная
масса отрезков цепей между соседними
узлами пространственной сетки.
–молекулярная
масса отрезков цепей между соседними
узлами пространственной сетки.
Учитывая,
что в равновесии 1
= 0, и зная параметр взаимодействия
(хи)
можно определить
![]() :
:
 (6)
(6)
Уравнение состояния полимера в растворе. Уравнением состояния называется уравнение, связывающее давление, объем, температуру, концентрацию и другие параметры системы, находящейся в равновесии. В общем виде это уравнение можно записать так: f(Р, T, V, ...) = 0.
В
случае раствора полимера уравнение
состояния связывает осмотическое
давление с температурой, концентрацией
раствора и индивидуальными характеристиками
компонентов. Осмотическое
давление раствора
связано с изменением химического
потенциала растворителя соотношением
![]() ;
поэтому, учитывая уравнение (5), можно
получить уравнение состояния раствора
полимера:
;
поэтому, учитывая уравнение (5), можно
получить уравнение состояния раствора
полимера:
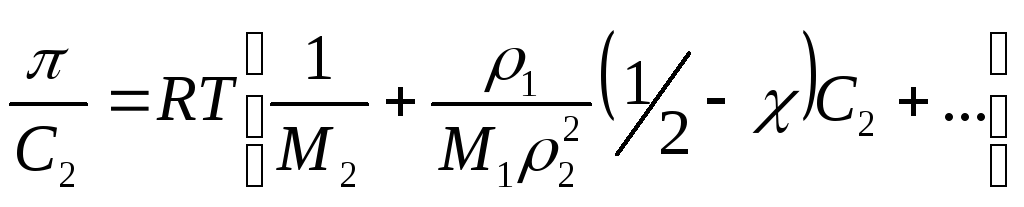 (7)
(7)
где С2 – концентрация полимера;
1 – плотность растворителя;
М1, М2 – молекулярные массы растворителя и полимера.
Измеряя зависимость от С2 и строя ее в координатах уравнения (7), можно определить значение М2. Уравнение (7) представляет собой частный случай вириального разложения.
В общем виде:
![]()
где А1 и А2 – вириальные коэффициенты.
Второй вириальный коэффициент учитывает отклонение раствора полимера от идеального поведения. При А2=0 уравнение (7) превращается в уравнение Вант-Гоффа для идеального раствора:
![]() .
.
Коэффициент А2 определяют по тангенсу угла наклона зависимости приведенного осмотического давления от концентрации раствора (рисунок 3). В выражение для А2 входит параметр взаимодействия полимер –растворитель . Поэтому коэффициент А2 существенно зависит от природы растворителя и, поскольку он при достаточно малых концентрациях полимера не зависит от концентрации, является удобной характеристикой термодинамического качества растворителя, т. е. термодинамического сродства компонентов раствора.
-состояние раствора полимера. В хороших растворителях А2 > 0, в плохих А2 < 0 (см. рис. 6). Из уравнения (7) следует, что А2 обращается в 0 при = 0,5.
Как уже отмечалось, параметр характеризует энергию взаимодействия Гиббса, т. е. учитывает как тепловые, так и ориентационные эффекты растворения. Поэтому можно представить в виде двух составляющих – энтальпийного (k1) и энтропийного (1 – пси):
![]() (8)
(8)
Здесь
параметр
![]() имеет размерность температуры и
называется
(тэта)-температурой.
Подставив (8) в (7), получим для А2:
имеет размерность температуры и
называется
(тэта)-температурой.
Подставив (8) в (7), получим для А2:
![]()
Отсюда видно, что при Т = коэффициент А2 = 0, т. е. раствор полимера ведет себя как идеальный. -температуру можно определить, экстраполируя зависимость А2 от температуры к А2 = 0.
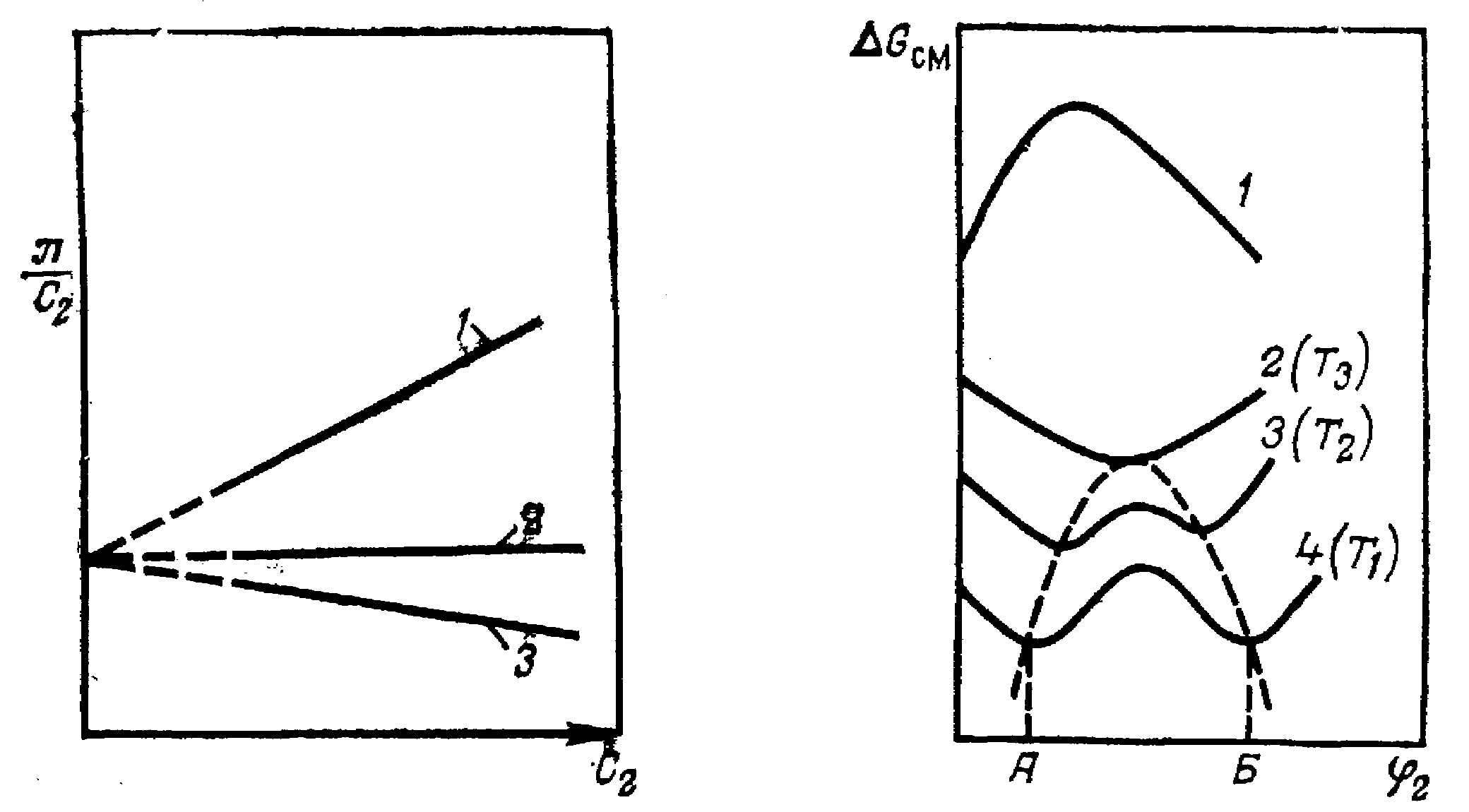
Рисунок
6 – Зависимость приведенного осмотического
давления раствора полимера
![]() от концентрации раствора С2:
от концентрации раствора С2:
1 – в хорошем растворителе, А2 > 0; 2 – в -растворителе, А2 =0; 3 – в плохом растворителе, А2 < 0.
Рисунок 7 – Зависимость Gсм системы полимер – растворитель от объемной доли полимера:
1 – компоненты не смешиваются; 2 – компоненты смешиваются во всех соотношениях; 3, 4 – компоненты частично смешиваются (Т1 < Т2 < Т3).
Состояние, в котором А2 = 0, называется -состоянием, а растворители, в которых оно может быть реализовано, называются (тэта)-растворителями.
Таким образом, в -состоянии, т. е. при -температуре в -рас-творителе, раствор полимера формально подчиняется законам идеальных растворов. Однако в отличие от растворов низкомолекулярных веществ это состояние для каждой данной системы реализуется лишь в определенных температурных точках. Поэтому его правильнее называть псевдоидеальным.
Изменение энергии Гиббса любого реального раствора можно представить в виде двух слагаемых:
Gсм = Gсм. ид. + GсмЕ
где GсмЕ – избыточное изменение энергии Гиббса, учитывающее отклонение от идеального поведения.
При GсмЕ > 0 наблюдается положительное отклонение от идеальности, при GсмЕ < 0 – отрицательное. В свою очередь:
Gсм = Hсм. – TSсмЕ
где SсмЕ – избыточное изменение энтропии.
Строго
говоря, раствор
называется идеальным
при
условии
GсмЕ=
0, Hсм.
= 0 и SсмЕ
=
0. Для растворов полимеров эти условия,
как уже отмечалось, в совокупности
никогда не реализуются. Однако
поведение реального раствора описывается
уравнениями для идеальных систем
также и в том случае, если условие
GсмЕ
=
0 выполняется за счет взаимной компенсации
энталь-пийного и энтропийного слагаемых,
т. е. Hсм.
= SсмЕ.
Для растворов полимеров, равно как
и для всех реальных газов и растворов,
в принципе существует некоторая
температура
![]() ,
при которой система ведет себя, как
идеальная. Все расчеты при этом значительно
упрощаются.
,
при которой система ведет себя, как
идеальная. Все расчеты при этом значительно
упрощаются.
Фазовые равновесия. В растворе полимера, как и во всякой однофазной молекулярно-дисперсной системе, всегда имеют мест гомофазные флуктуации концентрации. В определенных условиях могут возникнуть гетерофазные флуктуации, которые являются зародышами новой фазы и при небольшом изменении условий превращаются в новую пространственно протяженную фазу. В результате однофазный раствор разделяется на две фазы, одна из которых представляет собой более разбавленный, а другая – более концентрированный раствор по сравнению с исходным. Такие фазовые превращения характеризуются соответствующими изменениями термодинамических функций.
Флуктуáция, флюктуáция – [<лат. fluctuatio колебание] – случайное отклонение величины, характеризующей систему из большого числа частиц, от его среднего значения; например, временное, случайное отклонение от равномерного распределения молекул в газе или жидкости, возникающее в результате теплового движения.
Компоненты смешиваются во всех соотношениях, когда Gсм < 0 для любого состава раствора (рисунок 7). Если компоненты совсем не смешиваются, то Gсм > 0, и система двухфазна во всей области составов, причем каждая фаза представляет собой чистый компонент. Если же компоненты смешиваются частично, то в области составов, где они не смешиваются (участок АБ на рисунке 7), сосуществуют две фазы, состав которых определяется общей касательной к двум минимумам на кривой зависимости Gсм от состава. В остальной области составов система однофазна. Взаимная смешиваемость компонентов существенно зависит от температуры. Например, для многих систем область ограниченной растворимости компонентов уменьшается с повышением температуры, и при некоторой температуре (Т3 на рисунке 7) наблюдается полная смешиваемость. Эта температура и является верхней критической температурой растворения. Соединив плавной кривой точки, отвечающие составам фаз, находящихся в равновесии при разных температурах и ВКТР, получим диаграмму состояния системы полимер – растворитель (так называемую бинодаль). При температуре Т1 (см. рисунок 7) зависимость Gсм от состава имеет два минимума и один максимум. С повышением температуры все эти точки сближаются, пока не сольются в одну точку. Поэтому критической температуре соответствуют равенства:

Используя выражение (4), находят критическое значение параметра . Его подставляют в уравнение (8) и, решая последнее уравнение относительно Ткр, получают:
![]() (9)
(9)
где Р – степень полимеризации полимера.
Таким образом, критическая температура растворения полимера зависит от степени полимеризации, т. е. от молекулярной масс полимера и с увеличением молекулярной массы смещается сторону более высоких температур и меньших концентраций раствора (рисунок 8).
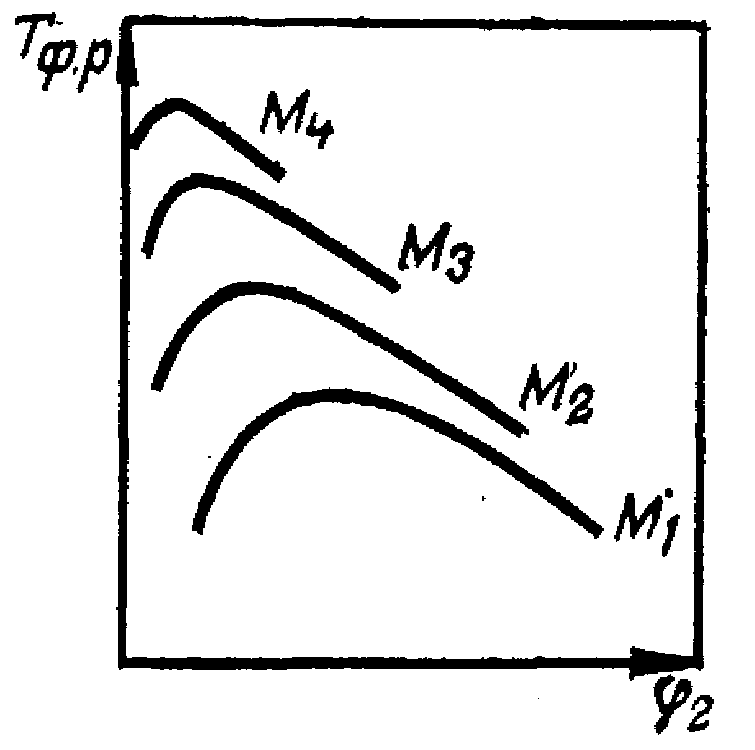
Рисунок 8 – Зависимость температуры фазового расслоения системы полимер – растворитель от объемной доли полимера разных молекулярных масс (М1 < М2 < М3 < М4).
Уравнение (9) получено на основе теории Флори – Хаггинса, которая в силу несовершенства некоторых исходных посылок предсказывает существование только одной критической температуры, а именно ВКТР; поэтому в данном случае речь идет о вктр.
На основании уравнения (9) можно дать еще одно определение -температуры как верхней критической температуры растворения полимера бесконечно большой молекулярной массы.
Если система полимер – растворитель обладает и ВКТР и НКТР, то ей должны быть свойственны две -температуры (рисунок 9, а).
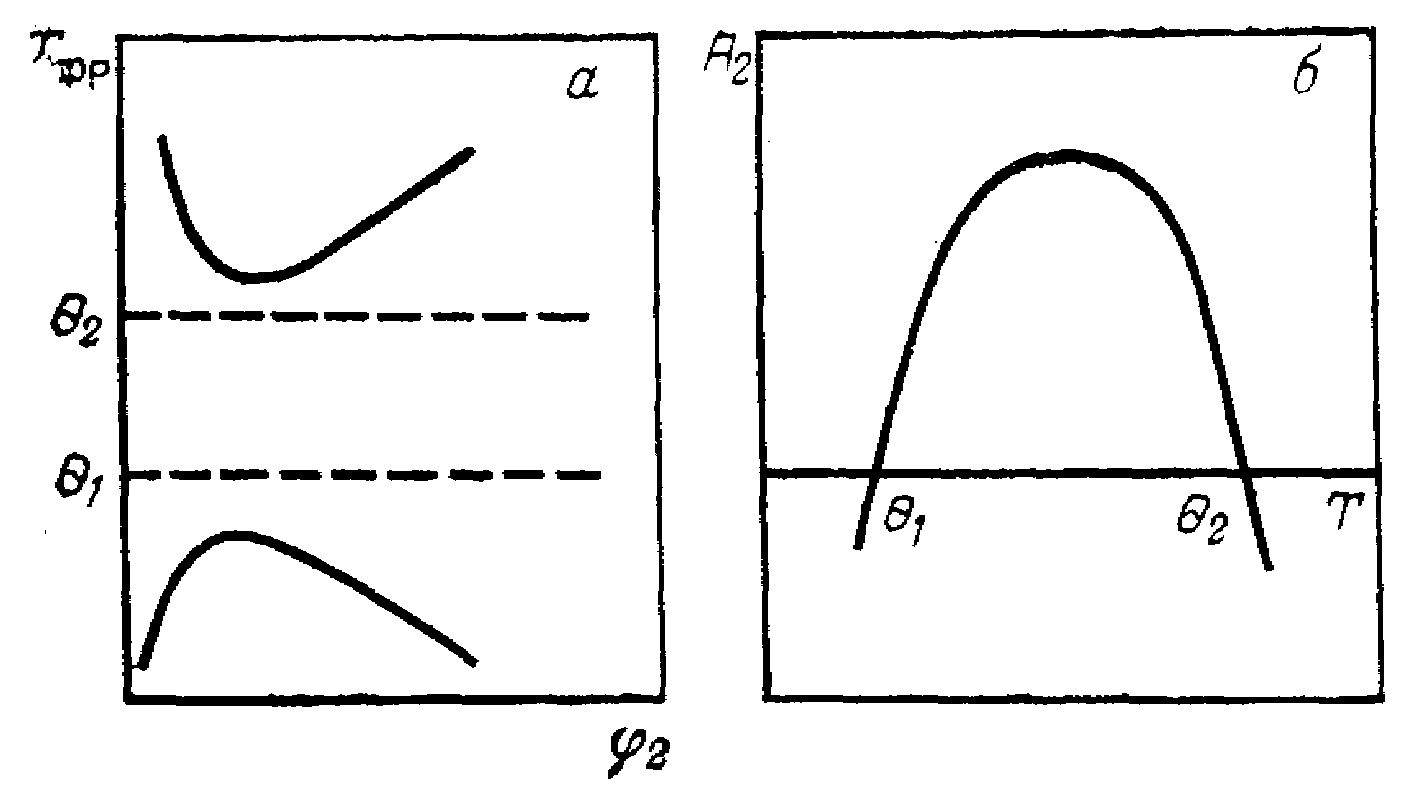
Рисунок 9 – Зависимость температуры фазового расслоения системы полимер – растворитель от объемной доли полимера (а) и второго вириального коэффициента раствора полимера от температуры (б).
При этом качество растворителя, о котором можно судить по коэффициенту А2, будет изменяться по кривой с максимумом в зависимости от температуры (рисунок 9, б). В области между 1 и 2, где данный растворитель является для полимера хорошим, растворы полимеров обнаруживают отрицательное отклонение от идеальности (GсмЕ < 0), тогда как при температурах ниже 1 и выше 2 растворитель является плохим, и отклонение от идеальности становится положительным. С увеличением молекулярной массы полимера ВКТР повышается, а НКТР снижается. Поэтому для полимера одной и той же молекулярной массы критические температуры могут служить мерой качества растворителя: чем ниже ВКТР и выше НКТР, тем лучше растворитель, шире область гомогенного раствора.
