
- •Государственный комитет Российской Федерации по высшему образованию
- •Председатель методического совета нпи________________ в.В. Дьяченко
- •1. Сорбция в природе и технике
- •1.1 Сорбция в природе
- •1.1.1 Сорбция химических веществ почвой
- •1.1.1.1. Поглотительная способность почвы
- •1.1.1.2 Почвенный поглощающий комплекс (ппк)
- •1.1.1.3 Сорбция анионов почвами
- •1.1.1.4 Натриевое адсорбционное отношение (или показатель адсорбируемости натрия)
- •1.1.1.5 Фиксация катионов почвами
- •1.1.1.6 Загрязнение тяжелыми металлами (фтор мышьяк)
- •1.1.1.7 Ионный обмен
- •1.1.1.8 Обменные катионы
- •1.1.1.9 Обменные анионы
- •1.1.2 Сорбция химических веществ в океане
- •1.2 Применение процессов сорбции в промышленности
- •1.3 Сорбционные методы удаления токсичных веществ из организма
- •Адоробция из растворов на границе раздела твердое тело – жидкость (г–ж)
- •2.1.1 Молекулярная адсорбция
- •2.1.2 Адсорбция ионов
- •2.1.3 Хроматография
- •2.2 Лабораторные работы
- •2.3 Контрольные вопросы
- •2.4 Задачи
- •3 Лабораторные работы и задачи, предлагаемые [12]
- •3. 1 Адсорбционные равновесия
- •3.2 Лабораторные работы
- •Порядок выполнения работы
- •Адсорбционного слоя»
- •Порядок выполнения работы
- •Порядок выполнения работы
- •Порядок выполнения работы
- •Часть 1. Определение пое смолы ку-2.
- •Часть 2. Определение константы ионного обмена
- •3.3 Контрольные вопросы и задачи Адсорбция на границе твердое тело–газ
- •Адсорбция на границе жидкость–газ
- •Адсорбция на границе жидкость–Твердое тало
- •Используемая литература
1.2 Применение процессов сорбции в промышленности
Адсорбционные процессы – наиболее распространенный способ очистки газов от газовых примесей. В них используется явления различной растворимости газов, химические реакции, когда в адсорбционной жидкости (обычно вода) применяются такие реагенты, которые образуют с улавливаемым компонентом химическое соединение.
Адсорбционные методы очистки газов основаны на способности мелкопористых адсорбентов (активные угли, силикагели, алюмогели, пористые стекла и т.п.) улавливать их газовой фазы при соответствующих условиях те или иные вредные компоненты.
Сорбционные методы используются для улавливания из сточных вод: цианидов, меди, цинка, хрома, фенола [7].
Адсорбционная очистка нефтепродуктов, осуществляется для обеспечения их заданного группового состава, улучшения физико-химических свойств и эксплуатационных характеристик [8].
Типичные адсорбционные процессы очистки газов и паров, извлечения ценных примесей, гетерогенного катализа, хроматографического анализа смесей и другие процессы, происходящие на поверхности твердых тел, широко используются в самых различных отраслях народного хозяйства и требуют глубокого и внимательного изучения. [9].
1.3 Сорбционные методы удаления токсичных веществ из организма
С 1960-х годов сорбционные методы используют для прижизненного удаления токсических веществ из биологических жидкостей. С этой целью через слой сорбента пропускают кровь, плазму и лимфу. Соответственно эти процессы называют гемо-, плазмо- и лимфодиффузией. Иногда их называют гемо-, плазмо- и лимфосорбцией. Гемосорбция была первым методом, использованным для лечения отравлений. Техника этой процедуры достаточно проста: цельную кровь, взятую из артериальной системы организма, пропускают через колонку с адсорбентом, после чего вновь возвращают в организм.
Недостатком гемосорбции является прямой контакт сорбента с клеточными частицами крови (эритроцитами, тромбоцитами, лейкоцитами) в результате чего некоторые виды адсорбентов могут вызвать травму клеток. Поэтому применяют смешанные методы очистки. Чисто сорбционный характер очистки сохраняется, если через сорбент пропускать не цельную кровь, а бесклеточную среду – плазму.
2 ЛАБОРАТОРНЫЕ РАБОТЫ [14-17]: теория, методика проведения работ и обработки практических результатов; контрольные вопросы [11]
Адоробция из растворов на границе раздела твердое тело – жидкость (г–ж)
2.1.1 Молекулярная адсорбция
Адсорбция неэлектролитов и слабых электролитов на границе раздела т-ж носит молекулярный характер и подчиняется уравнению Гиббса. Если растворенное вещество (адсорбтив) адсорбируется в большем количестве, чем растворитель, то адсорбция его положительна. При большей адсорбции растворителя адсорбция отрицательна. Поэтому изотерма адсорбции из растворов кажущаяся.
Для адсорбции из растворов установлен ряд закономерностей. Адсорбция органических веществ одного и того же гомологического ряда подчиняется правилу Траубе. На пористых адсорбентах наблюдается обращение привила Траубе; адсорбция падает с ростом длины цепи, так как с возрастанием размера молекул уменьшается доступная для адсорбции площадь адсорбента; крупные молекулы не могут попасть в узкие поры адсорбента. При адсорбции на границе т-ж по правилу уравнивания полярностей, сформулированному Ребиндером, вещество адсорбируется на границе раздела фаз только в том случае, если в результате его присутствия в поверхностном слое разность полярностей фаз уравнивается.
Для измерения адсорбции в одинаковые объемы растворов адсорбируемого вещества разной концентрации вносят точную навеску адсорбента. Затем определяют равновесную концентрацию после адсорбции. Количество адсорбированного вещества вычисляют как разность начальной и равновесной концентрации в данном объеме раствора. В разбавленных растворах адсорбцию растворителя обычно не учитывают.
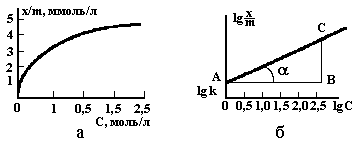
![]()
Рисунок 1 – Изотерма абсорбции на границе раздела т-ж (а) и графическое определение констант в уравнении Фрейндлиха – Бедекера (б)
По экспериментальным данным строят кривую – изотерму адсорбции, выражающую зависимость массы адсорбированного вещества от равновесной концентрации его в растворе. Массу адсорбированного вещества относят не к единице поверхности, а к единице массы адсорбента (рисунок 1). Вид изотермы, получаемой при образовании мономолекулярного слоя на непористых адсорбентах, хорошо соответствует уравнению Лэнгмюра. Адсорбция на пористых адсорбентах из разбавленных растворов описывается эмпирическим уравнением, предложенным Бедекером и Фрейндлихом:
![]() ,
,
где
![]() –масса
адсорбированного вещества на единицу
массы адсорбента ммолъ/г; с
–
равновесная концентрация, ммолъ/л; k
–
константа, соответствующая массе
адсорбированного вещества при равновесной
концентрации, равной единице; n
– константа
(n
= 0,1 – 0,5).
–масса
адсорбированного вещества на единицу
массы адсорбента ммолъ/г; с
–
равновесная концентрация, ммолъ/л; k
–
константа, соответствующая массе
адсорбированного вещества при равновесной
концентрации, равной единице; n
– константа
(n
= 0,1 – 0,5).
Чтобы найти k и n, уравнение логарифмируют
![]()
Наносятся
значения
![]() по
оси ординат, a
lgс
–
по оси абсцисс, получают прямую линию
(рисунок 1, б). Отрезок ОА, отсекаемый
прямой на ординате, дает значение lgk,
а тангенс угла наклона прямой к оси
абсцисс (tg)
–
n.
Уравнение применимо для растворов
адсорбтива средних концентраций.
по
оси ординат, a
lgс
–
по оси абсцисс, получают прямую линию
(рисунок 1, б). Отрезок ОА, отсекаемый
прямой на ординате, дает значение lgk,
а тангенс угла наклона прямой к оси
абсцисс (tg)
–
n.
Уравнение применимо для растворов
адсорбтива средних концентраций.
