
Глава 2. Экспериментальная часть
Объектом изучения служил сбор «Арфазетин», производитель ОАО «Красногорсклексредства», серия 10112
В качестве экстрагента при получении извлечения использовался спирт этиловый 70%.
Аппаратура, используемая в работе
1. перколятор
2. аналитические весы
3. весы ручные
4. сушильный шкаф
5. центрифуга
6. спиртомер бытовой ДИАС
Задачами для выполнения работы было создание новой лекарственной формы (водно-спиртовое извлечение из сбора «Арфазетин»), ее качественный и количественный анализ, проведение испытаний согласно общей фармакопейной статье ГФ XI издания «Настойки», а также сравнительный анализ содержания действующих веществ в полученном водно-спиртовом извлечении и водном извлечении, изготовленном согласно инструкции к медицинскому применению сбора.
Методика получения настойки
Для получения настойки использовали:
Лекарственный растительный сбор «Арфазетин»
Экстрагент - спирт этиловый 96%, разведенный до концентрации 70% согласно ГФ XI.
Разведение спирта производилось согласно таблице, указывающей в целых числах весовые (в граммах) количества воды и спирта различной крепости, которые необходимо смешать, чтобы получить 1 кг спирта крепостью 30%, 40%, 50%, 60%, 70%, 80%, 90% и 92% ГФ XI издания.
Спирт этиловый 96% - 665,0 г
Вода очищенная - 335,0 г
Таким образом, для приготовления 200 мл 70% спирта этилового необходимо взять: 133,0 г спирта этилового 96% и 67,0 г воды очищенной.
Для получения водно-спиртового извлечения использовали соотношение сырье : экстрагент – 1:10.
Получение настойки осуществляли методом перколяции в 3 стадии:
I стадия - намачивание сырья. 20,0 г сбора «Арфазетин», поместили в емкость для намачивания, залили 200 мл спирта этилового 70% и оставили на 4-5 часов, предварительно закрыв ёмкость. За этот период осуществляется капиллярная пропитка сырья, происходит образование концентрированного внутриклеточного сока (первичного сока).
II стадия – мацерационная пауза (настаивание). Набухший материал загрузили в мешок из фильтрующего материала, поместили в перколятор на ложное дно с оптимальной плотностью, чтобы в сырье оставалось как можно меньше воздуха; наверх положили груз, чтобы максимально вытеснить воздух, затем сырье залили экстрагентом до образования «зеркала», высота слоя над сырьем получилась равной 30 мм. Настаивание осуществляли в течение 48 часов для наиболее полного извлечения действующих веществ. На этой стадии происходит выход экстрактивных веществ в экстрагент, образуется пограничный слой.
III стадия – перколация. Осуществили процеживание экстрагента через слой сырья.
Очистку полученного нового извлечения производили отстаиванием при температуре 80C в течение 24 часов до получения прозрачной жидкости, осадок (5 мл) сливали. Объём извлечения на выходе получился 170 мл.
Общие испытания проводили согласно общей фармакопейной статье ГФ XI издания «Настойки».
Проверку органолептических признаков проводили визуальным методом - оценивали вкус, цвет и запах извлечения. В результате испытания обнаружили – вкус специфический горьковато-сладкий, соответствующий компонентам, входящим в состав сбора, цвет красновато-коричневый, запах характерный, резкий, ароматный.
Количественное определение спирта проводили, используя спиртомер (ALCOHOLOMETER) бытовой ДИАС 0 – 96% об., по следующей методике: во флакон 100 мл с исследуемым извлечением, наполненным на 2/3, плавно опускали спиртомер таким образом, чтобы прибор не касался стенок и дна флакона. После того как спиртометр установился в стационарном положении, наблюдали по шкале содержание спирта в исследуемом водно-спиртовом извлечении по линии совмещения нижнего мениска жидкости с делением шкалы. В результате эксперимента установили, что концентрация спирта этилового составила 67%.
Содержание экстрактивных веществ(сухого остатка) определяли по методике ГФ XI: 5 мл настойки поместили во взвешенный бюкс высотой 2-3 см и диаметром 5-7 см, выпарили на водяной бане, затем высушили в сушильном шкафу при температуре 100-1050С в течение 3 часов до постоянной массы.
В результате эксперимента удалось определить, что содержание сухого остатка в извлечении: составляет 0,2624±0,000252 г.
Содержание тяжелых металлов определяли по методике: к 10 мл извлечения прибавляли 1 мл разведенной уксусной кислоты, 2 капли раствора сульфида натрия, перемешали и через 1 минуту сравнили с эталоном, состоящим из 10 мл 0,00005% раствора ацетата свинца и такого же количества реактивов, какое добавлено к испытуемому раствору. Наблюдение окраски производили по оси пробирок диаметром около 1,5 см, помещенных на белой поверхности. Окраска, появившаяся в испытуемом растворе, не превышала эталон, была заметна лишь слабая опалесценция от серы, выделяющейся из сульфида натрия.
Качественный анализ действующих веществ проводили по следующим методикам:
1) Обнаружение дубильных веществ согласно ГФ XI издания: к 2 мл извлечения добавляли несколько капель раствора железоаммониевых квасцов, результатом эксперимента явилось черно-зеленое окрашивание раствора.
2) Обнаружение органических кислот также проводили согласно методикам в ГФ XI издания:
Щавелевая кислота: к 2 мл извлечения добавили 4 капли раствора кальция сульфата насыщенного, в результате образовался осадок растворимый в соляной кислоте и не растворимый в уксусной кислоте.
Янтарная кислота: к 1 мл извлечения добавили несколько кристалликов резорцина, затем по стенке пробирки добавили 0,5 мл концентрированной серной кислоты, охладили и добавили 0,5 мл 10% раствора гидроксида аммония, зеленая флуоресценция не появилась.
Лимонная кислота: 1 мл извлечения помещали в выпарительную чашку, добавляли несколько кристалликов ванилина и выпаривали досуха. К остатку добавляли 2 капли концентрированной серной кислоты, нагревали на водяной бане, в результате реакции появилось фиолетовое окрашивание.
Яблочная кислота: к 2 мл извлечения добавили 0,1 мл β-нафтола и 1каплю концентрированной серной кислоты. Опустили пробирку на 1/2 мин в кипящую водяную баню, в результате реакции наблюдалась ярко-желтая с зеленым флуоресценция.
Винная кислота: 4 капли извлечения выпаривали досуха в фарфоровой чашке, добавляли 1 мл концентрированной серной кислоты и несколькими кристалликами резорцина, нагревали на водяной бане, в результате реакции вишнево-красное окрашивание не появилось.
3) Качественное обнаружение полисахаридов проводили согласно методике (ГФ XI): К 10 мл извлечения прибавляли 30 мл 95 % спирта и перемешивали; появились хлопьевидные сгустки, выпавшие в осадок при стоянии. Затем часть осадка переносили в пробирку, прибавляли 2 мл разведенной хлористоводородной кислоты, нагревали на водяной бане, затем прибавляли 10 мл реактива Фелинга и снова нагревали. В результате реакции образовался оранжево-красный осадок.
4) Качественное обнаружение флавоноидов проводили согласно ГФ XI издания:
1. общей реакцией на флавоноидные соединения является цианидиновая проба – 10 мл извлечения выпаривали до объема 2 мл, прибавляли 3 капли концентрированной хлористоводородной кислоты, затем добавляли 0,05 г цинковой пыли и нагревали на водяной бане до кипения. В результате реакции жидкость приобрела красный цвет.
2. взаимодействие с щелочами: к 10 мл извлечения добавляли 2 мл NaOH, наблюдалось желтое окрашивание.
Количественное определение извлечения проводили на органические кислоты, дубильные вещества, полисахариды и флавоноиды в соответствии с методиками, регламентированными ГФ XI (выпуск 2).
1)Содержание органических кислот определяли методом алкалиметрии по методике: 5 мл извлечения помещали в колбу на 500 мл, прибавляли 200 мл воды очищенной, 1 мл 1% спиртового раствора фенолфталеина, 2 мл 0,1% метиленового синего и титровали 0,1 моль/л натрия гидроксидом до появления лилово-красной окраски.
Содержание свободных органических кислот в пересчете на яблочную кислоту в процентах вычисляли по формуле (1):
 ……………………….(1)
……………………….(1)
0,0067 - титр;
V - объем титранта, мл;
К - коэффициент пересчета;
Х - процентное содержание органических кислот.
Получили следующие данные: Vср = 3,47 мл
Процентное содержание органических кислот в водно-спиртовом извлечении составило 0,4649 ± 0,002498%
2) Содержание дубильных веществ определяли методом перманганатометрии по методике:25 мл извлечения помещали в колбу на 1 л., прибавляли 500 мл воды очищенной, 25 мл раствора индигосульфокислоты и титровали при постоянном перемешивании 0,02 моль/л раствором калия перманганата до золотисто-желтого окрашивания.
Содержание дубильных веществ в пересчете на танин вычисляли по формуле (2):
 (2)
(2)
Х - процентное содержание дубильных веществ;
V1 - объем титранта
V2 - объем, пошедший на титрование в контрольном опыте
0,004157- титр
K- коэффициент пересчета
В результате эксперимента были получены следующие данные:
V1=8,23 мл; V2 =2,12 мл
Процентное содержание дубильных веществ в водно-спиртовом извлечении составило 1,306 ± 0,00225%
3)Содержание полисахаридов определяли по методике: 25 мл извлечения помещали в центрифужную пробирку, прибавляли 75 мл 95% спирта, перемешивали, подогревали на водяной бане до 300С в течение 5 минут. Через час содержимое центрифугировали с частотой вращения 5000 об/мин в течение 30 минут. Осадок количественно перенесли на фильтр и последовательно промывали 15 мл раствора 95% спирта в воде (3:1), 10 мл ацетона , 10 мл этилацетата. Фильтр с осадком высушивали сначала на воздухе, затем при температуре 100-1050Сдо постоянной массы.
Содержание полисахаридов в процентах (Х) вычисляли по формуле (3):
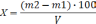 (3)
(3)
m1- масса фильтра в граммах;
m2- масса фильтра с осадком в граммах;
V- объем извлечения
В результате исследования были получены следующие данные:
m(1)=1,0289 г, m(2)=2,3807 г.
Процентное содержание полисахаридов в водно-спиртовом извлечении составило 5,4072 ± 0,00411%
4) Содержание флавоноидов определяли методом спектрофотометрии по методике: 2 мл извлечения помещали в мерную колбу вместимостью 25 мл, прибавляли 2 мл 5% раствора алюминия хлорида, 6 капель кислоты хлористоводородной разведенной, доводили объем раствора до метки 95% спиртом этиловым и перемешивали. Через 45 минут измеряли оптическую плотность раствора на спектрофотометре СФ-46 при длине волны 410 нм в кювете с толщиной слоя 10 мм. В качестве раствора сравнения использовали смесь, состоящую из 2 мл извлечения, 6 капель кислоты хлористоводородной разведенной и доведенной 95% этанолом в мерной колбе до 25 мл. Параллельно измеряли оптическую плотность раствора РСО рутина в 95% спирте этиловом.
Приготовление раствора РСО рутина: около 0,025 г (точная навеска) рутина, предварительно высушенного при температуре 130-1350С в течение 3-х часов, растворяли в мерной колбе вместимостью 50 мл в 95% спирте этиловом. 1 мл полученного раствора переносили в мерную колбу вместимостью 25 мл, добавляли 1 мл 5% раствора алюминия хлорида и 6 капель кислоты хлористоводородной разведенной и доводили до метки 95% спиртом этиловым.
Содержание суммы флавоноидов (Х) в пересчете на рутин определяли по формуле (4):
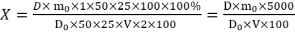
 (4)
(4)
где D - оптическая плотность испытуемого раствора;
D0 - оптическая плотность раствора РСО рутина;
V – объем извлечения, мл;
m - навеска РСО рутина, г;
(рутина)=0,0257г
D0 = 0,402
D = 1,124
В результате исследования установили, что содержание флавоноидов в анализируемом извлечении в пересчете на рутин составило 1,7964±0,00145%
Количественное содержание всех действующих веществ в полученном водно-спиртовом извлечении представлено на рисунке 1.
 Рисунок
1 – Количественное содержание действующих
веществ в полученном водно-спиртовом
извлечении
Рисунок
1 – Количественное содержание действующих
веществ в полученном водно-спиртовом
извлечении
Для проведения сравнительного анализа содержания действующих веществ в настойке, использовали данные количественного содержания органических кислот (0,084%), дубильных веществ (0,285%) и полисахаридов (1,966%) в водном извлечении, изготовленном согласно инструкции к медицинскому применению сбора «Арфазетин», полученные ранее при выполнении дипломной работы Куликовой С.И. на кафедре УЭФ Тверской ГМА в 2011 году.
В результате сравнительного анализа содержания органических кислот было установлено, что в водно-спиртовом извлечении их процентное содержание составило 0,4649±0,002498%, что в 5,5 раза больше, чем в водном извлечении (0,084%) (рисунок 2)
 Рисунок
2
–
Сравнительная характеристика
количественного содержания органических
кислот в полученном водно-спиртовом
извлечении и водном извлечении,
изготовленном согласно инструкции к
медицинскому применению сбора.
Рисунок
2
–
Сравнительная характеристика
количественного содержания органических
кислот в полученном водно-спиртовом
извлечении и водном извлечении,
изготовленном согласно инструкции к
медицинскому применению сбора.
В результате количественного анализа дубильных веществ было установлено, что в водно-спиртовом извлечении их процентное содержание составило 1,306±0,00225%, что в 4,6 раза больше, чем в водном извлечении (0,285%) (рисунок 3)
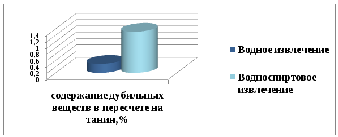 Рисунок
3
–
Сравнительная характеристика
количественного содержания дубильных
веществ в полученном водно-спиртовом
извлечении и водном извлечении,
изготовленном согласно инструкции к
медицинскому применению сбора.
Рисунок
3
–
Сравнительная характеристика
количественного содержания дубильных
веществ в полученном водно-спиртовом
извлечении и водном извлечении,
изготовленном согласно инструкции к
медицинскому применению сбора.
В результате количественного анализа полисахаридов было установлено, что в водно-спиртовом извлечении их процентное содержание составило 5,4072±0,00411%, что в 1,24 раза больше, чем в водном извлечении (4,362%) (рисунок 4).
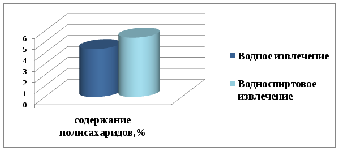
Рисунок 4 – Сравнительная характеристика количественного содержания органических кислот в полученном водно-спиртовом извлечении и водном извлечении, изготовленном согласно инструкции к медицинскому применению сбора.
